腹腔镜辅助双通道重建术治疗食管胃交界部腺癌
2019-06-21刘军强宋伟安岳彩迎赵嘉华范博士王振华陈思禹龚太乾
查 鹏,刘军强,宋伟安,岳彩迎,赵嘉华,范博士,王振华,陈思禹,龚太乾
因食管胃交界部腺癌(adenocarcinoma of esop-hagogastric junction,AEGJ)解剖位置的特殊性,在较长时间里,AEGJ分类、手术入路、切除范围及消化道重建方法均存在较大争议[1]。胸外科采用左侧开胸入路、食管部分切除术、近端胃大部切除术、食管胃左胸吻合术,存在手术创伤大、术后并发症多、胃食管反流重、生活质量差的缺点;普通外科采用经腹入路、全胃切除术、空肠重建术,存在吻合口并发症多、生活质量差的缺点[2]。
对AEGJ患者,我们过去采用左侧开胸食管部分切除术、近端胃大部切除术、食管胃左胸吻合术,2015年7月起,开始实施腹腔镜辅助近端胃大部切除术、限制性双通道空肠重建术,取得了不错的效果。本研究对接受不同手术方式的患者进行回顾性分析,评估腹腔镜辅助近端胃大部切除术、限制性双通道空肠重建术的安全性和可行性。
1 资料与方法
1.1 临床资料 2010年1月—2018年12月,解放军总医院第六医学中心胸外科共手术治疗符合入排标准的AEGJ患者89例,男性71例,女性18例。患者年龄46~78岁。纳入标准:年龄18~79岁,男女不限,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ-Ⅱ级;于解放军总医院第六医学中心胸外科接受根治性手术治疗的SiewertⅡ型AEGJ患者。排除标准:①ASA分级≥Ⅲ级;②手术方式为右胸+腹部切口(Ivor-Lewis)或颈胸腹切口(Mckeown);③既往行胃大部切除手术。
60例接受左侧开胸手术的患者作为对照组,29例接受腹腔镜辅助限制性双通道空肠重建术的患者作为观察组。因为2组患者样本量差别较大,为消除2组患者基线资料的统计学差异,对2组患者临床基线资料进行倾向匹配分析(1:2),最终匹配出26例观察组患者和52例对照组患者。在进行倾向匹配分析前后,对照组和观察组患者的临床基线资料情况如表1所示。
以上资料通过HIS收集,2015年9月以前手术患者,出院后通过电话随访;2015年9月以后手术患者,出院后通过零氪数据库进行随访;随访资料截至2018年12月31日。
1.2 手术方法 左侧开胸食管部分切除术、近端胃大部切除术、食管胃左胸吻合术:左侧第7肋间后外侧切口进胸,游离食管,清扫纵隔淋巴结;切开膈肌,游离胃,清扫腹腔淋巴结,将胃上提至左胸腔,以直线型切割缝合器行近端胃大部切除,制作管状胃,于肿瘤上方5~8 cm处切断食管,行食管胃端侧机械吻合。
腹腔镜辅助食管部分切除术、近端胃大部切除术、限制性双通道空肠重建术:患者仰卧位,经腹部5个切口置入戳卡,腹腔镜下游离胃及下段食管,并清扫腹腔及下纵隔淋巴结;将剑突下切口延长至5~10 cm,距肿瘤上方5 cm处切断食管,置入圆形吻合器底座,于体外以直线型切割缝合器行近端胃大部切除术,制作管状胃;Treitz韧带远端15 cm处切断空肠,将远端空肠封闭,远端空肠距断端10 cm处,远端空肠与食管行食管空肠端侧机械吻合,食管空肠吻合口远端10 cm处远端空肠与胃小弯行端侧吻合;胃空肠吻合口远端30 cm处,近端空肠与远端空肠行端侧吻合[2]。图1。
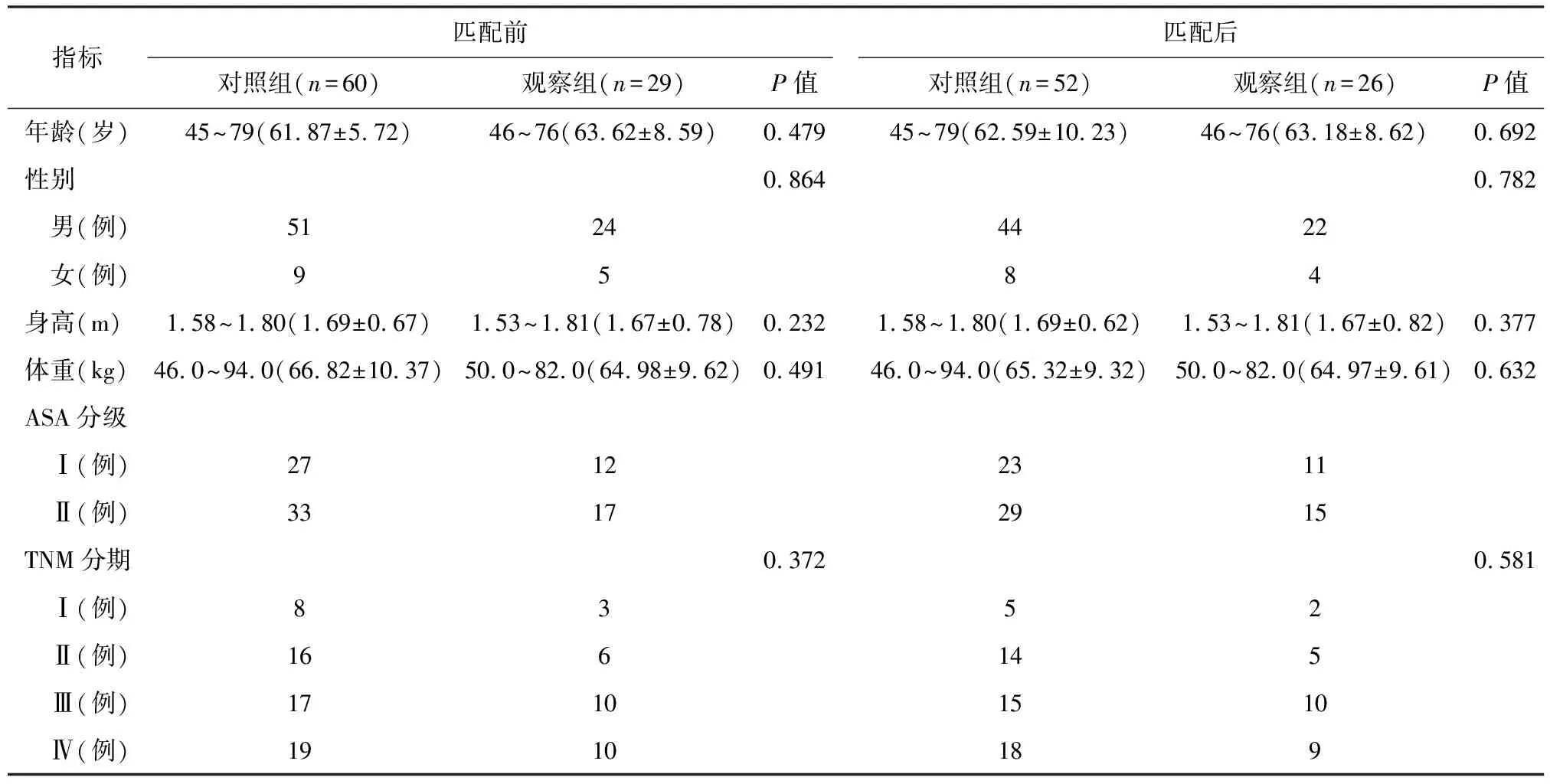
表1 倾向匹配前后2组患者基线资料比较
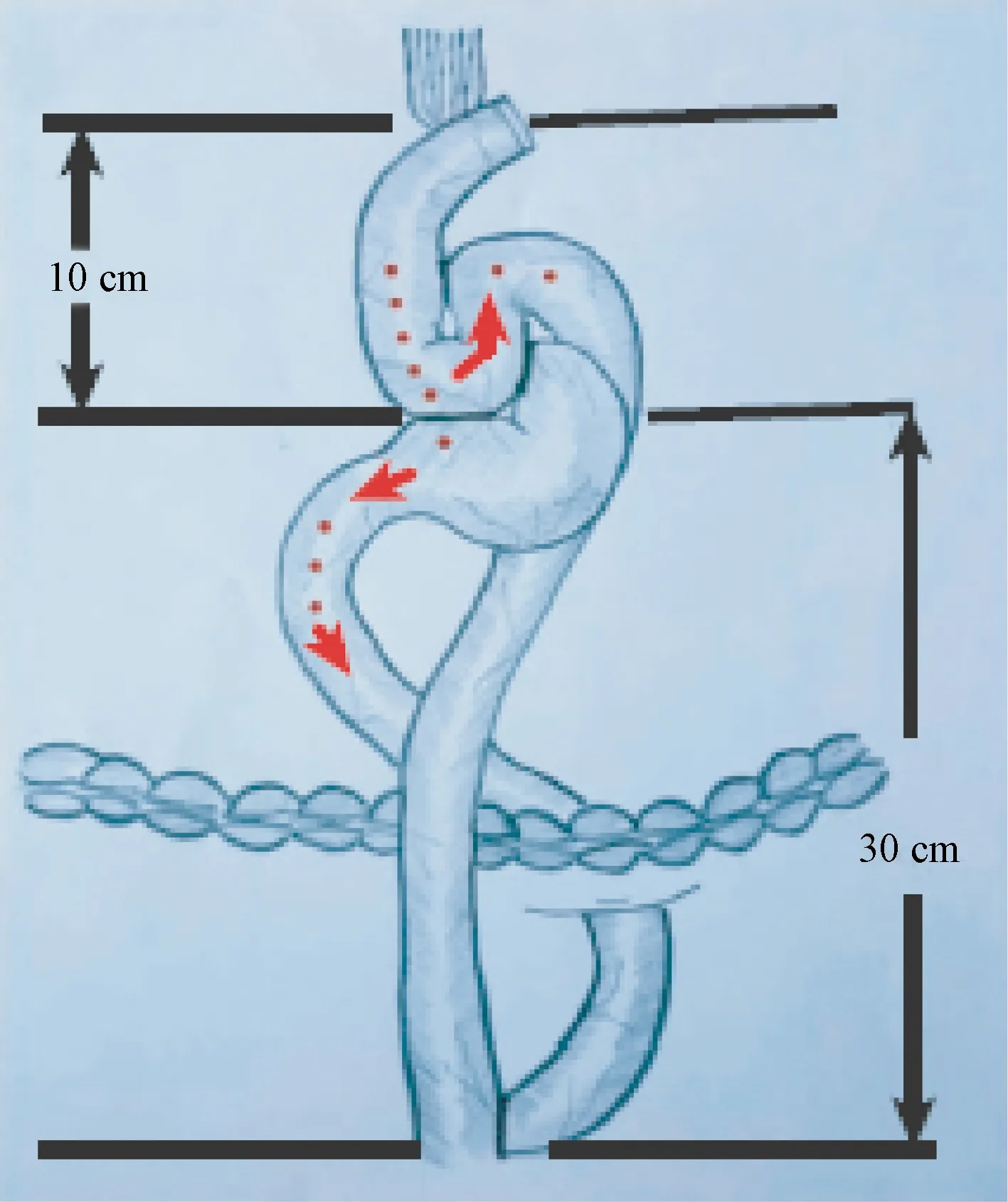
图1 腹腔镜辅助限制性双通道空肠重建术
1.3 观察指标 ①手术情况:包括手术入路、切除范围、吻合方式、手术时间、术中出血量、手术清扫淋巴结数量等;②术后并发症:根据Clavien-Dindo手术并发症分级系统,对术后30 d并发症进行分级,其中3~5级定义为严重并发症。
2 结果
2.1 手术结果 78例患者均成功地接受手术治疗,其中左侧开胸手术52例,腹腔镜辅助限制性双通道空肠重建术26例。手术时间130~500 min,术中出血量50~1 200 mL,清扫淋巴结数7~43个。2组患者手术时间、术中出血量差异比较无统计学意义(P>0.05);观察组清扫淋巴结数量多于对照组,差异比较有统计学意义(P=0.002)。表2。

表2 手术时间、术中出血量及淋巴结清扫数
注:与对照组比较,*P<0.05
2.2 术后并发症 对照组发生术后并发症39例(75.0%),观察组为13例(50.00%),2组1-2级并发症患者均占发生并发症患者总数的50%以上,多为术后输血,主要是因为AEGJ患者术前常常伴有贫血,术后需要输血;对照组发生严重并发症患者为14例(26.92%),主要是因为拔管后出现胸腔积液,需要行胸腔穿刺/胸腔闭式引流术,1例患者因肺部感染、呼吸衰竭转入ICU,1例患者死于术后吻合口瘘、肺部感染及呼吸衰竭;观察组发生严重并发症患者仅有5例(19.23%),无4级和5级并发症。观察组患者并发症发生率(50.00% vs 75.0%,2=9.82,P=0.003)显著低于对照组;观察组患者严重并发症(19.23% vs 26.92%,2=0.958,P=0.372)发生率低于对照组,但差异比较无统计学意义。术后并发症情况详见表3。
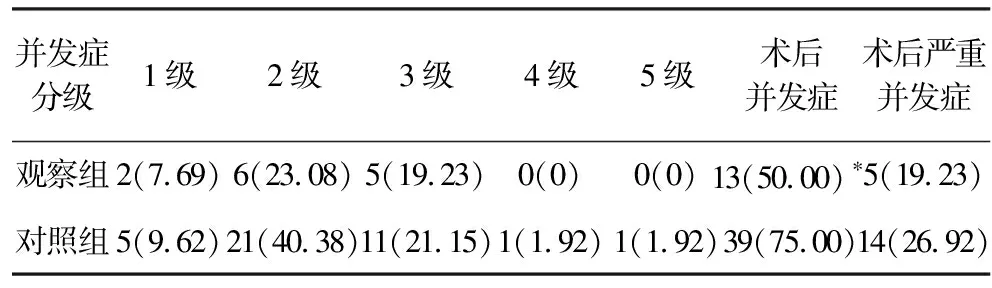
表3 术后并发症[n(%)]
注:与对照组比较,*P<0.05
3 讨论
近年来,AEGJ的发病率明显升高,而且预后较差,根治性手术切除仍然是可切除AEGJ的主要治疗方法[3-6]。由于解剖位置特殊性,AEGJ特别是SiewertⅡ型AEGJ的手术入路、切除范围及消化道重建方法均存在较大的争议。
国内胸外科常采用左侧开胸入路,行食管部分切除术、近端胃大部切除术、食管胃左胸吻合术,其优势在于食管切除范围及纵隔淋巴结清扫,但存在手术创伤大、术后并发症多、胃食管反流重、生活质量差的缺点;普通外科采用经腹入路、全胃切除术、空肠重建术,其优势在于腹腔淋巴结清扫彻底、避免开胸手术相关并发症,但存在吻合口并发症多、生活质量差的缺点[2]。对SiewertⅡ型AEGJ,循证医学证据证实:①经腹入路手术能够减少开胸手术创伤、彻底清扫腹腔淋巴结,有利于降低手术并发症,改善患者的长期预后[1,7-9]。②虽然推荐全胃切除术+D2淋巴结清扫作为标准手术方式,但其术后存在倾倒综合征及营养不良等严重问题[10]。大部分可通过胃大部切除术及区域淋巴结清扫而治愈,而且可以避免全胃切除术的并发症、提高患者生活质量并改善长期预后[11]。③近端胃切除术后消化道重建方式包括食管-残胃吻合、双通道吻合、间置空肠吻合等[12]。传统的食管胃吻合简单方便,但术后存在胃食管反流等并发症;而双通道重建术有助于改善上述问题[2,11-18]。
我们综合国内外研究结果,改进为腹腔镜辅助近端胃大部分切除、限制性双通道空肠重建术:经剑突下5~10 cm小切口,手术时间比全腹腔镜手术明显缩短,吻合效果满意;腹腔镜下通过食管裂孔,下段食管游离及切除范围更广,避免食管残端阳性,还能清扫下段食管旁淋巴结,保证手术的根治性;平衡双通道内的压力,减少因残胃或空肠张力增加引起的反流;通过调整残胃与输出襻空肠角度,限制食糜直接进入空肠,优先进入残胃及十二指肠,接近正常生理状态,保留了残胃及十二指肠排空、营养吸收等重要功能,手术效果优于单纯的双通道重建术[2]。
本研究中,观察组的手术方式虽然更复杂,但2组患者手术时间、术中出血量无显著性差异,说明随着微创手术的进步,手术的安全性得以保障,有利于提高手术的可行性。观察组清扫淋巴结数量显著多于对照组,能够改善淋巴结清扫,有利于提高手术的有效性,预期可以改善患者的预后。
本研究中2组患者的并发症发生率较高(75.0% vs 50.00%),其中大部分为输血等2级并发症,主要是因为AEGJ患者常因肿瘤破溃及食欲减退导致贫血。观察组患者并发症发生率显著低于对照组(P=0.03);严重并发症发生率也低于对照组,而且无围手术期死亡,但差异比较无统计学意义。说明限制性双通道空肠重建术可以降低术后并发症发生率,有利于提高手术的安全性。
本研究也存在一些不足之处,本研究是一项回顾性研究,样本量小,仅评估手术的安全性和可行性,需要进行进一步前瞻性的研究;未进行手术前后的生活质量评分和生存分析研究,需要在今后的研究中进一步改善。
