改性马铃薯渣果胶的组成与抗氧化活性研究
2019-06-21谭镇濠高敏简荣超谭乾开张燕唐小文李钰铃黄池光余汉忠盛钊君
谭镇濠,高敏,简荣超,谭乾开,张燕,唐小文,李钰铃,黄池光,余汉忠,盛钊君,3
(1.五邑大学 生物科技与大健康学院,广东 江门 529020;2.恩平市农业局,广东 恩平 529400;3.江门大健康国际创新研究院,广东 江门 529000)
果胶广泛存在于植物细胞间质中,其主要成分为D-半乳糖醛酸.因具有良好的增稠性、乳化稳定性、凝胶性、吸附性和成膜性等特性,果胶常被用作食品添加剂、食品包装膜、优良的药物制剂基质等[1].我国对果胶的需求量非常大,据不完全统计,我国每年消耗果胶1 500吨以上,其中约80%的果胶来源于进口[2].商品果胶的来源非常有限,而作为马铃薯加工淀粉的副产物,马铃薯渣果胶含量较高(约占干基的15%~30%)且价廉易得,是提取果胶的良好原料[3].
有研究表明,苹果渣果胶具有降血脂、抗氧化等作用[4-6],但是对于马铃薯果胶的生物活性研究较少.果胶分子质量大、水溶性差的特点,可能会阻碍甚至限制其生物功能的发挥.因此,本实验通过酸碱改性使得以马铃薯渣为原料提取的果胶生成长度较短、分支较少的糖链,以降低其酯化度、增加其水溶性、提高其半乳糖醛酸的含量,从而更好地发挥其生物活性和功能.
1 仪器、材料与试剂
1.1 仪器
FA2004N电子天平(上海菁海仪器有限公司),雷磁PHS-3C pH计(上海仪电科技仪器股份有限公司),TD5A-WS离心机(长沙湘仪离心机仪器有限公司),P70D20TL-D4型微波炉(广东格兰仕微波生活电器制造有限公司),DZF-6090真空干燥箱(上海一恒科学仪器有限公司),Evolution 201紫外-可见分光光度计(赛默飞世尔科技公司).
1.2 材料与试剂
马铃薯(购于广东省江门市),没食子酸(Gallic Acid)(阿达玛斯试剂有限公司),97%半乳糖醛酸(上海源叶生物科技有限公司),酚酞(上海泰坦科技股份有限公司),3-苯基苯酚(毕得医药科技有限公司),福林酚(上海麦克林生化科技有限公司),二苯代苦味酰基自由基(DPPH)(阿发埃莎(中国)有限公司),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(95+%)(美国Ark Pharm公司).其他试剂均为国产分析纯.
2 实验部分
2.1 样品的提取及改性处理
2.1.1 马铃薯渣的制备
按文献[7]方法制备马铃薯渣:马铃薯切小粉碎得到湿马铃薯渣,用四层纱布过滤除水,再用α-淀粉酶降解使马铃薯渣中淀粉的含量降到最低.酶解后的马铃薯渣经灭酶后,用无水乙醇洗涤一次,以除去游离糖、部分色素和杂质,拧干,60 ℃鼓风干燥后粉碎过80目筛,储存备用.
2.1.2 马铃薯果胶的提取
按文献[8]方法稍作修改,采用微波辅助法提取马铃薯渣中的果胶.准确称取马铃薯渣粉0.5000 g于烧杯中,先加入12 mLpH=2的稀硫酸溶液,然后置于微波炉中加热2 min.离心(3 000 r/min,10 min),取上清液,并加入400μL饱和的硫酸铝溶液,然后再用氨水调节至pH=5,置于50℃水浴锅中加热45 min.再离心(3000 r/min,10 min),弃去上清液,向沉淀中加入20 mL脱盐液(95%乙醇:水:浓硫酸=60:37:3),搅拌均匀,脱盐30 min,抽滤,干燥后得到马铃薯的果胶,多次提取备用.
2.1.3 马铃薯果胶的酸碱改性
准确称取3.0000 g马铃薯果胶于250 mL锥形瓶中,加入55℃蒸馏水200 mL,搅拌至果胶溶解,加入3 mol/L的NaOH溶液调节pH值至10.0.在55℃的水浴锅加热搅拌45 min,冷却至室温后再加入3 mol/L的HCl溶液调节pH值至3.0,置室温下过夜.加入3倍体积的95%乙醇溶液,搅拌,得到大量的白色絮状沉淀,抽滤后将沉淀置于真空干燥箱中干燥,得到酸碱改性果胶.改性果胶的得率按下式计算:

式中,m0为改性前马铃薯果胶的质量/g,m1为改性后马铃薯果胶的干质量/g.本实验中,酸碱改性马铃薯渣果胶的得率为60.1%.
2.2 马铃薯果胶的组成测定
果胶是一类结构复杂的酸性杂多糖,其主要成分为半乳糖醛酸.研究表明,由果胶水解得到的果胶低聚半乳糖醛酸具有降血脂、降血糖、防龋齿、抑菌等功效[9].而果胶中半乳糖醛酸含量与果胶的酯化度相关.此外,马铃薯果胶中还含有多酚物质,众所周知,多酚具有非常好的抗氧化活性.因此,果胶的半乳糖醛酸含量、多酚含量是评价果胶品质的重要指标.
2.2.1 半乳糖醛酸含量的测定
1)半乳糖醛酸标准曲线的绘制
用间羟联苯的方法[10]测定马铃薯果胶中的半乳糖醛酸的含量.配制60 μg/mL的半乳糖醛酸母液,再稀释成系列浓度的半乳糖醛酸标准溶液.以半乳糖醛酸的浓度为横坐标(单位:mg/mL),以吸光度为纵坐标(单位:Abs),绘制标准曲线,得出线性回归方程为y=77.387x+0.0144(R2=0.9981).
2)样品中半乳糖醛酸含量的测定
配制0.1 mg/mL的原果胶溶液和0.1 mg/mL的酸碱改性果胶溶液,分别吸取0.50 mL于两根离心管中,后续操作与标准曲线绘制相同,测定两种样品在520 nm波长下的吸光度,设3次平行,最后代入线性回归方程分别得出两种果胶中的半乳糖醛酸含量.
2.2.2 多酚含量的测定
1)没食子酸标准曲线的绘制
配制0.1 mg/mL的没食子酸标准溶液,分别准确移取没食子酸标准溶液0.0 mL、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL和3.0 mL于7个25 mL的容量瓶中,再分别加入1.25 mL的福林酚试剂摇匀,静置1 min,分别加入0.2 g/L的碳酸钠溶液3.75 mL,用蒸馏水定容至刻度线,置于室温下反应30 min后,在765 nm波长处测定各浓度的吸光度,且设3次平行.所配制的溶液中没食子酸的浓度(单位:mg/mL)分别为:0.000、0.002、0.004、0.006、0.008、0.010和0.012,以没食子酸的浓度(单位:mg/mL)为横坐标,以测定的吸光度(单位:Abs)为纵坐标绘制标准曲线,得出线性回归方程为y=76.804x-0.0075(R2=0.9978).
2)样品中多酚含量的测定
配制10 mg/mL的原果胶溶液和10 mg/mL的酸碱改性果胶溶液,分别吸取2.5 mL原果胶溶液和改性的果胶溶液于两个25 mL容量瓶中,后续操作与标准曲线绘制相同,在765 nm波长处测定各浓度的吸光度,且设3次平行.最后代入线性回归方程得出两种果胶样品中的多酚含量.
2.2.3 样品酯化度的测定
准确称取0.0500 g的果胶样品于50 mL的蒸馏温水中,溶解之后加入3滴酚酞溶液,用0.1 mol/L的NaOH溶液进行标定,滴定至溶液出现粉红色且维持1 min不褪色,记录此时所用NaOH溶液的体积V1(单位:mL,下同).再向溶液中加入3 mol/L的NaOH溶液2.5 mL,摇匀,静置5 min后,缓慢加入3 mol/L的盐酸至粉红色消失,再加入2滴酚酞溶液,用0.1 mol/L的NaOH滴定至溶液再次呈现粉红色且保持1 min不褪色,记录第2次所用的NaOH体积V2.酯化度的计算如下:

2.3 马铃薯果胶抗氧化活性的测定
2.3.1 DPPH自由基清除率的测定
以95%的甲醇溶液为溶剂配制0.2 mmol/L的DPPH溶液.再取2 mL新配制的DPPH溶液分别与2 mL不同质量浓度(0.0625~8.0000 mg/mL)的果胶样品溶液混合均匀,在室温避光处反应20 min后,在517 nm波长处测定各浓度果胶样品溶液的吸光度,记录为1A;用2 mL 95%的甲醇溶液分别与2 mL不同质量浓度的果胶样品溶液混合均匀,在室温避光处反应20 min后,在517 nm波长处测定各浓度果胶样品溶液的吸光度,记录为A2;最后用2 mL的DPPH溶液与2 mL的蒸馏水混合,在室温避光处反应20 min后,在517 nm波长处测定溶液的吸光度,记录为A0.果胶样品的DPPH清除率计算如下:2.3.2 ABTS自由基清除率的测定
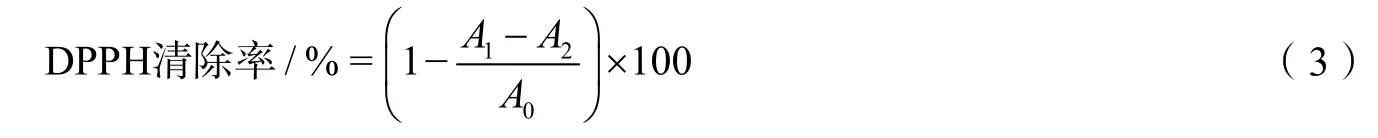
用0.2 mol/L的PBS(磷酸盐缓冲溶液)配制7.4 mmol/L的ABTS溶液(其中过硫酸钾的浓度为2.6 mmol/L),配制方法为:用PBS直接配制7 mmol/L的ABTS溶液,再与4.9 mmol/L的K2S2O3等体积混合即得所需,避光反应16 h后使用.使用前,先于紫外-可见分光光度计中测定ABTS溶液在734 nm处的吸光度,再用磷酸盐缓冲溶液稀释其吸光度至0.68~0.72,得到ABTS溶液的稀释液,将稀释后的ABTS溶液的吸光度记录为A0.将原果胶和酸碱改性果胶分别配制成不同浓度(0.0625~8.0000 mg/mL)的溶液.取0.6 mL各浓度果胶样品与6 mL的ABTS稀释液混合,在室温避光的条件下反应20 min后在734 nm波长下测定吸光度,所记录的吸光度为A1;同时将0.6 mL各浓度的果胶溶液与6 mL的磷酸盐缓冲溶液混合,同样在室温避光的条件下反应20 min后在734 nm波长下测定吸光度,所记录的吸光度为A2.果胶样品的ABTS清除率计算如下:

3 结果与分析
3.1 酸碱改性前后,马铃薯果胶的组成
改性前后马铃薯渣果胶的组成如表1所示.与改性前相比,酸碱改性果胶中的半乳糖醛酸含量提升了322 mg/g,酯化程度下降了46%.酯化度降低是由于在酸碱改性过程中,用碱处理果胶时引起了β-消除反应,同时同聚半乳糖醛酸骨架解聚;酸处理时,优先脱下了侧链上的中性糖,使得半乳糖醛酸含量降低.两种果胶的多酚含量均较低(<5 mg/g),而且差异不明显.说明马铃薯果胶中的抗氧化活性主要由其他物质(如多糖)引起,而非多酚类物质.

表1 改性前后马铃薯渣果胶的组成
3.2 DPPH自由基清除率
DPPH是一种具有稳定的氮中心自由基的光度测定分析试剂,常用于实验室抗氧化成分的体外抗氧化性评价[11].按照2.3.1所述的实验步骤,计算不同质量浓度下两种果胶的DPPH自由基的清除率;并以果胶样品终浓度(单位:mg/mL)的对数值为横坐标,以对应的DPPH自由基清除率为纵坐标(单位:%),使用Graphpad Prism软件绘制果胶浓度对DPPH自由基的清除率曲线.

图1 不同质量浓度下,马铃薯渣果胶对DPPH自由基的清除率
如图1所示,两种果胶的DPPH清除率都随果胶质量浓度的增加而增加,在终浓度低于0.25 mg/mL时,两种果胶的DPPH清除率差异并不明显;当终浓度大于0.25 mg/mL时,酸碱改性果胶的DPPH清除率高于原果胶的DPPH清除率.通过非线性拟合得到原果胶和改性果胶的DPPH清除率的IC50值分别是3.2 mg/mL和1.2 mg/mL.原果胶的IC50值大于酸碱改性果胶的IC50值,说明酸碱改性果胶的DPPH自由基清除能力大于原果胶的DPPH自由基清除能力.由于果胶中的羟基和羧基均可作为氢的供体,且羧基更加活泼更容易解离出氢离子与DPPH自由基结合还原成DPPH-H,因此半乳糖醛酸含量高且酯化度低的酸碱改性果胶清除DPPH自由基的能力更强.
3.3 ABTS自由基清除率
ABTS是稳定的以氮为中心的水溶性自由基,可用于评价天然产物的抗氧化活性.ABTS溶液与K2S2O3反应会产生蓝绿色的发色基团,果胶可以提供氢或电子使得ABTS发色基团灭活,导致其蓝绿色消失,由此推断 ABTS的清除率越高其抗氧化活性越好.以果胶样品的终浓度(单位:mg/mL)的对数值为横坐标,以对应的自由基清除率为纵坐标(单位:%),使用Graphpad Prism软件绘制各果胶浓度对ABTS清除率曲线.
如图2所示,原果胶和改性果胶在终浓度低于0.1 mg/mL时,ABTS自由基的清除率随浓度变化不明显;当终浓度>0.1 mg/mL 时,二者对ABTS自由基的清除率随着质量浓度的增大显著提高.当果胶样品浓度<0.18 mg/mL 时,原果胶的ABTS自由基的清除率比改性果胶的高.当果胶样品浓度>0.18 mg/mL 时,改性果胶的ABTS自由基的清除率比原果胶的高.通过非线性拟合得到原果胶和改性果胶ABTS自由基清除率的IC50值分别是0.41 mg/mL和0.37 mg/mL.原果胶的IC50值大于酸碱改性果胶的IC50值,证明酸碱改性果胶的ABTS自由基清除能力大于原果胶的ABTS自由基清除能力.

图2 不同质量浓度下,马铃薯渣果胶对ABTS自由基的清除率
4 结论
本研究对马铃薯果胶进行酸碱修饰得到改性果胶,并测试了其组成与抗氧化活性.与未改性果胶相比,酸碱改性果胶的半乳糖醛酸含量提高、酯化度下降.酸碱改性果胶的DPPH和ABTS清除率呈质量浓度依赖效应.未改性果胶对DPPH自由基的清除率的IC50值为3.2mg/mL,对ABTS自由基的清除率的IC50值为0.41 mg/mL;酸碱改性果胶对DPPH自由基的清除率的IC50值为1.2 mg/mL,对ABTS自由基的清除率的IC50值为0.37 mg/mL.由此可见,酸碱改性有助于果胶抗氧化活性的提高.本研究为马铃薯渣果胶在功能食品和化妆品上的应用指出了新思路,这将有利于提高马铃薯渣这一废弃物的综合利用价值.
