丁苯酞对兔视网膜缺血再灌注损伤中细胞凋亡的影响
2019-06-20张雅馨苏杰黄帅张新跃刘颖王林洪
张雅馨,苏杰,黄帅,张新跃,刘颖,王林洪
作者单位:华北理工大学附属医院眼科,河北 唐山 063000
近年来,由多种缺血性眼病所引发的视网膜的缺血再灌注损伤(retinal ischemia-reperfusion injury,RIRI)病例逐年增多,严重危害着病人的健康。视网膜是眼球后部的一层薄膜,可以看作是大脑的一部分,主要是由丛状层和神经纤维层构成的白质、光感受器和神经节细胞构成的灰质和Müller细胞及小星型细胞构成的神经胶质组成,对缺血缺氧环境极为敏感,且易受损伤,而且主要供给视网膜血供的终末动脉—视网膜中央动脉极易发生阻塞、缺血,一旦发生便可极快地损伤视网膜。RIRI是临床常见疾病,即缺血性眼病病人视网膜在恢复供血后,视功能不升反降,主要发生于糖尿病、视网膜中央静动脉阻塞、缺血性病变、青光眼等疾病中,其视神经损害主要表现在视网膜神经节细胞(retinal ganglion cell,RGC)的凋亡[1],隋源等[2]研究指出,RIRI中神经元的丢失也主要集中体现在RGCs。因此,视网膜缺血性疾病的预防及早期治疗极为重要。已有研究表明,丁苯酞对于脑缺血再灌注损伤中神经功能损伤具有很强的保护作用[3],笔者自2016年11月至2017年1月就丁苯酞对RIRI中细胞凋亡的作用进行探讨。
1 材料和方法
1.1 实验动物健康雄性新西兰白兔80只,体质量(2.5±0.5)kg,外眼及眼底检查均正常,饲养环境相同,均由华北理工大学动物实验中心提供。实验中充分保证动物福利、给予动物人道关怀,动物处置也符合伦理学原则。
1.2 主要试剂丁苯酞(恩必普,石药集团恩必普药业有限公司);DAB显色试剂盒(北京中杉金桥生物技术有限公司);封闭用正常山羊血清工作液SP-9001(北京中杉金桥生物技术有限公司);抗P53多克隆抗体、抗Bcl-2多克隆抗体(北京博奥森生物技术有限公司);山羊超敏二步法检测试剂盒(二抗)(北京中杉)等。
1.3 模型制备采用前房高眼压灌注法[4]制备缺血再灌注模型。术前给予丙美卡因点眼,复方托吡卡胺点眼至瞳孔完全散大后固定白兔,25%乌拉坦耳缘静脉麻醉,剂量4 mL/kg。麻醉成功后,白兔取仰卧位,将4.5号头皮针(连接250 mL 0.9%盐水袋)刺入前房,盐水袋垂直于兔眼,高度150 cm,此时眼底镜可见视网膜缺血水肿、苍白,持续1 h。对照组不予任何处理。氯霉素全程间断点眼保持角膜湿润,预防感染。
1.4 分组与给药采用随机数字表法将实验动物分成对照组(10只)、RIRI组(35只)、给药组(35只)三组,其中对照组再分为6 h、24 h两个亚组(排除时间和环境因素),RIRI组和给药组均再分7个亚组,分别为再灌注后1 h、6 h、12 h、24 h、48 h、72 h、7 d。排除标准:未到达预定时间死亡及造模失败、有严重手术并发症的白兔。将丁苯酞软胶囊用食用麻油稀释到10 mg/mL。治疗组于造模成功后开始灌胃给药,给药剂量为40 mg/kg,每日1次,直至处死。对照组和RIRI组每日给予相同体积食用麻油灌胃。
1.5 标本的制备将实验动物按照规定时间于耳缘静脉过量麻醉处死后摘取眼球,快速置于40 g/L多聚甲醛中固定24 h以上。将眼球壁自视乳头处纵行剪开,在平行、垂直于视神经平面各取一块约1 cm×0.5 cm视网膜组织置于包埋盒中,经过水洗、脱水、透明、石蜡包埋、切片,分别行HE染色、免疫组化法检测B细胞淋巴瘤-2基因(Bcl-2)、抑癌基因(P53)表达量及TUNEL检测细胞凋亡。
1.6 结果的判读封片后,每张切片随机取4个面积为0.2 mm×0.2 mm的高倍镜视野(400×)观察组织形态变化,应用计算机辅助图像分析技术系统分析,计数各组阳性细胞数,计算平均值。
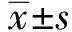
2 结果
2.1 光学显微镜下观察视网膜组织形态变化对照组兔视网膜组织结构与人相似。RIRI组1 h视网膜神经纤维层及内丛状层组织出现轻度水肿,厚度增加,染色较淡;6~24 h三个时间点,组织水肿逐渐加剧,其中神经纤维层和内丛状层最明显,可见RGCs排列稀疏;24 h视网膜内界膜不平滑,全层均可见高度水肿,神经纤维层明显薄变,内核层细胞杂乱排列,RGCs数量大幅减少,细胞变性,边界不清(图1)。48 h、72 h各层组织水肿明显减轻;120 h、7 d,视网膜水肿大幅消退,内层明显萎缩,RGCs数量减少且稀疏排列。给药组视网膜缺血再灌注后视网膜组织形态变化与RIRI组相比均较后者轻,可见丁苯酞能明显的减轻缺血再灌注后视网膜组织的损伤。
2.2 Bcl-2和P53蛋白的表达
2.2.1Bcl-2的表达 Bcl-2具有抑制凋亡的作用,其阳性表达为细胞质的棕黄色染色。本实验中对照组检测到极少阳性染色细胞,两个时间点无明显差异,而RIRI组两时间点与对照组比较差异有统计学意义(P<0.01),提示RIRI可以使Bcl-2表达增加(表1)。RIRI组在缺血再灌注后1 h时可见极少数阳性表达;6 h、12 h神经节细胞层阳性表达逐渐增多;24 h阳性表达到达高峰,除神经节细胞层外,内核层也可见阳性表达,外核层及色素上皮层未见阳性表达(图2);48 h、72 h可见神经节细胞层阳性表达逐渐下降,至7 d时已几乎无阳性细胞表达。给药组Bcl-2表达变化趋势同RIRI组相似,但各个时间点表达强度较RIRI组明显增强(7 d除外),同RIRI组各时段相比较差异有统计学意义(表2)。

表1 RIRI组和对照组Bcl-2在再灌注后6 h、24 h阳性细胞数/(n=5,个/平方毫米,

表2 RIRI组和给药组Bcl-2再灌注后各时间段阳性细胞数/(n=5,个/平方毫米,
注:1.a组内1 h与6 h比,P<0.01;2.b组内12 h与6 h比,P<0.01;3.c组内24 h与12 h比,P<0.01;4.d组内48 h与24 h比,P<0.01;5.e组内72 h与48 h比,P<0.01;6.f组内7 d与72 h比,P<0.01
2.2.2P53的表达 p53能通过下调Bcl-2基因表达而产生促节细胞凋亡作用,其阳性表达为细胞核质的棕色或浅棕色染色。对照组神经节细胞检测到极少阳性表达,两个时间点无明显差异,而RIRI组两时间点与对照组比较差异有统计学意义(P<0.01),提示RIRI可以使P53表达增加(表3)。RIRI组在缺血再灌注后1 h时可见极少数阳性表达;6 h、12 h神经节细胞层可见阳性表达逐渐增多;24 h阳性表达到达高峰,除神经节细胞层外,内核层也可见阳性表达,外核层及色素上皮层未见阳性表达(图3);48 h、72 h可见神经节细胞层阳性表达逐渐下降,至7 d时阳性细胞表达较少。给药组P53表达变化趋势同RIRI组相似,但各时间点表达强度明显减弱,同RIRI组各时段相比较差异有统计学意义(表4)。
2.3 TUNEL法检测细胞凋亡凋亡阳性细胞表达于细胞核,颜色为棕黄色。对照组可见极少凋亡阳性细胞,两个时间点无明显差异,而RIRI组两时间点与对照组比较差异有统计学意义(P<0.01),提示RIRI可以使凋亡增加(表5)。RIRI组再灌注后1 h神经节细胞层已经出现少量凋亡阳性表达;24 h前阳性表达呈上升趋势,24 h阳性表达出现峰值(除神经节细胞层外,内核层、外核层也可见阳性细胞)(图4);48 h、72 h凋亡细胞数目呈下降趋势;7 d时可见视网膜凋亡阳性细胞数极少,细胞核大量丢失。给药组凋亡细胞表达变化趋势同RIRI组,但各时间点表达强度明显减弱(7 d除外),同RIRI组各时段相比较差异有统计学意义(表6)。

表3 RIRI组和对照组P53在再灌注后6 h/24 h阳性细胞数/(n=5,个/平方毫米,

表4 RIRI组和给药组P53再灌注后各时间段阳性细胞数/(n=5,个/平方毫米,
注:a组内1 h与6 h比,P<0.01;b组内12 h与6 h比,P<0.01;c组内24 h与12 h比,P<0.01;d组内48 h与24 h比,P<0.01;e组内72 h与48 h比,P<0.01;f组内7 d与72 h比,P<0.01

表5 RIRI组和对照组在再灌注后6 h、24 h凋亡阳性细胞数/(n=5,个/平方毫米,
3 讨论
丁苯酞化学名称为消旋-3-正丁基苯酞(dl-3n-butylphthalide),是我国近年自主研发的一类新药。既往大量的实验研究及临床观察证实了丁苯酞在人体内靶点众多,能广泛分布于胃、肠、脑、脂肪等器官,直接透过血-脑屏障,能作用于心脑缺血疾病的多个病理环节,对脑缺血性疾病、血栓形成、血小板聚集、甚至急性缺血性脑卒中等疾病起到明显改善作用,不仅能改善线粒体功能,还对脑部缺血区域的血流量、微循环、清除自由基和脑部功能代谢均起到改善作用,促进功能恢复的同时无明显不良反应及毒副作用[5-10]。Xu等[11]实验研究证实了丁苯酞对脑组织缺血性神经损伤有很强的保护作用,可最大程度恢复神经功能。有学者[12-13]研究丁苯酞对凋亡相关因子的影响的实验结果表明丁苯酞对脑缺血再灌注损伤具有保护作用,其机制可能与上调Bcl-2的表达、下调Bax的表达有关。袁晓勇[14]通过研究家兔体内丁苯酞药动学发现其口服给药吸收迅速,30 min即可达最大血药浓度,且能迅速消除。虽然口服给药生物利用度较低,但大量实验研究表明口服给药方式在体内诸多器官广泛分布,以脑组织为主要靶器官,能起到有效的抑制细胞凋亡、减轻神经损伤的作用。本次实验也表明了丁苯酞对RCGs的凋亡具有较好的保护作用。

表6 RIRI组和给药组再灌注后各时间段凋亡阳性细胞数/(n=5,个/平方毫米,
注:1.a组内1 h与6 h比,P<0.01;2.b组内12 h与6 h比,P<0.01;3.c组内24 h与12 h比,P<0.01;4.d组内48 h与24 h比,P<0.01;5.e组内72 h与48 h比,P<0.01;6.f组内7 d与72 h比,P<0.01
细胞凋亡的发生由凋亡基因来进行调控,从一些早期的研究我们可以得知在视网膜缺血再灌注模型中,凋亡细胞存在于视网膜的神经节细胞层以及内核层[15]。任玉伟和宿华威[16]的实验研究表明Bcl-2蛋白具有抑制细胞凋亡作用,而P53则作为调控Bax/Bak的上游调控机制诱导细胞凋亡[17]。本次实验通过等剂量的丁苯酞与食用麻油灌胃给药,可见在缺血再灌注损伤后1~24 h Bcl-2/P53表达均明显增加,24 h达到高峰,24 h后则表达逐渐降低,差异有统计学意义。在给药组中我们可以见到Bcl-2的表达均比同一时间点的RIRI组增强,差异有统计意义(7 d组除外);P53的表达给药组均低于同一时间点的RIRI组,差异有统计意义,证明了丁苯酞可以通过上调Bcl-2和下调P53的表达起到抑制细胞凋亡的作用。而TUNEL试验中给药组各时间点凋亡细胞数均小于RIRI组,差异有统计学意义(7 d组除外),也同样证实了丁苯酞对视网膜缺血再灌注损伤中细胞凋亡起到了保护作用。本实验中7 d时凋亡和Bcl-2蛋白的阳性表达的组间比较差异无统计学意义(P>0.05),可能是与在7 d时观察时间过长,RIRI对视网膜的损伤逐渐减轻及视网膜自身修复作用逐渐加强有关。
从本次实验结果整体来看可以得出,丁苯酞能上调Bcl-2和下调P53的表达,减少凋亡细胞的表达数目,对RIRI后的细胞凋亡起到了一定的保护作用,提示丁苯酞可以透过血-视网膜屏障。但并未能完全避免凋亡的发生,可能的原因为一旦凋亡机制启动,凋亡的发生可能是无法避免的。本次实验没有给予不同浓度的剂量,故不同药物浓度对RIRI的影响有待进一步深入研究。
(本文图1~4见插图7-1)
