慢性阻塞性肺疾病急性发作期患者血清缺氧诱导因子-1α与肺功能、血气分析的相关性研究
2019-06-20吴艳巧尹丽霞
吴艳巧 尹丽霞
(1 山东省宁津县人民医院呼吸内科,山东 宁津 253400;2 德州市人民医院呼吸内科,山东 德州 253014)
慢性阻塞性肺疾病(COPD)是临床上常见的一种慢性呼吸系统疾病,随着环境污染的加重,发病率呈现增高趋势,由于COPD致残率、致死率均较高,给家庭和社会带来极大的压力。因此,在全球范围内,COPD的预防和治疗均已成为一个重要的卫生项目。目前,对于COPD的发病机制仍未完全明确,其中低氧、气道炎症、气道重构是相关的因素。细胞低氧反应中,低氧诱导因子(hypoxia-inducible factor,HIF)是最关键的核转录因子。哺乳动物细胞内存在的HIF-1随细胞内氧浓度变化而介导相应的转录因子,在低氧环境下能够调节100多种靶基因,适应机体缺氧,维持氧稳态,参与炎性因子的表达、缺氧性肺动脉高压、免疫反应的发展,在阻塞性肺疾病发生、发展中扮演了重要的角色[1]。并且有学者[2]研究发现,HIF-1α与COPD患者气道慢性炎症和气道重构有密切关系,HIF-1α可以促进COPD气道炎症的发展。目前临床对于慢性阻塞性肺疾病患者病情评价多采用肺功能和血气分析,笔者观察慢性阻塞性肺疾病急性发作期患者血清HIF-1α与肺功能、血气分析的相关性,以期更好的指导临床治疗。
1 资料与方法
1.1 一般资料:选择2015年10月至2017年10月在我院进行治疗的急性发作期COPD患者100例作为观察组,纳入标准:①诊断标准按照2007年全球慢性阻塞性肺疾病倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)[3];②第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)<70%,且第1秒用力呼气容积实测值占预计值的百分比(FEV1%)predicted<80%。排除标准:①临床资料不全者;②肿瘤所致的气道阻塞;③伴有严重肝、肾功能障碍者;④具有精神障碍无法配合者。另外选择同期在我科进行治疗的肺炎、支气管炎患者50例作为对照组。本研究均与患者签署知情同意书,并经医院医学伦理委员会批准。见表1。
1.2 肺功能的测定:嘱患者休息20 min,采用德国耶格公司生产的Masterscreen Diffusion型肺功能仪测定FEV1、FVC、计算FEV1/FVC。
1.3 血气分析:患者呼吸室内空气,用2 mL注射器取桡动脉或股动脉血1 mL密封后立即测定,血液气体分析仪采用瑞士AVL仪器公司生产的0MNI 9型进行测定。
1.4 血清HIF-1α的测定:所有患者均空腹抽取肘静脉血5 mL,采用3000 r/min离心15 min,提取血清,放置于-20 ℃冰箱统一待测。严格按照说明书进行操作,采用酶联免疫吸附法测定,测定450 nm处吸光度值,绘制标准曲线,计算样本结果。
1.5 统计学处理:所有资料处理均采用统计学软件SPSS13.0,采用χ2检验分析计数资料,计量资料均以(±s)表示,2组间平均值比较采用t检验,血清HIF-1与肺功能、血气分析的相关性行Pearson相关分析,采用多元线性回归分析各变量与HIF-1的关系。以P<0.05表示两组差异有统计学意义。
表1 两组一般情况的比较(±s)

表1 两组一般情况的比较(±s)
组别 例数(n) 性别(男/女) 年龄(岁) 身高(cm) 体质量(kg)PCO2(mm Hg)PO2(mm Hg) FEV1(%) FEV1/FVC HIF-1α(ng/L)观察组 100 62/38 63.5±6.2 168.3±7.3 62.5±5.3 53.6±6.2 59.3±11.2 51.6±10.3 57.2±8.3 60.31±5.32对照组 50 31/19 61.9±5.1 165.8±6.5 61.2±5.9 41.1±5.4 76.5±9.3 66.2±9.2 79.6±7.6 11.53±2.61 P值 - 0.268 0.306 0.095 0.226 <0.01 <0.01 <0.01 <0.01 <0.01
2 结 果
2.1 两组一般情况的比较:见表1,经比较,两组研究对象性别、年龄、升高、体质量无显著性差异(P>0.05);观察组PCO2明显高于对照组(P<0.01);观察组FEV1、FEV1/FVC、PO2均明显低于对照组(P<0.01)。
2.2 观察组血清HIF-1α与肺功能、血气分析的相关性:经Pearson相关分析显示,血清HIF-1α与FEV1、FEV1/FVC、PO2均呈负相关(r=-0.601、-0.416、-0.339,P<0.01)。
2.3 多元线性回归分析:将血清HIF-1α作为应变量,性别、年龄、升高、体质量、PO2、PCO2、FEV1、FEV1/FVC作为自变量进行分析,HIF-1α与性别、年龄、升高、体质量均无线性回归关系;HIF-1α与PO2、FEV1、FEV1/FVC有线性回归关系,见表2。
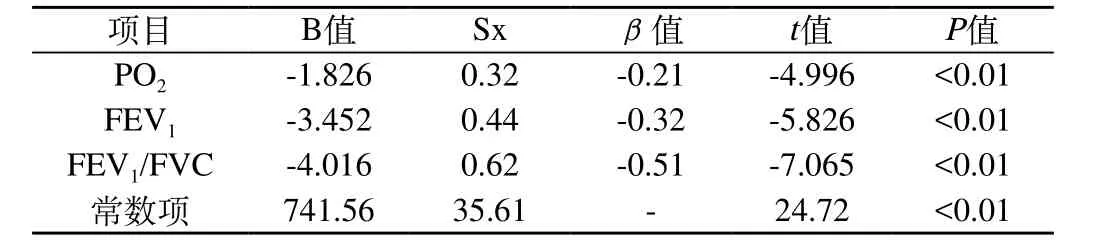
表2 HIF-1α与PO2、FEV1、FEV1/FVC回归分析
3 讨 论
慢性阻塞性肺疾病(COPD)包括慢性支气管炎和(或)肺气肿,疾病特征是气道气流阻塞,在我国发病率较高,近些年由于大气污染,发病率呈现增高趋势,常常伴有支气管哮喘和支气管扩张的疾病,确切原因尚不十分明确,疾病呈不可逆性进展,晚期患者呼吸困难严重而失去劳动能力,并且可合并肺心病,目前对于COPD的病理进程仍无有效药物逆转,因此严重影响了患者的生活质量[4]。目前学者们的研究主要集中在对于COPD发病机制的研究中以试图阻断其进展。HIF由α、β两个亚基组成,α亚基受氧调节,β亚基表达稳定。在人体中,HIF-α包括HIF-1α、HIF-2α和HIF-3α3种亚型。其中HIF-1α作用最为广泛,在炎症、肿瘤等疾病中均发挥重要的作用[5]。在低氧条件下,HIF-1α作为关键转录因子维持机体氧稳态。机体内缺氧后可以激活HIF-1α基因表达,能够上调适应低氧环境的能力[6]。COPD的始动因素是肺动脉高压,肺动脉高压的形成是多种因素作用的结果,多种因素导致上述的肺血管的改变,最终增加右心室负荷,进而进展成为右心衰竭[7]。李启芳等[8]通过研究COPD患者HIF-α与肺血管的关系表明肺血管表达更多的HIF-1α,血管壁增厚、中膜肌性增厚、无肌细动脉肌化及管腔变窄;COPD患者肺小动脉均明显增强表达HIF-1α mRNA及蛋白,并且与管壁厚度和管壁面积呈正相关,提示COPD气道重塑和肺动脉高压形成过程中HIF-1α可能扮演了重要的角色。另外,COPD的基本病理过程是一种炎性反应,有学者研究显示,炎症组织重要的病理特征是微环境的低氧,缺氧损伤又通常伴有炎性细胞浸润,二者相互影响,炎性反应激活细胞缺氧反应,缺氧又进一步增加局部的炎性反应[9]。在肺部缺氧病变中HIF-1α不仅仅是缺氧的表现,而且可以参与其中,HIF-1α在炎症性疾病中具有抗炎作用,通过研究大鼠肺不张模型,研究者发现,肺泡上皮细胞由于缺氧而增加局部HIF-1α的活化,HIF-1α可以抑制肺泡缺氧引起的炎性反应[10]。因此,在缺氧性肺疾病中HIF-1α的作用有待进一步研究。
本研究显示,观察组PCO2明显高于对照组(P<0.01);观察组FEV1、FEV1/FVC、PO2均明显低于对照组(P<0.01)。经Pearson相关分析显示,血清HIF-1α与FEV1、FEV1/FVC、PO2均呈负相关。HIF-1α与PO2、FEV1、FEV1/FVC有线性回归关系。通过以上研究数据可知,COPD患者血清HIF-1α与肺功能、血气分析均有明显的相关性,临床中是否可以利用简单测试血清HIF-1α而进行COPD的病情评估有待更大样本的数据。
