miRNA-146a在桥本甲状腺炎合并乳头状甲状腺癌组织中的表达及其对甲状腺癌K1细胞的调控作用△
2019-06-19李文祥章焱华吕冠高福平高波桑剑锋
李文祥,章焱华,吕冠,高福平,高波,桑剑锋
南京市高淳人民医院1普外科,2病理科,3超声科,南京211300
4南京鼓楼医院普外科,南京210008
甲状腺癌是常见的甲状腺恶性肿瘤,乳头状甲状腺癌(papillary thyroid carcinoma,PTC)是最常见的病理类型。慢性淋巴细胞性甲状腺炎(chronic lymphocytic thyroiditis,CLT)又称桥本甲状腺炎(Hashimoto’s thyroiditis,HT)或桥本病,是一种常见的自身免疫性甲状腺疾病。研究显示,PTC的发病风险与HT有一定的相关性[1-3]。近年来,HT合并PTC的发病率明显上升,但具体的发病机制仍不清晰[4],研究HT合并PTC的发生发展机制,对PTC的诊断和治疗也具有重要意义。微小RNA(microRNA,miRNA)广泛存在于动植物体内,与多种恶性肿瘤的发生发展密切相关[5]。研究显示,miRNA-146a在甲状腺癌、乳腺癌和宫颈癌等多种恶性肿瘤中高表达,与淋巴结转移和临床分期有关[6-8],但miRNA-146a在HT合并PTC患者中的表达情况及其对细胞增殖的调控作用尚不清楚。因此,本研究探讨miRNA-146a在HT合并PTC患者组织中的表达及其对甲状腺肿瘤细胞增殖、侵袭能力的影响,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2014年3月10日至2017年10月30日在南京市高淳人民医院接受手术治疗的甲状腺疾病患者的临床资料。纳入标准:①经病理学证实为甲状腺疾病;②甲状腺腺体质地增硬,有或无局部压迫症状;③甲状腺弥漫性增大,有局部压迫症状;④甲状腺合并结节或声嘶;⑤超声检查怀疑合并甲状腺肿瘤。排除标准:①术前确诊为原发性甲状腺机能亢进、促甲状腺激素受体抗体阳性的患者;②合并其他恶性肿瘤、全身免疫性疾病或感染性疾病的患者;③术前接受过其他治疗的患者。依据纳入和排除标准,共纳入215例甲状腺疾病的患者,其中结节性甲状腺肿28例,HT 62例,PTC 75例,HT合并PTC 50例。HT合并PTC患者中,男15例,女35例;年龄26~70岁,≥45岁29例,<45岁21例;根据美国癌症联合委员会的TNM分期标准[9]:Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期18例;有淋巴结转移16例,无淋巴结转移34例。
1.2 细胞、主要试剂和仪器
人甲状腺癌K1细胞购自中科院上海细胞库,miRNA-146a inhibitor及阴性对照序列均购自上海拓然公司,胎牛血清购自杭州四季青公司,胰蛋白酶、DMEM培养基均购自美国Gibco公司,CCK8细胞增殖检测试剂盒购自北京索莱宝公司,RNA提取试剂盒、总蛋白提取试剂盒、逆转录试剂盒和实时逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测试剂盒均购自上海碧云天公司,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、细胞周期蛋白D1(cyclin D1)抗体、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)抗体、β-肌动蛋白(βactin)抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗均购自美国Santa Cruz公司。LipofectamineTM2000购自美国Invitrogen公司,酶标仪购自美国Bio-Rad公司,凝胶成像系统购自美国UVP公司,显微镜购自日本NIKON公司。
1.3 实验方法
1.3.1 RT-PCR检测miRNA-146 a的表达情况所有患者分别取50 mg甲状腺组织标本研碎成浆,采用RNA提取试剂盒提取RNA,以紫外分光光度计检测所提取RNA样品的纯度和浓度,采用逆转录试剂盒合成互补DNA(complementary DNA,cDNA)。以合成的cDNA为模板,参照RT-PCR试剂盒说明书按照如下反应条件和反应体积检测miRNA-146a表达水平。反应条件:95℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸4 min,共40个循环。20 μl PCR反应总体积:2×SYBR Premix ExTaq 10 μl,上下游引物各 0.5 μl,cDNA 模板1 μl和ddH2O 8 μl。每份样品均检测3次,以U6为内参,2-△△Ct法计算甲状腺组织中miRNA-146a的相对表达量。U6正向引物:5'-GCTTCGGCAGCACATATACTA-3',反 向 引 物 :5'-AACGCTTCACGAATTTGCGT-3';miRNA-146a 正向 引 物 :5'-CAGTGCGTGTCGTGGAGT-3',反向引物5'-GGGTGAGAACTGAATTCCA-3'。
1.3.2 细胞培养和转染方法采用含100 ml/L胎牛血清的DMEM培养基培养K1细胞,在温度37℃、5%CO2的常规条件下培养,待细胞融合度达70%时,加入2.5 g/L胰蛋白酶消化传代。收集生长良好的对数生长期K1细胞,以3×105/ml的浓度接种至6孔细胞板上,每孔接种100 μl,将阴性对照序列和miRNA-146a inhibitor序列进行转染,在培养箱中培养至融合度达60%时,依据LipofectamineTM2000说明书步骤进行转染,分别作为NC组和miRNA-146a inhibitor组。
1.3.3 CCK 8法检测细胞增殖能力取上述生长良好的对数生长期NC组和miRNA-146a inhibitor组K1细胞,以细胞培养液调整细胞浓度,以3×105/ml的浓度接种至96孔细胞板上,每孔接种100 μl。每组设6个复孔,实验重复3次。置于细胞培养箱中常规培养24、48、72 h后,每孔加入CCK8溶液10 μl培养2 h。以酶标仪检测两组细胞在450 nm波长处的光密度(optical density,OD)值。
1.3.4 克隆形成实验检测细胞侵袭能力收集对数生长期的NC组和miRNA-146a inhibitor组K1细胞,经胰蛋白酶消化制备单细胞悬液,接种于6孔细胞板,每孔300个,培养箱中常规培养2周。磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗,加入4%甲醇和瑞氏-吉姆萨分别进行固定和染色,自来水冲洗后,晾干。显微镜下观察随机选取的5个视野中超过50个细胞的克隆数,计算两组细胞的侵袭能力。克隆形成率=克隆数/接种细胞数×100%。实验重复3次。
1.3.5 蛋白质印迹(Western blot)法检测PCNA、cyclin D 1和MMP 9蛋白的表达水平取对数生长期NC组和miRNA-146a inhibitor组K1细胞,参照总蛋白提取试剂盒步骤提取总蛋白,加入等体积上样缓冲液,沸水浴变性5~10 min。取50 μl变性蛋白样品至SDS聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)中电泳,实验重复3次。经转膜仪转膜后,浸于含5%脱脂奶粉的封闭液中封闭。洗涤后加入PCNA(1∶1000)、cyclin D1(1∶800)和 MMP9(1∶1000)抗体,4℃下孵育过夜,再加入HRP标记的二抗(1∶2000)常温下孵育2 h。比较两组细胞中PCNA、cyclin D1和MMP9蛋白的相对表达量。
1.4 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,多组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-146 a相对表达量的比较
HT、PTC、HT合并PTC组织中miRNA-146a的相对表达量均高于结节性甲状腺肿组织,差异均有统计学意义(P<0.05)。(表1)
表1 结节性甲状腺肿、HT、PTC、HT合并PTC组织中miRNA-146 a相对表达量的比较(± s)

表1 结节性甲状腺肿、HT、PTC、HT合并PTC组织中miRNA-146 a相对表达量的比较(± s)
注:*与结节甲状腺肿组织比较,P<0.05
组织类型结节性甲状腺肿(n=2 8)H T(n=6 2)P T C(n=7 5)H T合并P T C(n=5 0)0.0 1 8±0.0 0 1 0.0 2 4±0.0 0 2*0.0 2 8±0.0 0 3*0.0 2 5±0.0 0 2*m i R N A-1 4 6 a
2.2 HT合并PTC患者miRNA-146 a的相对表达量与临床特征的关系
有淋巴结转移、肿瘤直径≥2 cm、TNM分期为Ⅲ~Ⅳ期的HT合并PTC患者miRNA-164a的相对表达量均明显高于无淋巴结转移、肿瘤直径<2 cm、TNM分期为Ⅰ~Ⅱ期的患者,差异均有统计学意义(P<0.01);但不同性别、年龄的HT合并PTC患者miRNA-146a的相对表达量比较,差异均无统计学意义(P>0.05)。(表2)
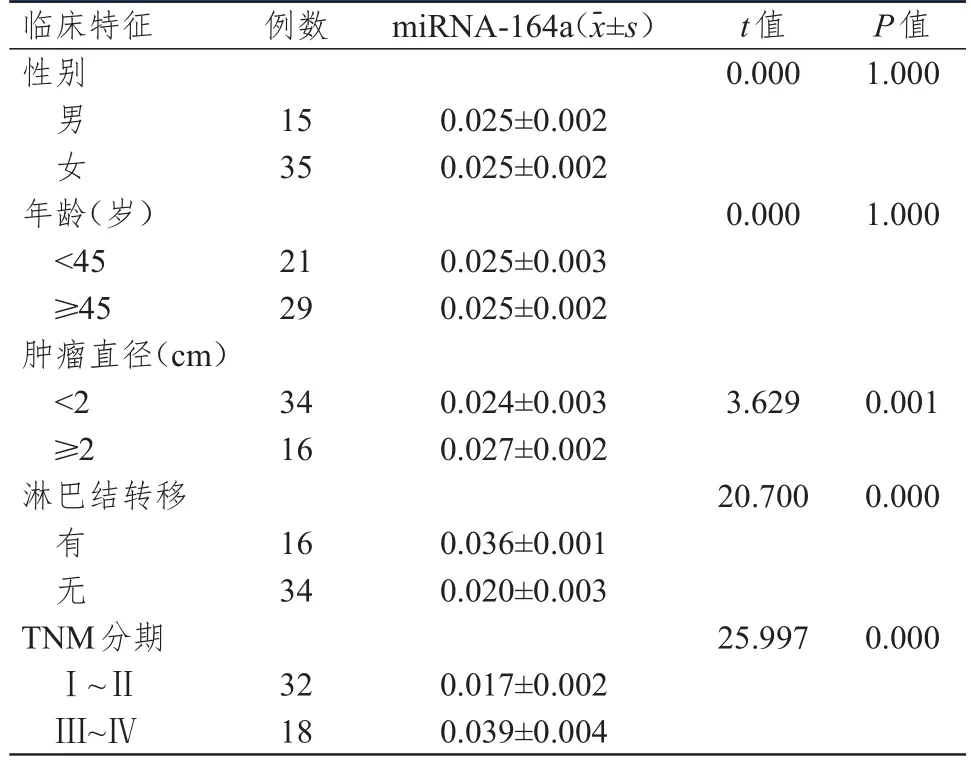
表2 不同临床特征HT合并PTC患者miRNA-146 a相对表达量的比较( n=50)
2.3 细胞增殖能力的比较
CCK8法检测细胞增殖能力,结果显示,培养24、48、72 h时,miRNA-146a inhibitor组细胞的OD值均明显低于NC组细胞,差异均有统计学意义(t=4.782、6.328、8.000,P<0.01)。(表3)
表3 不同时间点miRNA-146a inhibitor 组和NC组细胞的OD值(± s)

表3 不同时间点miRNA-146a inhibitor 组和NC组细胞的OD值(± s)
组别N C组m i R N A-1 4 6 a i n h i b i t o r组0.2 6 2±0.0 3 3 0.1 5 4±0.0 2 1 0.5 5 1±0.0 5 2 0.3 2 2±0.0 3 5 1.1 6 4±0.0 5 2 0.8 8 2±0.0 3 2 2 4 h 4 8 h 7 2 h
2.4 细胞侵袭能力的比较
克隆形成实验检测NC组和miRNA-146a inhibitor组细胞的侵袭能力,结果显示,miRNA-146a inhibitor组细胞的克隆形成率为(42.623±2.642)%,明显低于NC组细胞的(71.361±3.850)%,差异有统计学意义(t=10.660,P<0.01)。
2.5 PCNA、cyclin D 1和MMP 9蛋白表达情况的比较
Western blot检测结果显示,miRNA-146a inhibitor组细胞中PCNA、cyclin D1和MMP9蛋白的相对表达量均明显低于NC组细胞,差异均有统计学意义(t=11.237、13.033、8.538,P<0.01)。(表4)
表4 NC组和miRNA-146a inhibitor 组细胞PCNA、cyclin D 1和MMP 9蛋白的表达情况(± s)

表4 NC组和miRNA-146a inhibitor 组细胞PCNA、cyclin D 1和MMP 9蛋白的表达情况(± s)
组别N C组m i R N A-1 4 6 a i n h i b i t o r组0.9 2 3±0.0 6 1 0.4 8 2±0.0 3 0 0.5 5 2±0.0 3 2 0.2 6 4±0.0 2 1 0.6 4 2±0.0 5 0 0.3 5 2±0.0 3 1 P C N A c y c l i n D 1 M M P 9
3 讨论
miRNA-146a位于5q34染色体上,可依赖于炎性信号通路核因子-κB(nuclear factor-κB,NF-κB)、免疫因子白细胞介素-1受体相关激酶1(interleukin-1 receptor associated kinase 1,IRAK1)、活化诱导的肿瘤坏死因子受体6(activation-inducible tumor necrosis factor receptor 6,AITR6)等参与口腔扁平苔藓病和舍格伦综合征等多种自身免疫性疾病的发生发展[10]。Ahmadi-Motamayel等[11]研究发现,口腔扁平苔藓病患者外周血中miRNA-146a的表达量明显高于健康对照组,miRNA-146a可能是口腔扁平苔藓病免疫发病的潜在生物标志物;Shi等[12]研究发现,miRNA-146a在舍格伦综合征患者外周血中过表达,且与患者的临床特征有关。miRNA-146a除与自身免疫性疾病的发生发展有关外,还可能通过激活NF-κB信号通路及相关基因参与多种肿瘤细胞的发生发展[13-14]。Sandhu等[15]研究显示,乳腺癌组织中miRNA-146a表达水平上调,敲除miRNA-146a可通过促进NF-κB的表达从而抑制肿瘤细胞增殖并促进其凋亡。王丽萍等[16]研究指出,miRNA-146a在口腔鳞状细胞癌组织和细胞中表达水平较高,在口腔癌细胞的增殖、侵袭和迁移过程中发挥重要作用。
HT是一种常见的自身免疫性疾病,PTC是内分泌系统中最常见的恶性肿瘤,二者间的关系一直是临床研究的重点。研究显示,miRNA-146a在PTC患者中表达量较高[6],但miRNA-146a在HT合并PTC组织中的表达情况及其对甲状腺癌细胞增殖的作用仍不清晰。本研究结果显示,miRNA-146a在HT、PTC、HT合并PTC组织中的相对表达量均高于结节性甲状腺肿组织;进一步观察miRNA-146a的相对表达量与HT合并PTC患者临床特征的关系,结果显示,有淋巴结转移、肿瘤直径≥2 cm、TNM分期为Ⅲ~Ⅳ期HT合并PTC患者miRNA-164a的相对表达量均明显高于无淋巴结转移、肿瘤直径<2 cm、TNM分期为Ⅰ~Ⅱ期的患者,表明miRNA-146a在HT合并PTC的发生发展过程中可能具有重要作用。采用常规生物学方法抑制miRNA-146a的表达,miRNA-146a inhibitor组细胞的增殖能力和克隆形成率均明显低于NC组细胞,表明miRNA-146a可能在PTC的发生发展过程中具有原癌基因的作用。
PCNA是DNA合成和细胞周期顺利进行的重要蛋白质,可较好地反映细胞的增殖情况;cyclin D1是周期蛋白依赖性激酶中的一员,在细胞G1至S期转变过程中发挥正向调控作用;MMP9属于基质金属蛋白酶家族成员,在维持降解和重塑细胞外基质的动态平衡中发挥重要作用,PCNA、cyclin D1和MMP9均在PTC细胞的增殖和侵袭过程中发挥重要作用[17-19]。Dong等[20]研究显示,miRNA-146a的敲除可通过调控NF-κB、p65和PCNA来抑制血管平滑肌细胞的增殖和迁移能力;此外,研究显示,miRNA-146a可通过调控cyclin D1和MMP9的表达水平,参与细胞的增殖、侵袭过程[21-23]。本研究通过Western blot法检测PCNA、cyclinD1和MMP9蛋白的表达情况,结果显示,miRNA-146a inhibitor组细胞PCNA、cyclin D1和MMP9蛋白的相对表达量均明显低于NC组细胞,表明miRNA-146a可能通过上调PCNA、cyclin D1和MMP9的表达,促进甲状腺癌的发生发展。
综上所述,miRNA-146a在HT合并PTC组织中表达水平较高,下调miRNA-146a的表达可抑制甲状腺癌患者细胞的增殖和侵袭能力,其分子机制可能与抑制PCNA、cyclin D1和MMP9蛋白的表达有关。
