PEAR1基因多态性与缺血性脑卒中患者阿司匹林反应相关性研究
2019-06-19陈静静田京辉徐炳欣岳延涛兰丙欣
陈静静,田京辉,徐炳欣,岳延涛,兰丙欣
(许昌市中心医院 药学部,河南 许昌 461000)
缺血性脑卒中在我国中老年人群中有较高的发病率和致残致死率,主要是由于脑血管狭窄、硬化引起血管堵塞从而导致的神经功能损伤[1]。在缺血性脑卒中的药物治疗和预防中,阿司匹林应用最为广泛,但在临床应用中发现,5 %~65 %的患者在接受规范的阿司匹林治疗后,疗效不能达到预期,患者对阿司匹林的抗血小板药理作用非敏感,这种现象称为阿司匹林抵抗[2-3]。这种现象的发生是由许多因素导致的,其中影响最大的因素被认为是遗传因素[4]。血小板内皮聚集体1(platelet endothelial aggregation receptor 1,PEAR1)是在血小板中有高度表达的Ⅰ型膜蛋白,参与血小板的激活和聚集,在形成稳定血栓中起到积极作用[5]。目前未发现关于PEAR1基因多态性与我国缺血性脑卒中患者人群中阿司匹林抵抗相关性的报道。为此,笔者分析我院2016年1月~2018年1月收治的缺血性脑卒中患者的临床资料,检测PEAR1基因多态性,探讨其与阿司匹林抵抗的相关性,现报告如下。
1 资料与方法
1.1 一般资料
收集2016年1月~2018年1月我院就诊的缺血性脑卒中患者的详细临床资料,按纳入和排除标准入组患者共148例。纳入标准:①经影像学检查确诊为缺血性脑卒中;②接受阿司匹林规范治疗7 d以上;③血小板计数为100×109~500×109/L;④年龄18~70岁。排除标准:①近1个月内联用其他抗血小板聚集的药物;②凝血功能异常、近期有活动性出血;③近期外科手术患者;④恶性肿瘤、胶原病、血液病及严重心肝肾功能异常;⑤妊娠妇女;⑥患者依从性较差。
1.2 分组和样本收集
入组患者连续口服阿司匹林 7 d,100 mg/日,于第8天早晨空腹抽取外周静脉血,采用血栓弹力图检测血小板的聚集率,根据抑制率分为对照组(即敏感患者,抑制率不小于30 %,共计102例)和观察组(即抵抗患者,抑制率小于30 %,共计46例)。所有患者均告知并均已签署患者知情同意书。
1.3 基因检测方法
两组患者于早晨空腹抽取外周静脉血3 ml,置入用EDTA处理过的离心管,-20 ℃保存。采用荧光染色体原位杂交技术对PEAR1基因型进行检测。具体操作步骤如下:在1.5 ml离心管中加入1.2 ml 1×NH4Cl预处理液,加入150 μl患者全血,混匀后室温静置5 min,离心吸弃上层红色液体,加入生理盐水重悬白细胞,再离心吸弃上清,最后向多次富集白细胞离心管中加入50 μl PEAR1基因耀金分试剂,反复吹打后混匀,室温静置30 min后用荧光检测仪测定,结果由软件自动分析判读。以上操作均严格按试剂盒和仪器标准操作规程进行。
1.4 统计学方法
应用SPSS13.0统计软件分析。计量数据和计数资料分别采用均数±标准差()和百分比(%)表示,比较采用t检验和χ2检验,多因素分析采用Logistic回归。P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料比较
对两组的性别、年龄、基础疾病、危险因素和可能与阿司匹林抵抗相关的生化指标进行比较,两组性别、饮酒和高密度脂蛋白胆固醇(HDL-C)方面的差异存在统计学意义(P<0.05),其他一般临床资料之间差异无统计学意义(P>0.05)。结果见表1、表2。
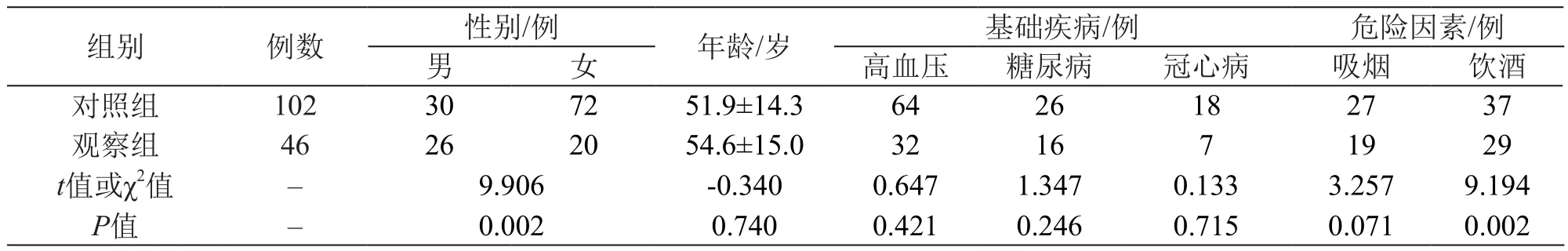
表1 一般资料的比较
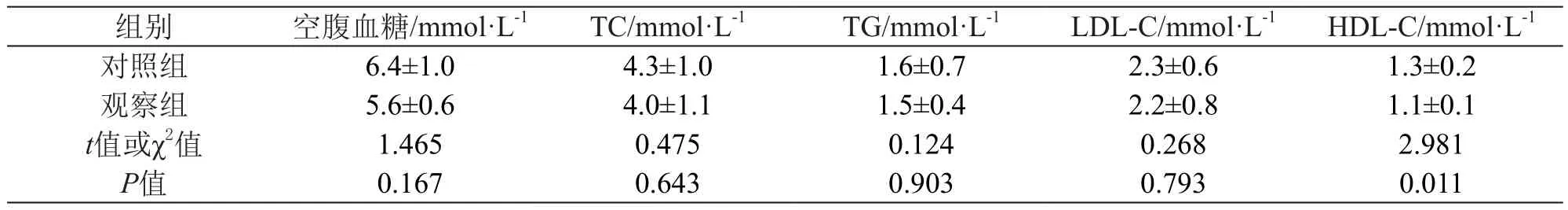
表2 生化指标比较
2.2 两组PEAR1基因多态性的比较
两组患者PEAR1基因rs12041331位点检出GG、GA和AA3种基因型,其基因型分布差异有统计学意义(P<0.05),其中观察组中的GG型携带频率远低于对照组(P<0.05);两组患者PEAR1基因rs2768759位点存在多态性,基因型有AA、AC和CC,两组患者3种基因型的分布差异无统计学意义(P>0.05),见表3。

表3 两组PEAR1基因分布比较(例数,%)
2.3 Logistic回归分析
将单因素分析中存在统计学差异的影响因素:性别、饮酒、HDL-C、PEAR1基因rs12041331位点基因型分布纳入Logistic回归方程进行多因素分析,结果见表4。结果表明性别、HDL-C、PEAR1基因rs12041331位点基因型分布是阿司匹林抵抗发生的独立危险因素(P<0.05),而饮酒被排除(P>0.05)。
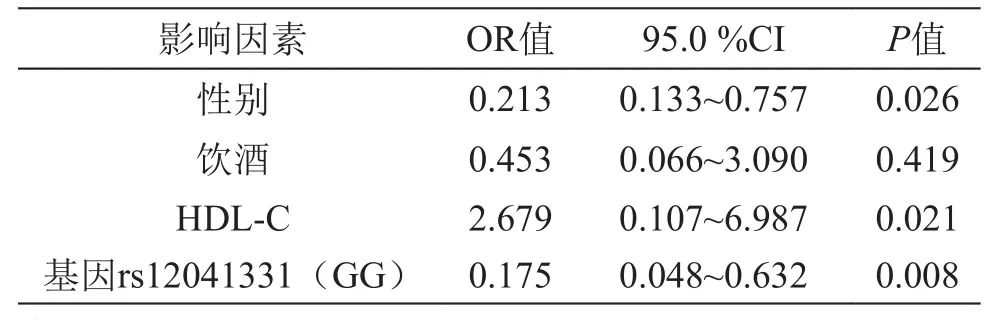
表4 阿司匹林抵抗多因素分析
3 讨论
缺血性脑卒中患者是因血小板聚集和活化形成脑血栓,最为有效的治疗方法为抗血小板聚集的溶栓治疗,其中阿司匹林临床应用最为广泛。但有临床报道,大量患者出现了阿司匹林抵抗,是指规律口服治疗剂量的阿司匹林仍不能减少或避免血栓的形成,血小板聚集未得到有效抑制[6]。其发生的机制较为复杂,不是十分明确,其中遗传因素可能是一关键机制[4,7]。近年,有文献报道PEAR1基因与血小板聚集有密切相关性,在内皮细胞和血小板细胞有较高的表达,其编码的蛋白质是一种参与诱导血小板激活的跨膜蛋白,这种蛋白的磷酸化可促进血小板的聚集并形成稳定的血栓[8]。
在近年关于PEAR1基因的研究中,有研究报道rs2768759位点中的C等位基因可能与促进血小板活化聚集相关,但也有研究报道该位点的变异与阿司匹林抵抗并不存在相关性[9-10]。本研究发现,两组患者在rs2768759位点均存在多态性,但阿司匹林抵抗组(即观察组)基因分布与阿司匹林敏感组(即对照组)相比,虽然抵抗组C等位基因的频数高于敏感组,但两组间差异不存在统计学意义(P>0.05)。笔者分析这可能与入选病例数量有限和存在偏倚相关,要明确rs2768759位点与阿司匹林抵抗的相关性尚需进一步扩大样品容量加以证实。本研究发现阿司匹林抵抗组(即观察组)与阿司匹林敏感组(即对照组)的PEAR1基因rs12041331位点的基因分布存在明显差异(P<0.05),观察组中的GG纯合子频数明显低于对照组(P<0.05),且经Logistic多因素回归分析发现,rs12041331位点的A等位基因为阿司匹林抵抗的独立危险因素(P<0.05),与近年多篇文献报道结论相一致[11-13],从而证实了rs12041331基因多态性与阿司匹林抵抗密切相关。这可能是与携带A等位基因的患者血小板活化作用增强,且对内皮细胞迁移有影响,从而促进血栓形成有关[14-15]。本研究发现性别和HDL-C为阿司匹林抵抗的独立危险因素(P<0.05),但饮酒被排除(P>0.05),笔者分析可能是由于女性患者体内雌激素具有抗氧化、降低血脂水平和血管张力、抑制血小板的聚集和黏附等作用,从而抑制阿司匹林抵抗的发生[16],LDL-C则通过减少炎性因子释放从而抑制阿司匹林抵抗的发生[17],饮酒在中国生活习惯的男女差异极大,绝大部分为男性,故饮酒作为独立危险因素的可能被排除。
综上所述,本研究提示PEAR1基因的多态性与缺血性脑卒中患者的阿司匹林反应密切相关,rs12041331位点的A等位基因有增加阿司匹林抵抗的风险。本研究入选病例有限,存在许多局限性,尚需进一步的大样本多中心检测。
