鲜食枣的快速繁殖体系研究初报
2019-06-19李学营彭勇菲王金鑫彭建营
李学营,彭勇菲,王金鑫,彭建营
(1.河北农业大学园艺学院,河北保定071001;2.河北省农林科学院石家庄果树研究所,河北石家庄050061)
植物组织培养技术是指利用植物细胞的全能性,在无菌条件下将离体的器官(如根、茎、叶、花、果、茎尖等)、组织(如形成层、表皮层、皮层、髓部细胞、胚乳等)、细胞及原生质体放在培养基中进行培养,在人工控制的环境里长成完整植株的过程。植物组织培养具有成本低、效率高、脱病毒等特点,最先始于20 世纪初期,形成于20 世纪中期,在20 世纪60 年代后被广泛应用。其在生物技术中尤为重要,同时也是植物无性繁殖的重要方式之一[1-3]。
近年来,我国枣生产发展较快,培育和发掘出许多优良品种,其繁殖方式主要有嫁接、扦插、分株和组织培养繁殖等。嫁接繁殖成活率高,方法简单易操作,因此,其成为当前栽培枣树最为常用的方式,但其发枝量少,树冠成形慢。嫩枝扦插繁殖由于其耗枝量大,并且必须选取当年萌发的半木质化枝条,取材相对较困难。而对成年的大树一般采取分株繁殖,且要采取人为断根措施,这样不仅对母树造成伤害,还可能引起品种混杂[4-6]。利用组织培养技术可在短期内获得大量、无毒的组培苗,在一定程度上促进了枣树优良品种的发展,间接地提高了经济效益[7]。生长调节剂和外植体的选择是影响植物组织培养成功与否的重要条件。但不同品种、不同生长调节剂配比、不同外植体选择存在较大差异。
笔者通过对6 个鲜食枣品种不同取材部位和不同生长调节剂浓度配比进行研究,以期筛选出枣最佳外植体材料和最佳启动、继代培养基,为枣组织快速繁殖体系提供理论依据。
1 材料和方法
1.1 材料
试验以稷山板枣、上海白蒲枣、疙瘩枣、孔府酥脆枣、宁阳六月鲜和尖枣6 个鲜食枣品种为试材,于2012 年栽植于河北农业大学农林教学实验基地,株行距1.5 m×3 m,按常规进行管理。
1.2 方法
本试验用MS 培养基,附加蔗糖30 g/L、琼脂6 g/L,通过添加不同质量浓度配比的6-BA 和IBA筛选枣启动培养基和增殖培养基。在启动培养基和增殖培养基中分别设计4 个配比处理(表1),生长调节剂在灭菌前加入,pH 值调至5.8~6.0,在高压蒸汽灭菌锅121 ℃条件下灭菌20 min。培养条件为每日光照10~12 h,光照强度1 600 lx,温度(25±2)℃。
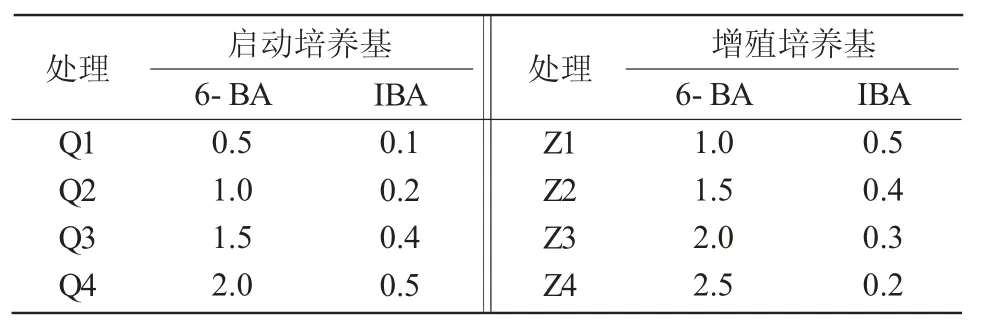
表1 2 种培养基中生长调节剂的配比 mg/L
1.2.1 外植体消毒及启动培养基筛选 2016 年3 月剪取休眠期1 年生枝和二次枝,带回实验室后用0.1%的洗衣粉水浸泡5~10 min,将枝条表面清洗干净,用自来水冲洗30 min,插入烧杯中进行水培。水培20 d 左右后取萌发的带腋芽茎段(6 个品种的混合取样)作外植体,用0.1%HgCl2溶液灭菌处理8 min,蒸馏水冲洗4~5 次,切去茎段两端各0.5 cm,接种于不同配比的培养基上,每个处理10 瓶,每瓶3 个,共30 个茎段,重复3 次。将接种好的茎段于组培室进行培养,每隔7 d 进行一次茎段生长状况调查,统计萌芽数。
1.2.2 增殖培养基筛选 外植体培养至5~6 cm时进行增殖继代培养,每个茎段3~4 个腋芽,每瓶3 个茎段,设置不同的生长调节剂配比,每个处理10 瓶,重复3 次。将接种好的茎段于组培室进行培养,定期观察记录枣启动芽的生长情况。
1.2.3 外植体筛选试验 2016 年5 月分别采取稷山板枣、上海白蒲枣、疙瘩枣、孔府酥脆枣、宁阳六月鲜和尖枣6 个鲜食品种枣头、枣吊、枣叶片为外植体进行研究。启动培养基为1.2.1 筛选出的最适启动培养基,前处理与1.2.1 相同,每个处理10 瓶,每瓶接种3 个材料,共计30 个,重复3 次,于组培室进行培养。每周观察新梢的生长状况,同时统计接种材料的存活率。
2 结果与分析
2.1 不同生长调节剂配比对枣茎段启动培养的影响
将带腋芽的茎段分别接到不同处理的启动培养基中,培养14 d 后,茎段开始膨大,腋芽开始萌动并露出绿色芽点,切口处有愈伤组织出现;21 d 后发现,茎段腋芽处出现不定芽,长出1~2 个丛状小枝;培养28~35 d 后,腋芽处长出2~3 cm 的小芽。
添加不同质量浓度生长调节剂,不定芽生长分化有明显差异,说明植物生长调节剂对不定芽的生长和分化起着重要作用。从表2 可以看出,Q2 处理效果最好,即生长调节剂质量浓度6-BA 为1.0 mg/L,IBA 为0.2 mg/L 时,芽的萌发数多,启动率最高,为63.33%,显著高于其他处理;Q1 处理效果次之,启动率为46.67%;再次为Q3 处理,启动率为33.33%;Q4 处理的效果最差,启动率仅为26.68%。
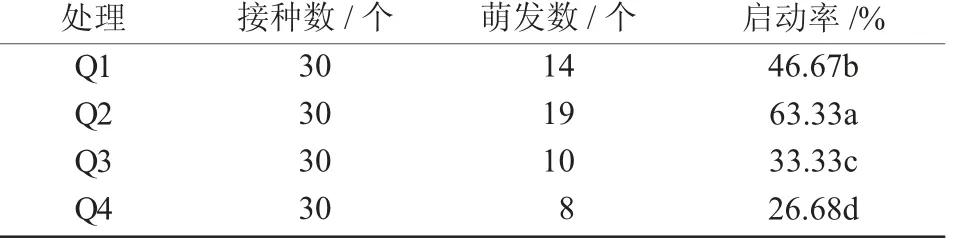
表2 不同生长调节剂配比下枣茎段启动培养情况
2.2 不同生长调节剂配比对枣增殖培养的影响
由表3 可知,不同生长调节剂质量浓度配比的培养基对枣增殖影响很大。Z3 处理(6-BA 2.0 mg/L,IBA 0.3 mg/L)的芽苗粗壮,长势良好,增殖系数为2.33,显著优于其他处理;Z1处理次之,芽苗长势细弱;而Z2,Z4 处理效果较差,长势较弱,并逐渐死亡。
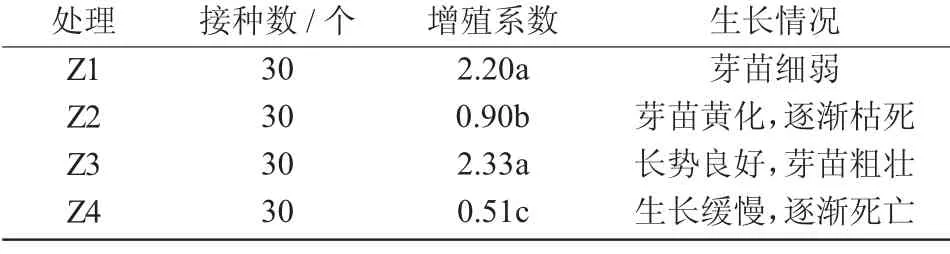
表3 不同继代培养基的增殖情况
2.3 不同外植体材料对存活率的影响
从表4 可以看出,枣头接种后存活率最高,为53.33%~83.33%,是枣树组织培养快速繁殖很好的启动材料;而枣吊接种后大部分直接枯萎死亡,只有少数成活,但在培养过程中逐渐衰亡,不宜作为组培快繁的接种材料;叶片接入启动培养基后几天渐渐衰亡,同样不适宜作为枣组培的启动材料。因此,枣组织培养的最佳启动材料为枣头。不同品种间枣头的存活率也有差异,其中,稷山板枣和孔府酥脆枣存活率较高,分别为83.33%,80.00%;宁阳六月鲜枣和上海白蒲枣存活率较低,分别为56.68%,53.33%。
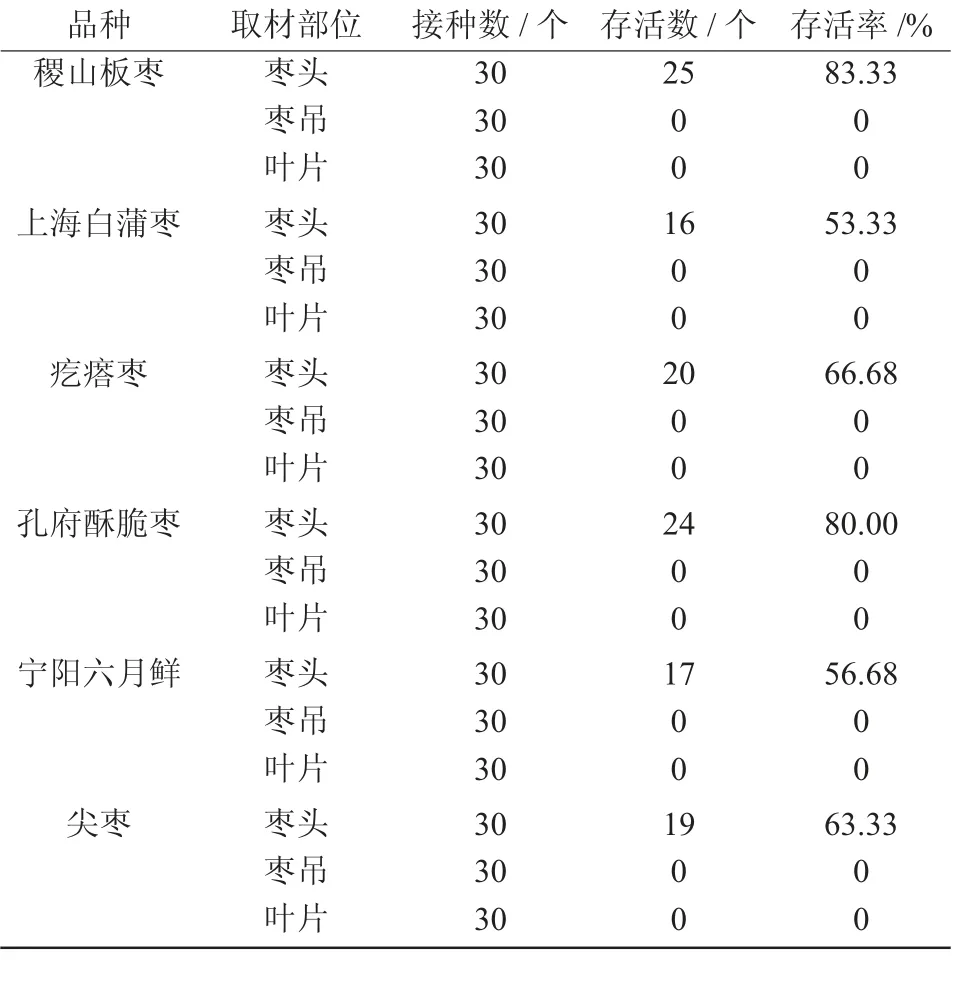
表4 外植体不同取材部位的成活率比较
3 结论与讨论
枣树的启动培养和增殖培养的培养基一般采用MS 培养基[8]。培养基中加入的植物生长调节剂是影响组织培养成功与否的一个重要条件[9]。植物生长调节剂的种类有很多,植物细胞分裂素的主要作用是促进植物细胞分裂和分化,诱导胚状体和不定芽的形成,细胞分裂素多采用6-BA 和KT;生长素的作用是影响茎尖和节间的伸长、向性、顶端优势、叶片脱落和生根等,主要有IBA,IAA 和NAA。调节剂之间的搭配和浓度均对组织培养中的细胞有较大影响,本研究中枣的启动培养基为MS+6-BA 1.0 mg/L+IBA 0.2 mg/L,增殖培养基为MS+6-BA 2.0 mg/L+IBA 0.3 mg/L 时,培养和增殖效果最好,增殖培养基中激素浓度均大于启动培养基。
影响组织培养的重要因素有组培材料、消毒灭菌时间和方式、培养基类型、植物生长调节剂的选择等。植物组织培养中外植体材料的选择是组织培养过程中关键步骤[10-13]。罗晓芳等[14-15]已建立了金丝小枣和赞皇大枣等的无菌体系。关于枣离体叶片组织培养研究相对较晚,叶部组织培养成功的报道均以试管苗叶片为试材,通过不同切割、摆放、基本培养基种类和生长调节剂配比等研究其再生[16-18],而田间直接采取叶片无再生不定芽的能力[17]。本研究发现,不同鲜食枣品种直接田间采取叶片接种培养,长出愈伤组织后逐渐枯萎死亡,成活率为零,进一步说明大田枣叶片不能作为组织培养材料。本研究中枣吊接入培养基后,未萌发新芽,而是枯萎变黄,有少数枣吊在瓶中开花后,逐渐枯萎,所以,枣吊同样不适合作为枣组织培养的外植体材料;而枣头接种于启动培养基后,萌芽后生长缓慢,但成活率较高,因此,枣头是枣快速繁殖的最佳外植体材料。
