PI3K/mTOR双靶点抑制剂PI-103在体外对喉鳞癌细胞的作用
2019-06-18李柯楠刘会勤
李柯楠 刘会勤 丛 宁 周 梁 张 明△
(1复旦大学附属眼耳鼻喉科医院耳鼻喉科, 2 耳鼻喉科研究院 上海 200031)
PI3K/Akt/mTOR信号通路与肿瘤的发生发展密切相关。其在多种恶性肿瘤细胞中过度活化后可抑制细胞凋亡,促进细胞周期进展,从而促进细胞的生存和增殖,同时参与血管形成,在肿瘤的发生、侵袭和转移中发挥重要作用[1-2]。因此,以该信号途径为靶点的药物开发已成为肿瘤治疗的研究热点之一。一方面抑制PI3K通路可以使细胞周期阻滞,抑制细胞生长,另一方面抑制mTOR可诱导自噬而使肿瘤细胞失活,所以单靶点的PI3K/mTOR抑制剂在促进细胞凋亡的同时,可以诱导细胞自噬,从而干扰肿瘤细胞活性,肿瘤细胞得以继续存活,抗肿瘤作用有限[3]。PI-103作为一种新型的PI3K /mTOR双靶点抑制剂,能特异性抑制PI3K及mTOR的活性,从而抑制肿瘤细胞的增殖,在某些类型的肿瘤体内外研究中均表现出强效的抗瘤能力及低细胞毒性[4]。
目前,PI3K/Akt/mTOR信号通路抑制剂作用于喉鳞癌细胞的研究甚少。我们拟通过研究PI3K/mTOR双靶点抑制剂PI-103对喉鳞癌细胞周期、凋亡、迁移及侵袭能力的影响,探讨PI3K/mTOR双靶点抑制剂用于喉鳞癌临床治疗的理论依据。
材 料 和 方 法
试剂 喉鳞癌细胞株Hep-2由复旦大学附属眼耳鼻喉科医院细胞库提供,细胞株AMC-HN-8由韩国Ulsan大学医学院馈赠。LY294002、Rapamycin、PI-103(美国 Selleck公司);兔抗人Caspase-8、9、3,Cyclin D1,Cyclin E1,p-AKT、AKT、p-4EBP1、4EBP1单克隆抗体(美国Neomarkers公司);兔抗人active Caspase3 (美国Abcam公司);鼠抗人GAPDH 抗体、HRP标记羊抗兔 IgG、HRP标记羊抗鼠IgG(美国Santa Cruze公司);Annexin V-FITC试剂盒(美国Invitrogen公司);ECL试剂盒(美国 Millipore公司);Transwell小室(美国Corning公司);Matrigel(美国BD公司)。
流式细胞术检测Hep-2及AMC-HN-8细胞周期 收集对数生长期的Hep-2细胞和AMC-HN-8细胞,调整细胞浓度为5×105/mL,设空白对照组和给药组:15 μmol/L LY294002、50 nmol/L Rapamycin、4 μmol/L PI-103。细胞培养48 h后取1×106个细胞,300×g离心5 min后PBS清洗,加入75%冰乙醇5 mL混匀固定,-20 ℃静置24 h,再300×g离心10 min弃去乙醇,用PBS清洗,取1 mL PBS重悬细胞加入RNase 5 μL (10 mg/mL),37 ℃温浴1 h,加入PI (10 mg/mL)染液5 μL,室温避光染色30 min后用流式细胞仪检测。
流式细胞术检测Hep-2及AMC-HN-8细胞凋亡 按Annexin V-FITC凋亡检测试剂盒步骤操作,细胞处理方式同上。取1×106个细胞移入离心管,300×g离心5 min后,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞。加入5 μL Annexin V-FITC,轻轻混匀,室温避光孵育10 min。300×g离心5 min,弃上清,加入190 μL Annexin V-FITC 结合液再重悬细胞,加入10 μL PI 染色液混匀,冰浴避光静置,流式细胞仪检测。
CCK-8检测细胞增殖-毒性试验 收集对数生长期的Hep-2和AMC-HN-8细胞,调整细胞浓度为5×105/mL,100 μL/孔在96孔板中接种细胞悬液,设阴性对照组(无细胞仅培养液)、空白对照组和给药组各3个复孔:15 μmol/L LY294002、50 nmol/L Rapamycin、4 μmol/L PI-103,培养箱内孵育,分别在8 h、12 h、24 h、36 h和48 h加入10 μL CCK-8溶液,培养箱孵育2 h,酶标仪测定450 nm处的吸光度。
Transwell检测肿瘤细胞迁移能力 根据CCK-8细胞增殖-毒性试验,在36 h以上药物对细胞数量影响较大,而24 h内药物组与对照组无明显差异,故定于20 h内行迁移试验。收集对数生长期细胞,调整细胞悬液浓度为5×105/mL。Transwell chamber置于37 ℃温育。在下室(即24孔板底部)加入600 μL含20%血清的培养基,上室加入150 μL细胞悬液,设阴性对照组(无细胞仅培养液)、空白对照组和给药组各3个复孔:15 μmol/L LY294002、50 nmol/L Rapamycin、4 μmol/L PI-103,加药后继续培养24 h。取出chamber,吸干上室液体,甲醇室温固定30 min,结晶紫染液室温染色15~30 min,PBS冲洗,擦去上室底部膜表面上的细胞。倒置显微镜下取10个随机视野计数,统计结果。
Transwell检测肿瘤细胞侵袭能力 在Transwell chamber上室底部中央垂直加入100 μL稀释后的Matrigel,37 ℃温育。收集对数生长期细胞,处理方法同迁移实验,调整浓度为5×105/mL。在下室加入600 μL含20%血清的培养基,上室加入150 μL细胞悬液,为避免Matrigel胶对细胞迁移的限制,加药后继续培养至24 h。取出chamber,吸干上室液体,甲醇室温固定30 min,结晶紫室温染色15~30 min,擦去Matrigel凝胶和聚碳酯膜上表面的细胞,小心揭下膜表面上的细胞,底面朝上晾干,移至载玻片上用中性树脂封片。倒置显微镜下取10个随机视野计数,统计结果。
Western blot 检测相关蛋白表达 取对数生长期Hep-2及AMC-HN-8细胞,处理方法同流式细胞术测细胞周期。细胞裂解,抽提蛋白质,定量,准备样品液,进行SDS-PAGE;蛋白质转膜,封闭后与一抗结合(兔抗人Caspase-8、Caspase-9、actived Caspase-3、Cyclin D1、Cyclin E1、p-AKT、AKT、p-4EBP1、4EBP1单克隆抗体、鼠抗人GAPDH抗体均按1∶1 000的比例稀释),洗膜后加入二抗抗体(HRP标记羊抗兔及羊抗鼠IgG二抗均按1∶5 000的比例稀释),ECL发光试剂显色定影,自动凝胶成像分析系统对蛋白质条带扫描定量。
结 果
PI3K/mTOR信号通路抑制剂阻滞喉鳞癌细胞细胞周期 与对照组相比,分别经PI3K/mTOR通路抑制剂LY294002、Rapamycin、PI-103处理的喉鳞癌细胞(Hep-2、AMC-HN-8),其细胞周期阻滞于S期,S期细胞百分含量明显增多(Hep-2:34.82%±1.09%vs.59.15%±0.52%,54.63%±0.81%,66.56%±1.19%;AMC-HN-8:32.51%±0.66%vs.44.95%±1.24%,54.44%±1.55%,55.53%±0.93%),而G2期细胞百分含量明显下降(Hep-2:11.44%±0.54%vs.3.92%±0.20%,4.58%±0.23%,1.12%±0.08%;AMC-HN-8:24.62%±1.15%vs.4.92%±0.19%,8.45%±0.83%,0.42%±0.06%),细胞分裂出现抑制,且双靶点抑制剂PI-103的作用显著高于单靶点抑制剂(LY294002、Rapamycin) (P<0.000 01,图1 A、C)。
PI3K/mTOR信号通路抑制剂促进喉鳞癌细胞凋亡 与对照组相比,分别经PI3K/mTOR通路抑制剂LY294002、Rapamycin、PI-103处理的喉鳞癌细胞(Hep-2、AMC-HN-8),其细胞凋亡率显著上升(Hep-2:2.36%±0.96%vs.20.73%±2.54%,19.98%±1.33%,33.57%±1.49%;AMC-HN-8:1.53±0.83%vs. 16.62%±1.38%,18.38%±1.27%,32.56%±2.81%),且双靶点抑制剂PI-103作用显著高于单靶点抑制剂(LY294002、Rapamycin) (P<0.01,图1B、D)。
阻断PI3K/mTOR信号通路抑制喉鳞癌细胞的迁移能力 与对照组相比,分别经PI3K/mTOR通路抑制剂LY294002、Rapamycin、PI-103处理的喉鳞癌细胞,其细胞迁移数显著下降(Hep-2:199.6±6.45vs.125.2±26.65,111±3.062,29.07±8.637;AMC-HN-8:277.5±62.9vs. 92.73±1.157,110.7±4.1,75.4±7),且双靶点抑制剂PI-103作用显著高于单靶点抑制剂LY294002和Rapamycin (Hep-2:P<0.05;AMC-HN-8:P<0.001) (图2)。
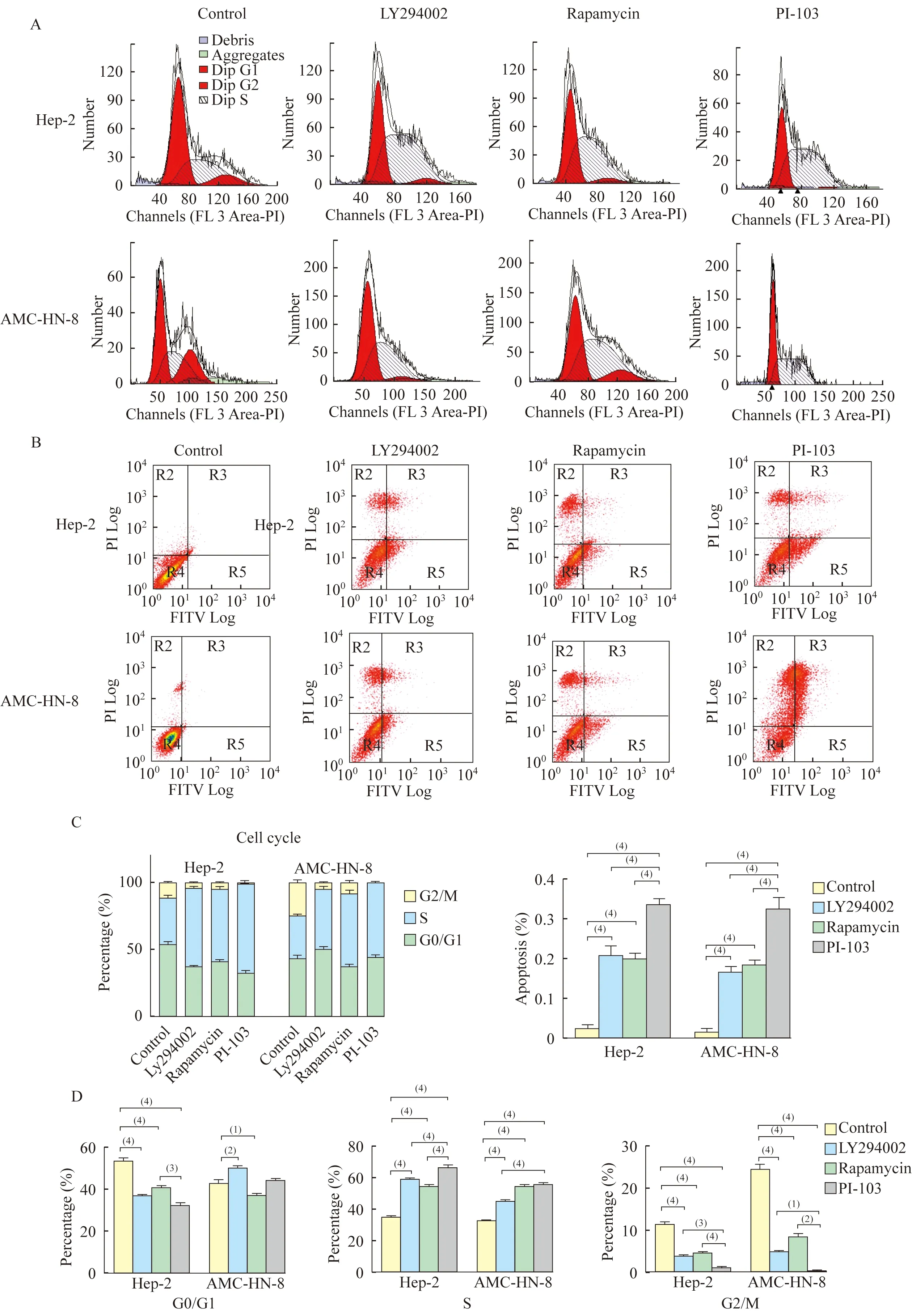
A:Increased Hep-2 and AMC-HN-8 cell apoptosis by inhibitors of PI3K/mTOR signal pathway.B:Arrested Hep-2 and AMC-HN-8 cell cycle by inhibitors of PI3K/mTOR signal pathway.C:The percentage of cell apoptosis.D:The G0/G1,S and G2/M percentage in cell cycle.(1)P<0.01;(2)P<0.001;(3)P<0.000 1;(4)P<0.000 01.
图1 阻断PI3K/mTOR信号通路能阻滞喉鳞癌细胞周期及促进凋亡
Fig 1 Laryngeal squamous carcinoma cell cycle was arrested and apoptosis was enhanced by inhibiting the PI3K/mTOR signal pathway
阻断PI3K/mTOR信号通路抑制喉鳞癌细胞的侵袭能力 与对照组相比,分别经PI3K/mTOR通路抑制剂LY294002、Rapamycin、PI-103处理的喉鳞癌AMC-HN8细胞,其细胞侵袭数显著下降(Hep-2:915.5±148.1vs.558.2±23.5,387.6±16.75,146.6±39.7;AMC-HN-8:576.1±4.95vs.366.5±45.9,410.8±15.4,334.2±20.2554),且双靶点抑制剂PI-103作用在Hep-2细胞显著高于单靶点抑制剂LY294002和Rapamycin (P<0.001),在AMC-HN-8细胞侵袭数低于单靶点抑制剂,但差异无统计学意义(P=0.8216,0.3049,图2)。
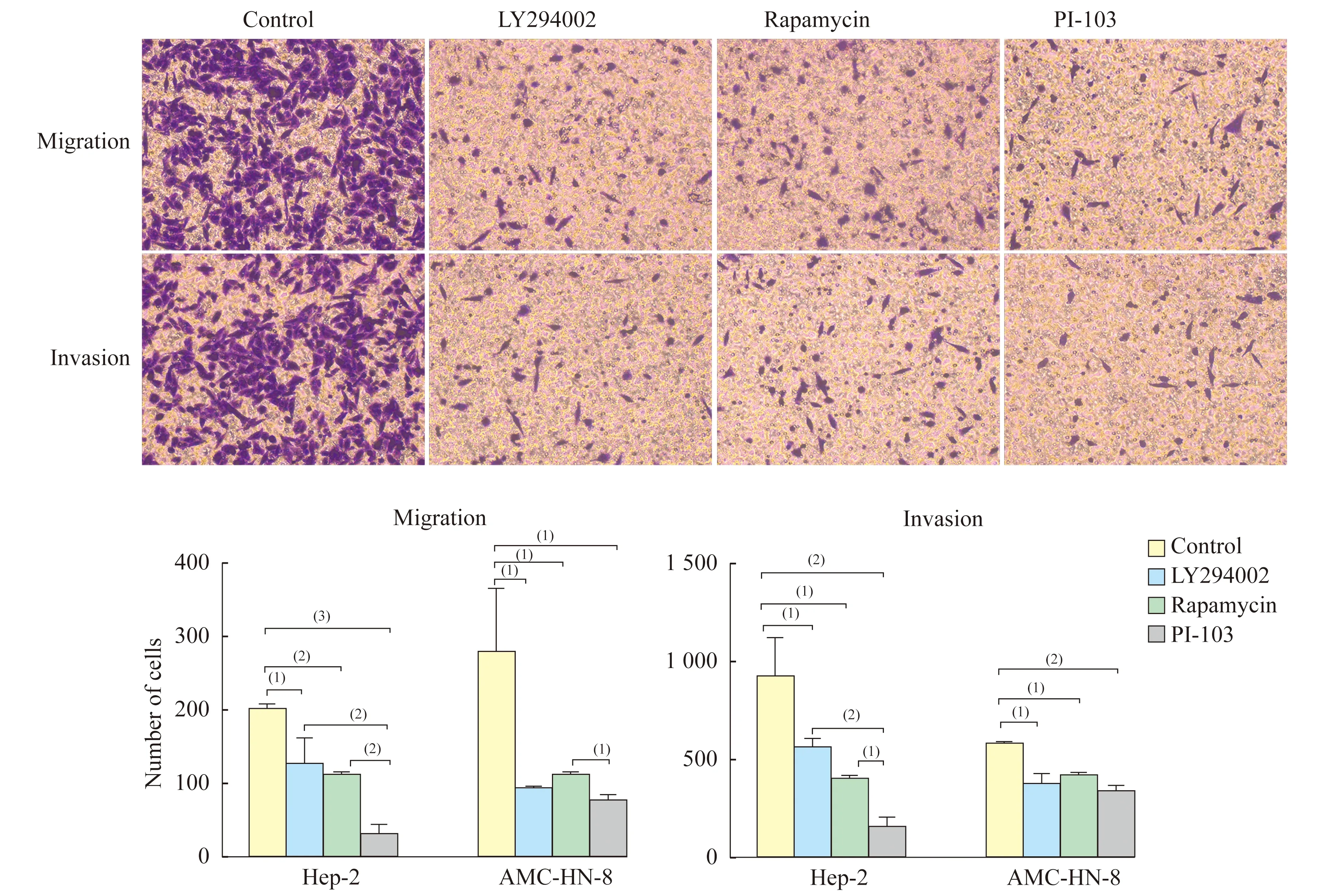
(1)P<0.01;(2)P<0.001;(3)P<0.000 1.Crystal purple staining×100.
图2 阻断PI3K/mTOR信号通路能抑制喉鳞癌细胞迁移和侵袭
Fig 2 Inhibition of migration and invasion of laryngeal squamous carcinoma cell by inhibiting the PI3K/mTOR signal pathway
PI3K/mTOR信号通路抑制剂对喉鳞癌细胞细胞周期、凋亡及该通路相关蛋白质水平的影响 双靶点抑制剂PI-103能够显著抑制PI3K/mTOR信号通路蛋白质的磷酸化,p-AKT和p-4E-BP1表达量显著降低,从而抑制该通路的活性;能使凋亡相关蛋白Caspase9、Caspase3、Caspase8的水平显著升高,而细胞周期相关蛋白Cyclin E1和 Cyclin D1水平显著降低,且相较于单靶点抑制剂(LY294002、Rapamycin),PI-103作用更显著(P<0.05,图3A-C)。
讨 论
喉癌是耳鼻咽喉头颈外科第二高发的鳞状细胞癌,喉癌的病理95%以上为鳞癌,且近20年来发病率有增高趋势。呼吸、发音和吞咽保护是喉的主要生理功能,因此晚期喉癌患者的致残率和致死率较高,尽管过去几十年来治疗方式有不断改进,却并未改善晚期喉癌患者的生存率[5]。如何提高喉癌患者的生存率和生存质量,成为亟待解决的难题。
PI3K/Akt/mTOR通路是细胞蛋白质合成调节的主要信号通路,参与细胞增殖、分化、迁移等调节,研究发现在多种恶性肿瘤,包括在喉鳞癌中过度活化[6]。该信号通路活化可以抑制多种刺激诱发的细胞凋亡,促进细胞周期进展,参与肿瘤血管的形成、侵袭和转移,已经成为肿瘤干预治疗的新靶点,靶向PI3K/Akt/mTOR信号通路的小分子药物为肿瘤治疗提供了新的方向。以往研究较多的是单靶点治疗,如针对PI3K的抑制剂LY294002和mTOR的抑制分子Rapamycin,可抑制某些肿瘤细胞的生长、阻滞细胞周期以及降低肿瘤细胞的侵袭能力,但是信号通路中单靶点抑制导致的反馈激活限制了其总体抗瘤效果,难以实际应用于临床[7]。PI-103是PI3K/mTOR双靶点抑制剂,能特异性抑制PI3K及mTOR活性,并且不会通过信号反馈而激活Akt,抗瘤活性显著优于PI3K抑制剂LY294002及mTOR抑制剂Rapamycin,并且能够增强肿瘤细胞的放疗敏感性[8]。

(1)P<0.01;(2)P<0.001;(3)P<0.000 1;(4)P<0.000 01.
图3 阻断PI3K/mTOR信号通路和喉鳞癌细胞周期、凋亡及该通路相关蛋白质水平
Fig 3 The protein levels of cell cycle,cell apoptosis and signal pathway by inhibiting the PI3K/mTOR signal pathway
本文通过对喉鳞癌细胞的研究发现,PI-103能够显著降低p-AKT 和p-4EBP1的蛋白表达量,表明了其对PI3K/Akt/mTOR通路的有效抑制,并且作用显著优于单靶点抑制剂LY294002和Rapamycin。PI-103能将喉鳞癌细胞周期阻滞于S期,G2期百分含量较对照组显著下降,显著下调细胞周期蛋白Cyclin D1和Cyclin E1的表达,细胞分裂出现抑制,显著促进喉鳞癌细胞的凋亡,凋亡相关蛋白质Caspase 9、8、3水平升高,细胞凋亡率增加。通过细胞迁移和侵袭实验发现,PI-103能够显著抑制喉鳞癌细胞迁移和侵袭,并且以上作用均强于单靶点抑制剂。
综上所述,双靶点抑制剂PI-103能够通过有效抑制PI3K/Akt/mTOR信号通路的活性,在体外阻滞喉鳞癌细胞周期阻滞,抑制细胞分裂,促进细胞凋亡,抑制细胞迁移和侵袭能力,且作用效果显著优于单靶点抑制剂LY294002和Rapamycin,为喉鳞癌进一步的体内实验以及未来的临床应用提供了理论基础。
