体外小鼠nuocyte细胞中IL-13的干预促进CD4+ T细胞向CD4+IL10+细胞的分化
2019-06-18魏瑾瑾汤欣玥
蔺 林 陈 峥 戴 飞 魏瑾瑾 汤欣玥
(复旦大学附属华山医院北院耳鼻咽喉头颈外科 上海 201907)
变应性鼻炎(allergic rhinitis,AR)是由变应原诱导、免疫球蛋白(immunoglobulin,Ig)-E介导、Th2细胞促发的发生于鼻腔黏膜的变态反应性炎症。在AR发病的各种信号通路中,Th2细胞(适应性免疫的关键细胞)合成和释放的Ⅱ型细胞因子白介素(interleukin,IL)-4、IL-5、IL-9和IL-13等起着枢纽的作用[1]。大量研究证实,无论是适应性免疫还是固有免疫,都在AR的发病机制中起着重要作用[2]。
固有淋巴样细胞(innate lymphoid cells,ILCs)是固有免疫的关键细胞,nuocyte细胞属于Ⅱ型(IL2Cs)中的一种。该细胞是在对小鼠寄生虫免疫的研究中发现的。nuocyte细胞在IL-25和/或IL-33的作用下,可在小鼠寄生虫模型的肠系膜淋巴结和脾脏中大量增殖,产生和释放Ⅱ型细胞因子如IL-5、IL-13等,尤其是IL-13,也能产生少量IL-10[3]。随后的研究发现,nuocyte细胞在小鼠哮喘模型的肺组织中也出现增殖,并可以直接导致支气管的高反应性,其诱发机制主要是通过释放大量IL-13而增加了支气管黏膜的炎症反应所致[4]。IL-5可以趋化和激活嗜酸性粒细胞(eosinophil,Eos)[5],IL-13可以促进杯状细胞的增生和黏膜下腺体的分泌,还能诱发气道的高反应性[6]。
我们前期的研究显示,nuocyte细胞在卵清蛋白(ovalbumin,OVA)诱导建立的AR小鼠模型的鼻相关淋巴组织(nasal-associated lymphoid tissue,NALT)中出现增殖,并发现将体外培养的OVA诱导NALT来源的nuocyte细胞过继转移给小鼠后,可以加剧AR小鼠鼻腔黏膜的变应性炎症[7],这种作用也是通过nuocyte细胞产生和释放IL-5和IL-13而诱发的。目前大多数关于nuocyte细胞的研究重心都放在这两种细胞因子上,而对于该细胞分泌的IL-10及其可能的作用研究甚少。本研究旨在探讨体外小鼠nuocyte细胞中IL-13的干预对CD4+IL10+细胞分化的影响。
材 料 和 方 法
实验动物 健康雌性BALB/c小鼠(SPF级)12只,6~8周龄,购自中科院上海实验动物中心,由复旦大学上海医学院实验动物科学部代养。本研究获得复旦大学实验动物科学部动物福利和伦理小组的批准(伦理号:201808001Z)。实验动物随机分为2组,每组6只。
动物模型的建立 按照已经出版的建模方法[8],以浓度为0.5 mg/mL的OVA(美国Sigma公司)和20 mg/mL的Al(OH)3生理盐水溶液共0.2 mL对小鼠进行腹腔注射致敏,致敏3次,每周1次(第1、8和15天),然后用浓度为40 mg/mL的OVA生理盐水溶液0.02 mL滴入小鼠鼻孔进行激惹,每天1次(第22天至29天),共8次,即为AR小鼠;对照组只用生理盐水(正常组)(图1)。打喷嚏和挠鼻次数在最后一次激惹结束后10 min进行计数。

图1 AR小鼠模型的建模步骤
Fig 1 Protocols of AR mice models
小鼠NALT和外周血单个核细胞的获取 处死小鼠,去掉其前牙和面颊部肌肉,由硬腭后半部边缘以细针头小心获取NALT组织,并将该组织放入添加了10%胎牛血清(fetal bovine serum,FBS)的RPMI 1640培养基中,然后将其通过70 μm Falcon细胞筛网滤过,并用三羟甲基氨基甲烷-氯化铵缓冲液(0.83% NH4Cl和20 mmol/L Tris/Cl)裂解红细胞;AR小鼠外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)的获取采用常规摘除小鼠眼球法。
nuocyte细胞的获取 NALT细胞悬液在4 ℃温度和200×g离心10 min后进行流式细胞仪检测。根据多项相关研究所证实的nuocyte细胞膜表面分子表达的特点即CD3CD4CD8CD19CD11bCD11cFcεR1 (lineage)-ICOS+进行设门,细胞用200 μL流式细胞液(1%牛血清白蛋白溶液和0.1% PBS溶液)洗涤,并与兔血清在室温下共培养5 min以封闭Fcγ,然后再用流式细胞液洗涤3次,将细胞调成浓度为1×108/mL,分别用50 μL结合了荧光素异硫氰酸酯-葡聚糖的一抗(抗CD3、CD4、CD8、CD19、CD11b、CD11c、FcεR1的抗体,美国MyBioSource公司或美国BioLegend公司)在4 ℃温度下染色30 min,随后用结合了藻红蛋白的单克隆抗体(抗ICOS的抗体,美国MyBioSource公司)再染。再次洗涤,并与结合了生物素的50 μL兔抗小鼠的二抗IgG共培养,随后加入50 μL结合了链霉亲和素的藻红蛋白(丹麦Dako公司),对照组只用与上述抗体同型的一抗染色。样品用装备了ACSDIVA 软件系统(美国BD Biosciences公司)的LSR II型流式细胞仪进行分析,并用FlowJo version 10进行数据输出。
nuocyte细胞体外培养和rmIL-33干预 nuocyte细胞分离、提纯后调成6 × 107/mL浓度,并在含有10% FBS、1%青霉素/链霉素、0.1% β-巯基乙醇、10 ng/mL小鼠重组(recombinant,rm)IL-7(美国MyBioSource公司)和10 ng/mL小鼠rmIL-33(美国MyBioSource公司)的RPMI培养基中体外培养6天。然后收集nuocyte细胞,重新加入100 ng/mL小鼠rmIL-33(美国MyBioSource公司)培养3天,ELISA法检测细胞上清液中IL-13和IL-10的浓度。
IL-13 shRNA慢病毒的构建及转染 IL-13 shRNA序列的选择和含有该序列慢病毒的构建均由生工生物工程(上海)股份有限公司提供,用293T细胞包装慢病毒,以PANC细胞检测慢病毒转染效率,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)作为核染色的空白对照,构建完成后,将其以1× 109TU/mL的滴度加入nuocyte细胞培养基进行转染,3天后,用ELISA法检测培养基上清液中IL-13和IL-10的浓度。
具体方法分别按照小鼠IL-13和IL-10 ELISA试剂盒(美国MyBioSource公司)所规定的步骤进行。
CD4+T细胞的获取 小鼠CD4+T细胞的分离、提纯按照相关试剂盒EasySepTMMouse CD4+T Cell Isolation Kit (加拿大STEMCELL公司)所规定的步骤进行,该方法获得的CD4+T细胞得率高、纯度高,方便下一步实验;将分选出的CD4+T细胞调成浓度5 × 105/mL并移入T细胞培养基(1640,10% FBS,1%青霉素-链霉素,50 μmol/L β-巯基乙醇,100 U/mL IL-2)中体外培养6天,然后把nuocyte细胞加入CD4+T细胞培养基中,共培养3天,检测CD4+IL10+细胞占CD4+T细胞的百分比。
CD4+IL10+细胞的检测 流式细胞仪检测CD4+IL10+细胞占CD4+T细胞的百分比,方法和步骤同上述“nuocyte细胞的获取”,一抗分别用结合了FITC的抗CD4抗体和结合了PE的抗IL-10抗体,所得数据用FlowJo 10进行分析。

结 果
AR小鼠模型的建立 小鼠采用经典方式建模,OVA腹腔内致敏,OVA及其佐剂鼻内激惹(图1)。末次激惹后10 min,分别计数小鼠打喷嚏和挠鼻次数,发现AR组与正常组比较,差异具有统计学意义,AR模型明显超过正常小鼠(t=54.44,P<0.000 1;t=33.75,P<0.000 1)。提示AR小鼠模型建立成功。
nuocyte细胞的鉴定 建模后,用流式细胞仪设门技术,分选、提纯NALT中nuocyte细胞。nuocyte细胞被鉴定为CD3CD4CD8CD19CD11bCD11cFcεR1 (lineage)-ICOS+(图2A和B),而且AR小鼠的nuocyte细胞数较正常小鼠显著增多(图2C)。
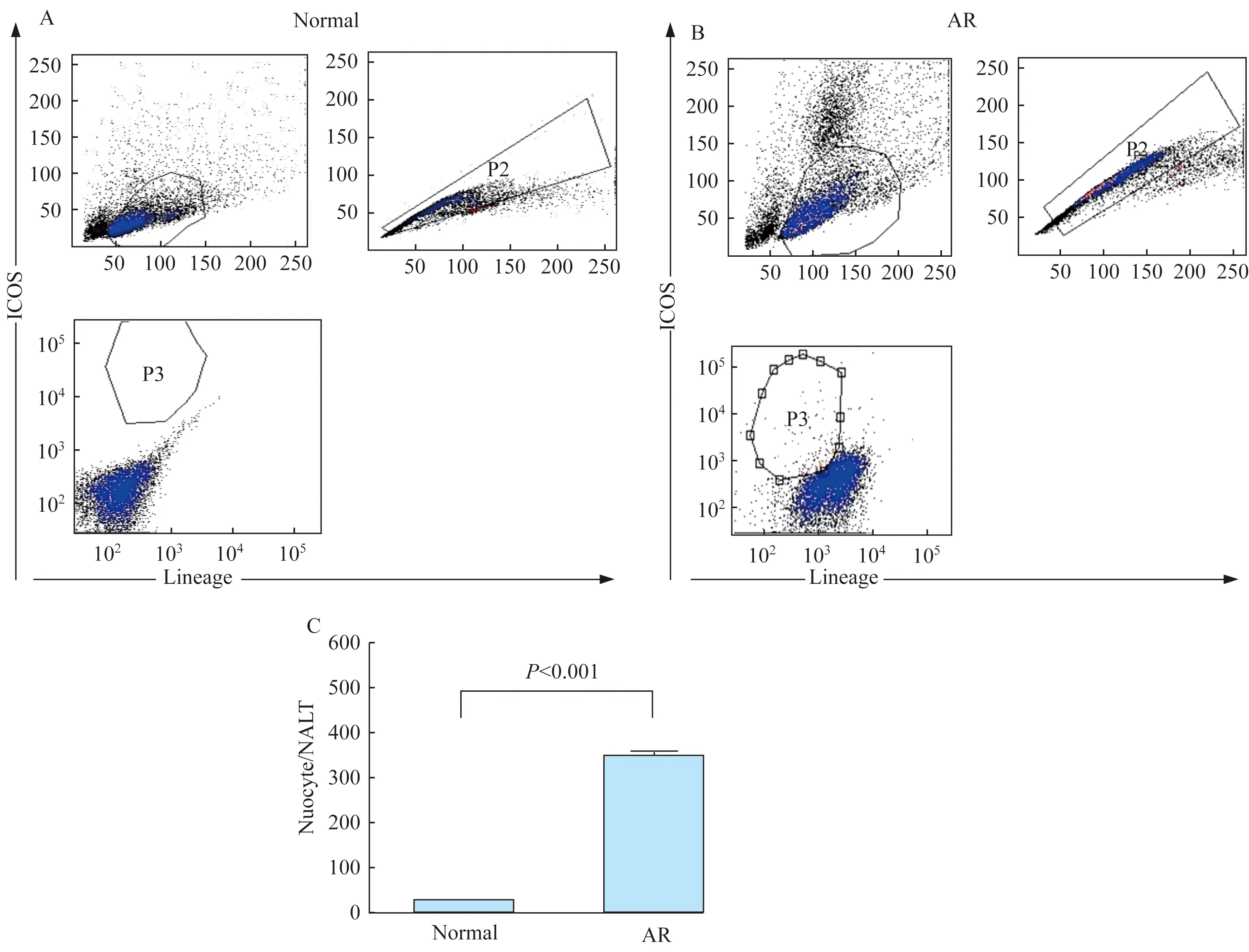
A:NALT nuocytes from normal mice;B:NALT nuocytes from AR mice;C:Comparison of nuocytes numbers in normal and AR mice.AR:Allergic rhinitis.
图2 小鼠AR模型的NALT中nuocyte细胞的流式细胞仪分析
Fig 2 Flow cytometry analysis of NALT nuocytes from AR mice models
nuocyte细胞的转染率 IL-13 shRNA慢病毒转染nuocyte细胞的效率以分析绿色荧光蛋白在转染的PANC细胞中的表达量来评估,感染复数设置为10,IL-13 shRNA的转染率为98.28%;IL-13的转录抑制率以分析其mRNA在PANC细胞中的含量来评估,当感染复数设置为10时,IL-13 shRNA的抑制率为90.5%。nuocyte细胞的转染定性评估见图3A和3B。
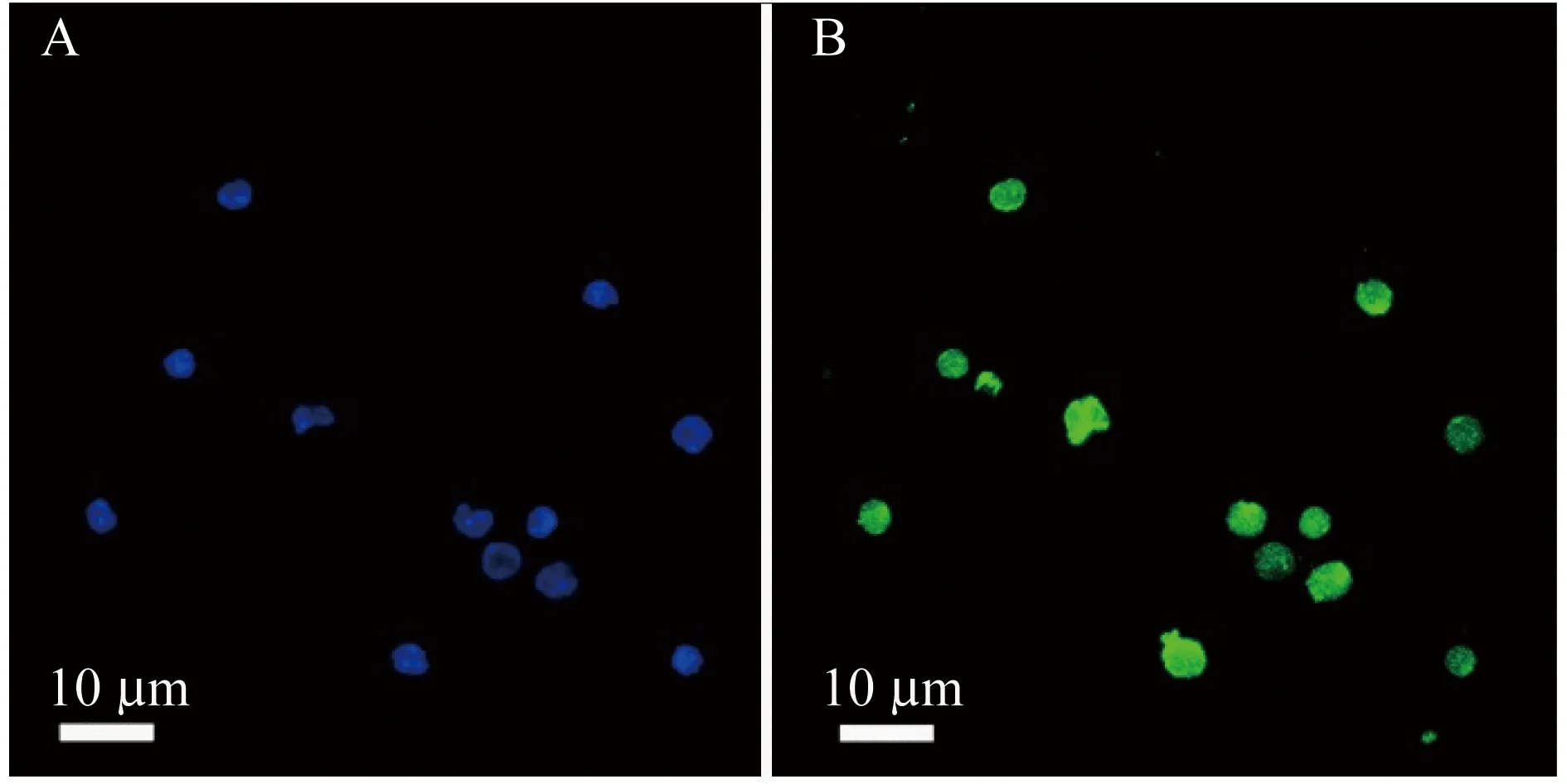
A:Blank control,blue fluorescence indicated DAPI staining (× 400);B:Positive staining of nuocytes,green fluorescence indicated transfection of nuocytes by lentivirus with IL-13 shRNA (× 400).
图3 IL-13 shRNA慢病毒转染nuocyte细胞
Fig 3 Transfection of nuocytes by lentivirus with IL-13 shRNA
nuocyte细胞对rmIL-33的反应 nuocyte细胞的特点是合成和释放Ⅱ型细胞因子如IL-13,也可以释放少量的抑制性细胞因子IL-10。为了检测OVA诱导NALT来源的nuocyte细胞是否具有其相应的功能,我们用ELISA法检测体外培养的此种细胞是否分泌IL-13和IL-10,以及是否受IL-13 shRNA慢病毒转染的影响。结果发现,转染前rmIL-33干预后体外培养的细胞大量释放IL-13和IL-10,IL-13与IL-10浓度均显著高于干预前,差异有统计学意义(t=22.62、11.93,P均<0.000 1,图4A、B)。这证明OVA诱导产生的nuocyte细胞具有其正常的功能。而转染后,rmIL-33干预后体外培养的nuocyte细胞释放IL-13没有明显升高,与干预前相比较,其浓度差异无统计学意义(图4C)(t=1.67,P=0.14),而IL-10的浓度干预后显著高于干预前(图4D)(t=30.45,P<0.000 1)。转染前IL-13的浓度明显高于转染后(图4E)(t=22.54,P<0.000 1),IL-10的浓度明显低于转染后(图4F)(t=9.29,P<0.000 1),差异均有统计学意义。
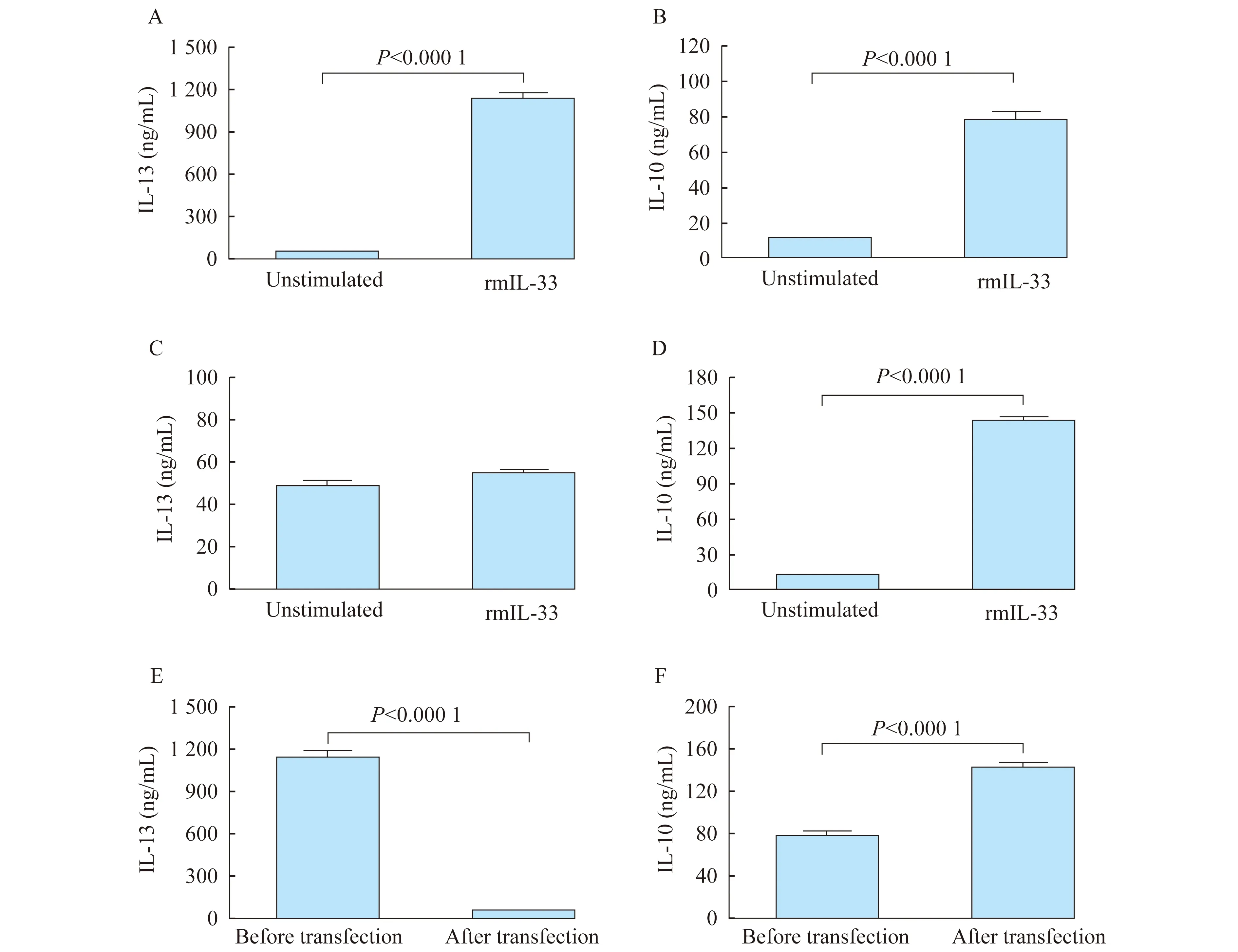
A:Concentration of IL-13 in the cultures before transfection;B:Concentration of IL-10 in the cultures before transfection;C:Concentration of IL-13 in the cultures after transfection;D:Concentration of IL-10 in the cultures after transfection;E:Comparison of concentration of IL-13 in the cultures before and after transfection;F:Comparison of concentration of IL-10 in the cultures before and after transfection.
图4 转染前后AR小鼠NALT来源的nuocyte细胞对rmIL-33干预后的反应
Fig 4 Response of NALT-derived nuocytes to rmIL-33 before and after transfection
nuocyte细胞对CD4+T细胞的诱导 为了证实nuocyte细胞对CD4+T细胞的诱导作用及是否受IL-13 shRNA慢病毒转染的影响,我们将转染前后NALT来源的该细胞与CD4+T细胞培养基进行体外共培养,结果发现CD4+IL10+细胞所占CD4+T细胞百分比发生变化(图5A和5B),转染后的nuocyte细胞共培养后,CD4+IL10+细胞百分比明显升高(t=10.00,P< 0.0001)(图5C)。这表明,nuocyte细胞受IL-13 shRNA慢病毒转染的影响,促进CD4+T细胞向CD4+IL10+细胞的分化。
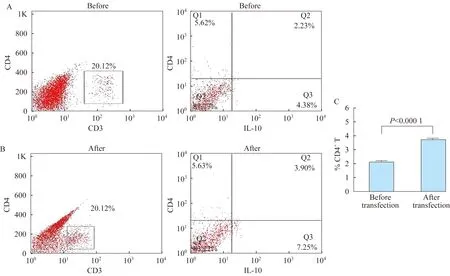
A:Flow cytometry analysis of CD4+IL10+cells in the cocultures before transfection,Q2 area indicated CD4+IL10+cells;B:Flow cytometry analysis of CD4+IL10+cells in the cocultures after transfection;C:Comparison of percentage of CD4+IL10+cells in total CD4+T cells before and after transfection.
图5 nuocyte细胞对CD4+T细胞的诱导
Fig 5 Induction of CD4+IL10+cells from CD4+T cells by nuocytes
讨 论
变态反应性炎症中适应性免疫系统Th2细胞是Ⅱ型细胞因子如IL-4、IL-5、IL-9和IL-13的主要来源,但越来越多的研究证实,固有免疫系统ILC2s也可以产生这类细胞因子,并诱发Eos局部的浸润、肥大细胞的增殖、杯状细胞的增生和分泌的病理改变[9]。还有研究表明,IL-13可直接导致呼吸道高反应,Th2细胞并非是该细胞因子的主要来源,ILC2s才是[10]。有学者按照ILC的特点和功能将其分为3型:ILC1s、ILC2s和ILC3s,每型都有相应的细胞种类。nuocyte细胞属于Ⅱ型;ILC2s还包括自然辅助细胞和固有辅助细胞Ⅱ型,虽然这些细胞种类不同,但它们共同的特点都是表达IL-25受体(IL-17BR)和IL-33受体(T1/ST2),均可在IL-25和IL-33的作用下产生炎症介质IL-5和IL-13[11]。变态反应性炎症状态下,IL-25和IL-33主要由呼吸道上皮细胞产生[12],虽然它们属于不同的细胞因子家族,但却具有上述类似的细胞反应[13]。大量研究证实,这两种细胞因子可以诱导Ⅱ型免疫反应,用IL-25和/或IL-33干预后,会产生大量Ⅱ型细胞因子如IL-5和IL-13,并导致局部相应的病理改变[14-15]。
nuocyte细胞除了分泌Ⅱ型细胞因子促进炎症反应外,也可以产生和释放少量IL-10。目前关于nuocyte细胞的研究重心大都放在IL-5和IL-13两种细胞因子上,而对于该细胞分泌的IL-10及其可能的作用研究甚少。但该细胞既然释放IL-10,可能就会有相应的功能,而IL-10又有诱导CD4+T细胞向CD4+IL10+细胞分化的作用,因此我们课题组假设nuocyte细胞来源的IL-10可能会影响T辅助细胞向CD4+IL10+细胞的分化。本研究即是初步探讨体外小鼠nuocyte细胞中IL-13的干预是否会影响IL-10的产生和释放,并进一步探讨后者对CD4+T细胞向CD4+IL10+细胞分化可能造成的影响。
本研究中,用OVA建模后,小鼠打喷嚏和挠鼻次数明显增加,说明AR小鼠模型建立成功。我们选择AR小鼠NALT中的nuocyte细胞,是因为炎症状态下的该细胞数目不仅增多(本研究中也显示AR小鼠的nuocyte细胞数较正常小鼠显著增多),而且处于激活状态,方便对其功能进行研究。获得了AR小鼠的nuocyte细胞后,在体外对其功能进行了检测,发现其在转染前受到小鼠rmIL-33的干预后大量释放IL-13,并释放少量的IL-10,说明该细胞功能正常。随后,我们构建了IL-13 shRNA,并以慢病毒为载体体外转染到nuocyte细胞中,以抑制IL-13基因在该细胞中的表达。我们没有直接用IL-13基因敲除小鼠,因为IL-13-/-小鼠建模不成功会对研究造成较大影响(数据尚未发表),而携带有IL-13 shRNA的慢病毒转染稳定,且只影响nuocyte细胞产生和释放IL-13的功能,结果更客观与可靠。结果发现,nuocyte细胞经转染后,rmIL-33的干预没有使nuocyte细胞释放IL-13的浓度升高,与干预前相比较,IL-13的浓度差异不具有统计学意义,但分泌IL-10的浓度差异具有统计学意义,干预后显著高于干预前。IL-13的浓度变化转染前明显高于转染后,差异具有统计学意义,IL-10的浓度变化转染前明显低于转染后,差异也具有统计学意义。这说明,nuocyte细胞中IL-13基因转录的阻滞可以使抑制性细胞因子IL-10的产生和释放增加,可能在两种细胞因子的基因序列之间有某种联系,目前其机制尚不清楚。我们又将转染前后的nuocyte细胞加入体外培养的CD4+T细胞中,以评估该细胞对CD4+IL10+细胞的分化是否有诱导作用。结果发现CD4+IL10+细胞所占CD4+T细胞百分比发生变化,转染后的nuocyte细胞共培养后CD4+IL10+细胞百分比明显升高。这表明该细胞受IL-13 shRNA慢病毒转染的影响,IL-13释放量减少,而IL-10释放量增加,后者可通过其位于CD4+T细胞上的相应受体,调节该细胞向CD4+IL10+细胞的分化[16]。
nuocyte细胞也可以产生和释放IL-5,但其量甚微,该细胞的主要特点是产生IL-13,并在局部组织(如肠道和肺组织)中实施相应功能[3-4],所以本研究中未检测IL-5,而IL-13 shRNA的作用是否也会影响IL-5的产生,后者浓度的改变是否也会诱导CD4+IL10+细胞比例增加,尚待进一步研究。
CD4+IL10+细胞可通过产生和分泌IL-10抑制局部的炎症反应,就AR或哮喘等呼吸道的变态反应性炎症而言,该细胞通过释放IL-10,后者通过其受体激活抑制气道炎症的通路,从而减轻鼻黏膜或支气管黏膜的变应性炎症[17]。因此,可以考虑设计某种药物或其他相关治疗方法,通过抑制nuocyte细胞中IL-13基因的转录表达,从而增加IL-10的产生和释放,在直接抑制炎症反应的同时,诱导CD4+T细胞向CD4+IL10+细胞转化,后者再释放IL-10,继续抑制局部的炎症。
本研究发现体外小鼠nuocyte细胞中IL-13基因的干预可以促进CD4+T细胞向CD4+IL10+细胞的分化,但IL-13浓度的降低与IL-10的释放增多之间是否存在某种调控机制,以及IL-13 shRNA是否会直接影响IL-10的表达,尚待进一步研究。
