磁共振(MRI)扩散峰度成像(DKI)与拉伸指数模型(SEM)评价裸鼠原位肝细胞癌(HCC)异质性
2019-06-18杨烁慧韩志宏傅彩霞赵梦龙
郭 然 林 江 杨烁慧,3△ 韩志宏 严 序 傅彩霞 赵梦龙
(1上海市影像医学研究所 上海 200032; 2复旦大学附属中山医院放射科 上海 200032;3上海中医药大学附属曙光医院放射科,4病理科 上海 200021;5西门子医疗磁共振科研市场部 上海 201318;6西门子(深圳)磁共振有限公司应用开发部 深圳 518057)
肿瘤异质性 (tumor heterogeneity) 是指肿瘤内及肿瘤间存在的基因和表型的差异,受到基因与环境的共同作用,是造成肿瘤致死、治疗无效及药物抵抗的重要原因之一[1-2]。肿瘤异质性一定程度上反映了肿瘤的生物学特征,如生长方式、侵袭能力和对药物的敏感性等,它涵盖多方面,其中包括随着肿瘤的发生、发展及与治疗相关的空间及时间异质性[3]。
磁共振(magnetic resonance imaging,MRI)扩散加权成像(diffusion weighted imaging,DWI)可用于评估肿瘤细胞增殖和肿瘤坏死程度[4]。由于肿瘤组织内水分子扩散不符合高斯分布,传统DWI模型无法评价肿瘤的异质性[5]。有研究指出MRI扩散峰度成像(diffusion kurtosis imaging,DKI)和拉伸指数模型(stretched exponential model,SEM)有助于肿瘤异质性的评估,并可用于鉴别肿瘤良恶性、区分高低级别、评价预后以及监测疗效[5-8]。
目前,使用DKI和SEM评估肝细胞癌(hepatocellular carcinoma,HCC)肿瘤异质性的报道较少[9-11],而与组织病理学相对照的研究更少。本实验通过建立裸鼠原位HCC模型,观察在自然生长状态下肿瘤的空间异质性及随时间延长而改变的时间异质性,分析不同时间点间DKI和SEM各参数间的差异,以及各参数与组织病理学指标之间的相关性,从而客观评估DKI和SEM方法用于观察HCC肿瘤空间和时间异质性的价值。
材 料 和 方 法
实验造模和实验方案 本实验通过复旦大学附属中山医院实验动物管理委员会备案和批准。使用人HCC-LM3细胞系和4~6周龄体质量为23~25 g的BALB/c雄性裸鼠(中国科学院上海药物研究所)建立裸鼠原位HCC模型[4]。将相同体积人HCC-LM3细胞瘤块(1 mm3)植入25只裸鼠肝左叶包膜下,并将25只瘤鼠随机分为A、B、C、D和E组,每组5只,分别在肿瘤生长至第21、28、35、42和49天进行MRI扫描[12]。
MRI扫描方法 瘤鼠按40 mg/kg腹腔注射1.5%戊巴比妥钠进行麻醉,然后俯卧位固定于动物架上,在西门子MAGNETOM Aera 1.5T磁共振成像仪上使用16通道腕关节线圈分别进行常规MRI (T1WI和T2WI横断位,T2WI冠状位)和DKI-SEM序列扫描。常规T1WI和T2WI扫描均采用自旋回波序列,层厚2 mm,层间距0.2 mm,视野100 mm×100 mm。DKI-SEM序列为单次激发平面回波扩散加权成像序列,层厚2 mm,层间距0.4 mm,视野176 mm×295 mm,TR 5 000.0 ms,TE 75.0 ms,带宽1 405 Hz/像素,扫描矩阵118×198;所用6个b值(激励次数)为0 (1)、500 (2)、800 (3)、1 000 (4)、1 500 (6)和2 000 (6) s/mm2[9,13],每个非零b值均采用3个相互正交的扩散编码方向,并行采集加速因子为2。
图像后处理和测量 扫描完成后,将瘤鼠的DKI-SEM原始DICOM图像导入电脑,使用基于Mathworks的 MATLAB软件编写的图像处理程序,利用高斯滤波器以3 mm的半高全宽值抑制扩散加权图像的噪声[14]。分别根据以下模型对逐个体素进行DKI和SEM信号拟合获得各参数图:S(b)/S(0)=exp(-b·MD + 1/6·b2·MD2·MK);S(b)/S(0)=exp[-(b·DDC)α][5]。其中,S(b)代表扩散加权因子为b时的信号强度;S(0)代表无扩散加权因子时的信号强度。平均扩散系数(mean diffusivity,MD)表示校正非高斯运动后的表观扩散系数(apparent diffusion coefficient,ADC)值;平均峰度(mean kurtosis,MK)反映水分子运动偏离高斯分布的程度;扩散分布指数(distributed diffusion coefficient,DDC)代表组织平均扩散速率;α是扩散异质性指数,描述组织内水分子扩散的不均匀性[5]。传统单指数扩散模型所产生的ADC由图像处理程序自动生成。在对瘤鼠模型分组和组织病理学结果均不知情的情况下,2名分别具有12年和25年肝脏MRI诊断经验的医师对图像进行后处理分析和评价:先在T2WI横断位图像上选取肿瘤最大径层面、测量肿瘤最大径以获得肿瘤大小[4],然后参照T1WI和T2WI横断位图像,避开出血区域,分别在ADC图像上于肿瘤最大径层面沿肿瘤边缘手动勾画感兴趣区(region of interest,ROI)[4,14],再自动拷贝到DKI和SEM各参数图上(图1、2)。每个观察者在同一肿瘤同一层面上测量2次,结果取平均值,1个月后重复该项操作。将具有25年诊断经验的医师2次得到的均值再次平均获得最终结果,用于后续的统计学分析。
组织病理学检查 MRI扫描结束后处死瘤鼠,取下肿瘤连同肝脏放入10 %缓冲甲醛溶液中固定24 h。根据DKI和SEM扫描层厚度,取肿瘤中央约2 mm组织进行石蜡包埋,薄切为3 μm厚度的切片后染色。由具备10年诊断经验的病理科医师使用Aperio ScanScope和Leica SCN400对组织病理学切片行全景扫描后导出数字化图像,使用SlidePath Gateway Client软件对这些图像进行观察、放大、摄片、并以JPG格式保存,然后再将JPG图像导入ImageJ(V1.48)和Image-Pro Plus(V6.0)软件后获得组织病理学结果。首先行HE染色显示肿瘤整体、细胞和组织的形态及结构,经全景扫描获得的原始数字化图片(肿瘤中央切面)转换成JPG图片后,再通过ImageJ软件转换成灰阶图,后者中每个像素均附有对应的灰度值,接着对图片进行直方图分析获得像素灰度的分布情况,然后测量得到反映肿瘤空间异质性的指标即标准差(standard deviation,SD)和峰度[15-18]。其次,将HE染色的肿瘤图像放大20倍后随机取5个区域计算得到坏死分数(necrotic fraction,NF),NF为视野内肿瘤坏死面积/视野内肿瘤面积[19]。行抗CD31染色以获取肿瘤内微血管密度(micro-vessel density,MVD),即先将抗CD31染色肿瘤图像放大4倍,找到3个抗CD31染色阳性血管最密集的区域,然后放大20倍进行血管计数,得到肿瘤最大微血管密度[4]。行抗Ki-67染色观察肿瘤内细胞增殖情况,在抗Ki-67染色肿瘤图像上随机选取5个区域放大20倍后计算阳性细胞数占比,得到Ki-67指数[20]。
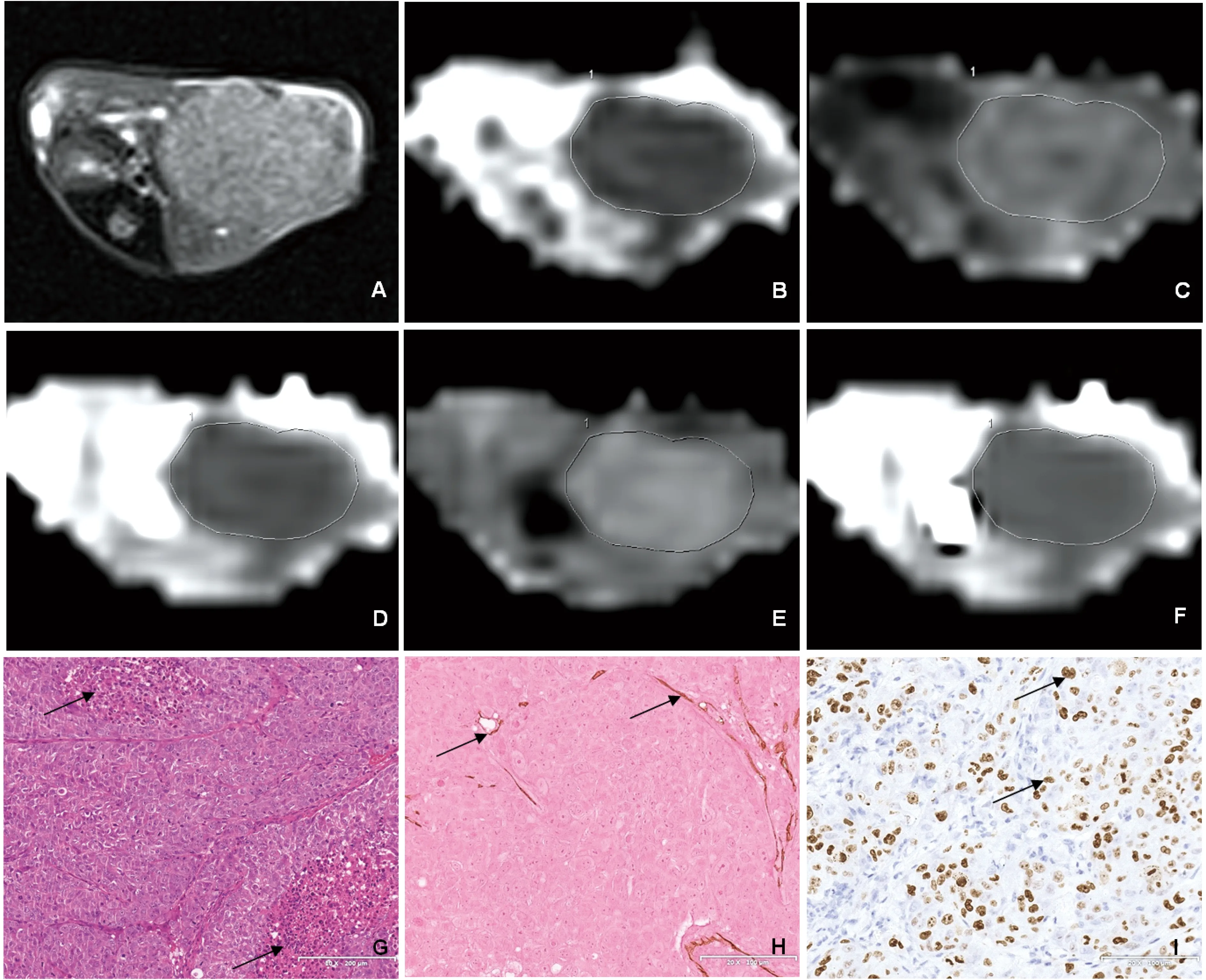
Transverse T2WI shows the greatest dimension of a tumor (A).ADC map for ROI outlining the tumor (B).Images of MK map (C),MD map (D),α map (E) and DDC map (F) of the tumor (MK=1.170,MD=0.622×10-3mm2/s,α= 0.795,DDC = 0.493×10-3mm2/s).HE staining image shows patchy and irregular necrosis (G,black arrows,10×) in the tumor.Anti-CD31 and anti-Ki-67 immunohistochemistry images show intratumoral micro-vessels (H,black arrows,20×) and Ki-67 positive cells (I,black arrows,20×) in the tumor.
图1 B组(第28天) HCC瘤鼠DKI和SEM各参数图和组织病理学切片
Fig 1 DKI and SEM images and corresponding histopathological images of a nude mouse with xenograft HCC of group B (on the 28thday)

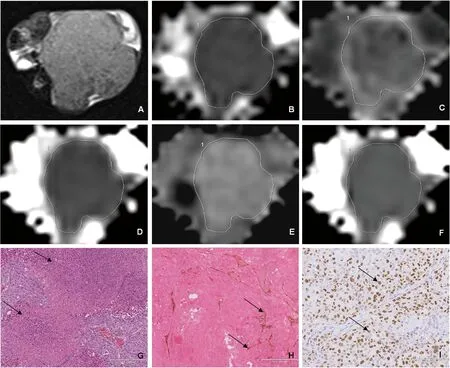
Transverse T2WI shows the greatest dimension of a tumor (A).ADC map for ROI outlining the tumor (B).Images of MK map (C),MD map (D),α map (E) and DDC map (F) of the tumor (MK=1.250,MD=0.684×10-3mm2/s,α=0.780,DDC=0.543×10-3mm2/s).HE staining image shows massive necrosis (G,black arrows,10×) in the tumor.Anti-CD31 and anti-Ki-67 immunohistochemistry images show intratumoral micro-vessels (H,black arrows,20×) and Ki-67 positive cells (I,black arrows,20×) in the tumor.
图2 E组(第49天) HCC瘤鼠DKI和SEM各参数图和组织病理学切片
Fig 2 DKI and SEM images and corresponding histopathological images of a nude mouse with xenograft HCC of group E (on the 49thday)
结 果
裸鼠原位HCC模型各组扫描结果 DKI-SEM扫描在25只瘤鼠中均顺利完成,各参数图中肿瘤均显示清晰,各参数的观察者内和观察者间测定的一致性良好(ICCs=0.897-0.947)。各组中共有5只瘤鼠(B组1只,C组1只,D组1只和E组2只)肉眼可见肿瘤内出血,但均未发生于肿瘤测量层面。
裸鼠原位HCC模型各组间DKI和SEM各参数的比较 各组间MK、MD、α和DDC值差异均有显著统计学意义(表1)。肿瘤MK值随时间延长逐渐上升,种植瘤生长至第49天(E组),MK值下降;其中,D组MK值明显高于A组和B组(Z=-2.410和-2.410,P=0.016和0.016),E组明显低于D组(Z=-2.417,P=0.016)。肿瘤α值随时间延长逐渐降低,但在E组有所升高;其中,D组明显低于A组和B组(Z=-2.522和-1.991,P=0.012和0.047),E组显著高于D组(Z=-2.200,P=0.028)。B组肿瘤MD和DDC值较A组略有下降,但未见统计学差异,而C组至E组的MD和DDC值逐渐上升;其中,D组显著高于B组(MD:Z=-2.095,P=0.036;DDC:Z=-1.997,P=0.046),E组显著高于B组和C组(MD:Z=-2.200和-2.200,P=0.028和0.028;DDC:Z=-2.402和-2.095,P=0.016和0.036)。其余组间肿瘤MK、MD、α和DDC值均未见统计学差异。
表1 裸鼠原位HCC模型各组间DKI和SEM各参数的比较
Tab 1 Comparisons of DKI and SEM parameters of nude mice with xenograft HCC among different groups
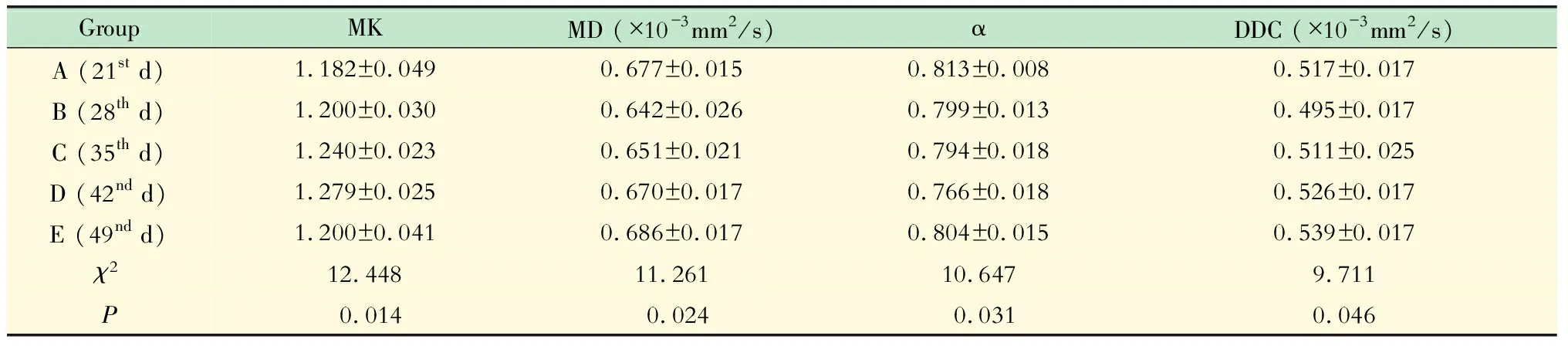
GroupMKMD (×10-3mm2/s)αDDC (×10-3mm2/s)A (21st d)1.182±0.0490.677±0.0150.813±0.0080.517±0.017B (28th d)1.200±0.0300.642±0.0260.799±0.0130.495±0.017C (35th d)1.240±0.0230.651±0.0210.794±0.0180.511±0.025D (42nd d)1.279±0.0250.670±0.0170.766±0.0180.526±0.017E (49nd d)1.200±0.0410.686±0.0170.804±0.0150.539±0.017χ212.44811.26110.6479.711P0.0140.0240.0310.046
HCC:Hepatocellular carcinoma;DKI:Diffusion kurtosis imaging;SEM:Stretched exponential imaging;MK:Mean kurtosis;MD:Mean diffusivity;DDC:Distributed diffusion coefficient.
裸鼠原位HCC模型各组间肿瘤大小和组织病理学指标的比较 裸鼠原位HCC肿瘤不断增大,B组和C组明显大于A组(Z=-2.660和-2.635,P=0.008和0.008),D组明显大于A组和B组(Z=-2.627和-2.333,P=0.009和0.020),E组明显大于A、B、C和D组(Z=-2.627、-2.643、-2.009和 -1.997,P=0.009、0.008、0.045和0.046)。SD和峰度值在B、C和D组逐渐升高,在E组则有所降低;其中,C组显著高于A组(SD:Z=-2.193,P= 0.028;峰度:Z=-2.193,P=0.028),D组显著高于A、B和C组(SD:Z=-2.611、-2.611和 -2.193,P=0.009、0.009和0.028;峰度:Z=-2.611、-2.611和-2.611,P=0.009、0.009和0.009),E组显著低于D组(SD:Z=-2.611,P=0.009;峰度:Z=-2.611,P=0.009)。随时间延长,HCC肿瘤的NF、MVD和Ki-67指数均有所升高,各组间比较差异均具有统计学意义(表2)。C组NF明显大于A组和B组(Z=-2.611和-2.611,P=0.009和0.009),D组明显大于A、B和C组(Z=-2.611、-2.611和 -2.402,P=0.009、0.009和0.016),E组明显大于A、B、C和D组(Z均=-2.611,P均=0.009)。D组和E组的MVD明显高于A组(Z=-2.227和-2.627,P=0.026和0.009)。C组的Ki-67指数明显高于A组(Z=-2.402,P= 0.016),D组和E组的Ki-67指数明显高于A组和B组(D组:Z=-2.611和-2.611,P=0.009和0.009;E组:Z=-2.611和-2.611,P=0.009和0.009)。
表2 裸鼠原位HCC各组间组织病理学指标的比较
Tab 2 Comparisons of histopathological results of nude mouse xenograft HCC among different groups
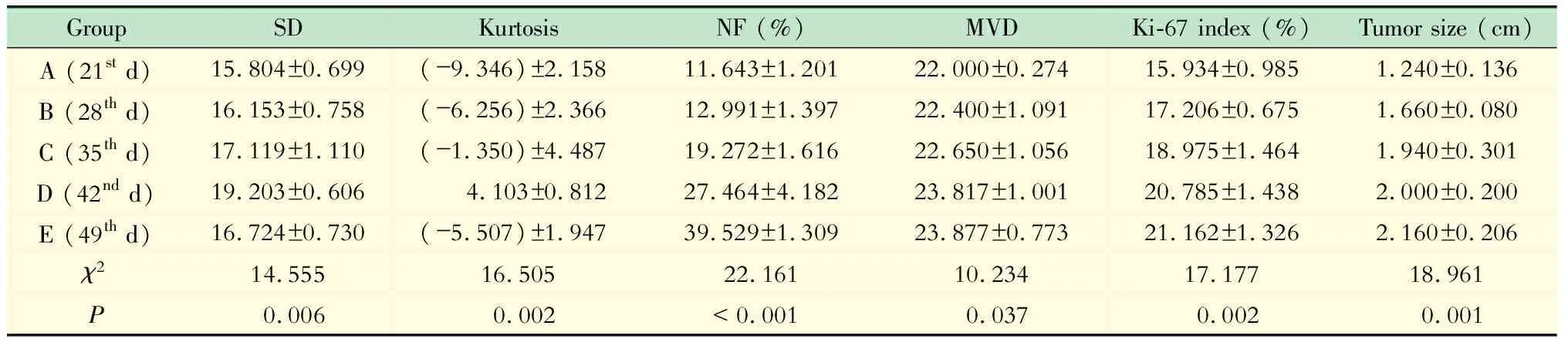
GroupSDKurtosisNF (%)MVDKi-67 index (%)Tumor size (cm)A (21st d)15.804±0.699(-9.346)±2.15811.643±1.20122.000±0.27415.934±0.9851.240±0.136B (28th d)16.153±0.758(-6.256)±2.36612.991±1.39722.400±1.09117.206±0.6751.660±0.080C (35th d)17.119±1.110(-1.350)±4.48719.272±1.61622.650±1.05618.975±1.4641.940±0.301D (42nd d)19.203±0.6064.103±0.81227.464±4.18223.817±1.00120.785±1.4382.000±0.200E (49th d)16.724±0.730(-5.507)±1.94739.529±1.30923.877±0.77321.162±1.3262.160±0.206χ214.55516.50522.16110.23417.17718.961P0.0060.002< 0.0010.0370.0020.001
SD:Standard deviation;NF:Necrotic fraction;MVD:Micro-vessel density.
裸鼠原位HCC模型DKI和SEM各参数与组织病理学各指标间的相关性 5组HCC肿瘤的MK值与SD和峰度值呈高度正相关(P均=0.001),α值与SD和峰度值呈高度负相关(P均=0.001)。5组肿瘤的MK和α值与NF、MVD、Ki-67指数以及肿瘤大小未见明显相关性;去除E组后,MK值与上述各指标均呈显著中度正相关(P均<0.05),α值与上述各指标呈显著中度负相关(P均<0.05)。5组肿瘤MD和DDC值与NF呈中度正相关(P均<0.05),与肿瘤大小则未见明显相关性;去除A组后,二者与NF呈显著高度正相关(P均=0.001),与肿瘤大小呈显著中度正相关(P均<0.05,表3)。
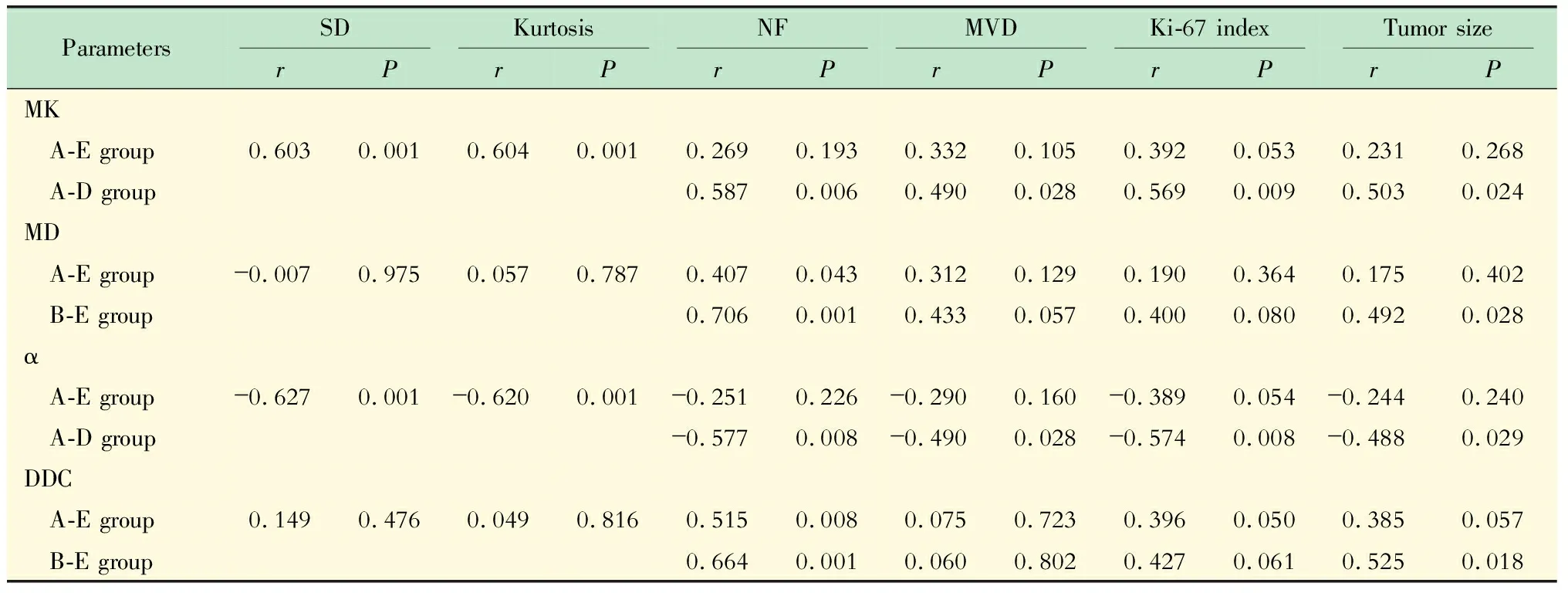
表3 裸鼠原位HCC各组DKI和SEM各参数与组织病理学各指标间的相关性Tab 3 Correlations between DKI and SEM parameters and histopathological results of nude mouse xenograft HCC at different time points among groups
讨 论
空间和时间异质性是肿瘤异质性的重要方面之一,与肿瘤发生、发展及治疗过程中肿瘤内部不同成分的演变有关[3,22]。肿瘤空间异质性越高,预后越差[3]。肿瘤异质性在肿瘤的临床诊断、治疗和预后评价等方面具有重要价值。本研究发现DKI和SEM方法能够一定程度上反映HCC的空间异质性,并监测到HCC自然生长状态下,肿瘤异质性随时间的延长而变化,与组织病理学指标相关。因此,DKI和SEM参数或许可以成为评价肿瘤时空异质性的生物影像学指标。
本研究发现随时间的延长,肿瘤大小不断增大,NF、MVD、Ki-67指数不断升高。进一步分析肿瘤HE染色切片,发现在第28、35、42天,裸鼠原位HCC的SD和峰度值均有所升高,而在第49天,肿瘤的SD和峰度值降低。有研究者指出肿瘤的SD和峰度值越大,组织的空间异质性越大[17- 18]。本研究组织病理学检查证实裸鼠原位HCC于自然生长状态下从第21天至第42天肿瘤空间异质性增大,在第49天有所减小。
MK反映水分子运动偏离高斯分布的程度,MK为0时,水分子运动符合高斯分布。α值反映组织内水分子扩散的不均匀性,范围为0~1,α越接近1说明信号衰减越接近单指数模型信号衰减。MK和α均与组织的复杂程度有关,MK值越高、α值越低代表组织异质性越大[13,23]。在乳腺癌的研究中,发现高级别肿瘤MK值明显高于低级别肿瘤,肿瘤MK值与组织学分级和肿瘤增殖指标Ki-67指数显著正相关[14,20];肿瘤直径越大、Ki-67指数越高的肿瘤α值越小[24]。Ren等[25]对胶质瘤的研究发现高级别肿瘤的α值明显低于低级别肿瘤,α值与肿瘤组织学分级和Ki-67指数存在显著负相关。本研究在HCC模型中也发现了类似的结果,在去除第49天的E组后,肿瘤MK值与Ki-67指数和肿瘤大小中度正相关,α值与Ki-67指数和肿瘤大小中度负相关。同时,我们还发现MK和α值与NF、MVD之间也存在中度相关性。以上结果说明在HCC的生长早期,细胞增殖、血管生成以及区域性坏死是造成肿瘤异质性增大的主要因素[26]。但到第49天,肿瘤坏死面积逐渐增大(此时NF明显升高),大面积及较均匀分布的坏死一定程度上使肿瘤空间异质性降低,表现为MK值下降和α值上升。与本研究结果相仿,Shi等[27]对裸鼠胃癌模型的研究也同样发现在实验观察时间段内对照组肿瘤的MK值存在先上升后下降的趋势。同时,我们还发现5组肿瘤的MK和α值与反映肿瘤空间异质性的组织病理学指标SD和峰度值间高度相关。因此,MK和α能够反映HCC的肿瘤空间异质性,并可用于监测其随时间变化的情况。
MD和DDC是反映水分子扩散的指标,与传统DWI的ADC值存在相关性,能较ADC更准确地反映组织内水分子扩散情况[28]。随着肿瘤细胞增殖、血管生成、肿瘤增大和细胞外间隙减小,在某一时间点,肿瘤达到最密实的状态,此时MD和DDC值降低。之后随着肿瘤的生长,肿瘤体积增大,其血管生成已经无法满足细胞增殖和肿瘤生长的需要,瘤内坏死逐渐增多,使扩散系数MD和DDC值增大[12]。在去除第21天的A组后,我们观察到MD和DDC值与NF之间的相关性较未去除A组前更大,达到高度正相关,并且与肿瘤大小中度正相关。本研究未发现MD和DDC值与肿瘤异质性指标SD和峰度、Ki-67指数和MVD之间的相关性,其原因可能是在观察时间段内,MD和DDC并不是反映HCC的肿瘤异质性、细胞增殖和血管生成的敏感指标。
本实验存在一些局限性。首先,为了更好地将DKI和SEM各参数与组织病理学相对照,我们选择在肿瘤最大径层面上测定,因此对肿瘤整体异质性的反映有限[29],且病理切片与DKI和SEM图像可能不完全匹配。第二,尽管我们勾画ROI时避开了出血区域,但MRI上肉眼不能分辨的微出血的存在可能对结果产生一定影响。第三,每个时间点的瘤鼠只有5只,样本量较少,未来需要扩大样本量来进一步验证本研究结果。最后,本实验所研究的DKI和SEM参数可能仅反映了HCC肿瘤异质性的某些方面,最近一项基于血氧水平依赖和动态增强MRI的直方图分析也发现能够定量分析HCC肿瘤异质性,但技术更复杂、耗时更长[30]。
综上所述,DKI和SEM能够一定程度上反映HCC自然生长状态下随时间的延长而变化的肿瘤空间异质性,或可成为临床评价HCC肿瘤时空异质性的生物影像学指标。
doi:10.1002/jmri.26523.
