FZD5 在山羊妊娠早期的表达及激素调控
2019-06-18邢园园崔云凤
邢园园,张 云,崔云凤,任 杰,倪 华
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
胚胎着床是妊娠建立的关键环节,是影响繁殖效率的重要因素之一。尤其是体外操作的胚胎,着床率明显低于体内正常发育的胚胎[1],是胚胎工程技术的瓶颈之一。山羊是重要的经济动物,关于山羊胚胎着床的机制研究具有重要的理论和实践意义。已有研究表明,Wnt-FZD(Wingless/Int1-Frizzled)信号通路在多种动物的胚胎着床过程中具有重要功能,如调控子宫内膜层重建、子宫接受态的建立和胚胎黏附等过程[2]。FZD 蛋白家族共分为10 类(FZD1-10),结构均为7 次跨膜受体。当Wnt 配体与FZD 受体结合,可以启动经典Wnt 信号通路,调节细胞增殖、分化、黏附和运动等功能[3]。现已发现FZD5 参与多种癌症的发生,FZD5 基因沉默后可减少前列腺癌细胞PC3的迁移和增殖[4]。Peterson等[5]研究表明,FZD5 受体与SFRP2(Secreted frizzled-related protein 2)结合激活Wnt/Ca2+通路,导致细胞内Ca2+释放,激活钙调神经磷酸酶/NFATC3 通路诱导内皮细胞的血管生成。Lu 等[6]研究发现,FZD5 基因敲除的小鼠妊娠第10.5 天胎盘血管生成减少,胚胎死亡。但FZD5 在反刍动物山羊围着床期子宫中的表达与作用尚不清楚。本研究检测FZD5 基因在山羊围着床期子宫中的表达情况,为后续研究Wnt-FZD 信号系统在反刍动物胚胎着床机制提供实验基础,为改进胚胎移植、克隆动物等胚胎工程技术操作提供思路。
1 材料与方法
1.1 实验动物 本实验选择健康无疾病的未孕母羊27 只(黑龙江本地品种山羊)于黑龙江大庆银浪羊场统一饲养。山羊的发情周期一般为17~25 d,平均为21 d,发情持续1~3 d。采用公羊试情法鉴定母羊是否发情,选取稳定发情的用于后续实验。
1.2 实验动物模型
1.2.1 发情周期模型 采用公羊试情法判定山羊发情后,观察记录2 个发情周期。选取发情规律的山羊,在第3 次发情当天,记为发情第0 天(ED0)。山羊发情期ED0、ED6、ED12、ED16 宰杀后30 min 之内取出子宫,用PBS 清洗子宫表面存在的污物血迹,健康子宫组织,一部分液氮冻存,一部分固定石蜡包埋。每个时期取3只羊。
1.2.2 早期妊娠模型 选择发情规律的母山羊与公山羊配种,通过记录的交配日期和监控是否返情确定妊娠阶段。如果没有返情,则将最后1 次交配日期记录为妊娠第0 天(D0),根据日期确定妊娠所处阶段。分别于妊娠D0、D6、D16、D19、D25 处死动物,取子宫组织。将子宫体分成小块(每小块上有明显肉阜区)放于液氮中保存,每个时期取3 只羊。
1.2.3 类固醇激素处理模型 将健康母山羊的两侧卵巢切除,恢复2 个月康复后,分为 4 组进行皮下注射类固醇激素,每组 3 只。油处理组(对照):1 mL 芝麻油/只;雌激素处理组:50 μg/(mL·只);孕酮处理组:500 mg/(mL·只);雌激素和孕酮共同处理组:500 mg 孕酮+50 μg 雌激素/(mL·只)。饲养 24 h 之后处死,取材方法同上。
1.3 荧光定量PCR
1.3.1 总RNA 提取及cDNA 合成 按照TRIzol®Reagent试剂说明书提取山羊子宫中总RNA,Nano Drop 2000测RNA 浓度及纯度;将得到总RNA 进行消化后Nano Drop 2000 测RNA 浓度及纯度;按照PrimeScriptTM RT Reagent Kit 试剂盒说明书操作采用两步法合成第一链cDNA 并于-20℃冰箱保存。
1.3.2 引物设计合成 按照Real-time PCR 引物原则,根据NCBI 提供的基因序列,用Premier 5 引物设计软件设计山羊FZD5 及内参GAPDH 引物序列。

表1 引物序列
1.3.3 荧光定量PCR 使用SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)对妊娠D6(孕体黏附起始)、D16(孕体黏附与延长)、D19(黏附稳固)的山羊子宫基因的表达情况进行荧光定量PCR。用ABI 7500 实时荧光定量PCR 仪检测。反应体系为25 μL:上下游引物(10 mol/L)各1 μL,SYBR®Premix Ex Taq(2×)12.5 μL,ROX 0.5 μL,cDNA 1 μL,Nuclease-free H2O 9 μL。反应条件:95℃预变性30 s,95℃ 5 s,60℃ 34 s(采集信号),40 个循环。每个cDNA 样品设置3 个重复。由计算机根据扩增曲线自动分析得出Ct 值,以18S 为内参。以公式2-ΔCt计算基因的相对表达水平。利用GraphPad Prism 5 软件统计组间差异并做图。
1.4 Western blot 收集子宫组织,加入冰预冷的蛋白裂解液,用匀浆器匀浆,冰上孵育30 min 后离心取上清液进行蛋白定量。50 μg 蛋白沸水中煮5 min,上样,SDS-PAGE 电泳,电转移至聚偏二氟乙烯膜(PVDF)。转移后用5%脱脂奶粉室温封闭1 h。之后与Frizzled-5兔源抗体(1∶500,bs-2930R,Bioss)4℃孵育过夜。PBST 液漂洗,再加入Mouse Anti-rabbit IgG/HRP(1∶2 000,bs-0295M,Bioss)37℃孵育1 h。PBST 洗3 次后,ECL试剂盒显影。
1.5 免疫组化 子宫组织经中性福尔马林固定液固定,然后脱水和包埋,制成石蜡切片(5 μm),二甲苯脱蜡,梯度酒精脱水后,抗原修复,加3%H2O2室温孵育以消除内源性过氧化物酶活性,PBS 洗涤后加封闭液(10%马血清)37℃封闭1 h,滴加Frizzled-5 兔源抗体(1∶50),4℃孵育过夜,PBS 洗涤后滴加Mouse Anti-rabbit IgG/HRP(1∶100)于37℃孵育1 h,PBS 洗涤后加DAB 显色、终止、苏木精复染、脱水、透明、封片、镜检照相。
1.6 统计分析 根据荧光定量所得到的Ct 值,采用2-ΔCt方法进行结果处理。Western blot 结果使用Image Pro Plus 6.0 图像分析软件扫描测定,重复3 次,其中FZD5 灰度值为FZD5 IOD 值与GAPDH IOD 值的比值。免疫组织化学切片用生物显微镜观察并拍照。数据采用SPSS1 9.0 软件进行单因素方差分析和显著性检验,结果用平均值± 标准误表示。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结 果
2.1 FZD5 mRNA 在妊娠山羊围着床期子宫中的表达图1 显示,FZD5 mRNA 在妊娠D6 时表达最高,随着黏附进行,D16、D19 显著低于D6 且表达规律呈下降趋势。
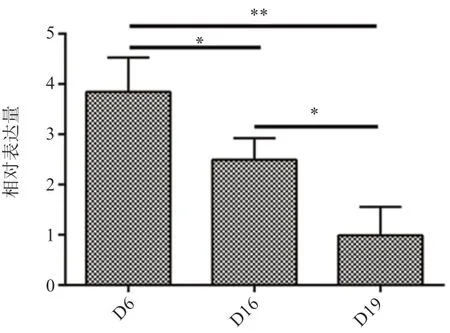
图1 FZD5 mRNA 在围着床期子宫中的表达
2.2 FZD5 蛋白在山羊子宫中的表达
2.2.1 FZD5 蛋白在山羊早期妊娠子宫中的表达 免疫组化结果(图2)显示,在山羊妊娠D6,FZD5 蛋白表达于子宫腔上皮、腺上皮中;在妊娠D16,FZD5 蛋白在子宫腔上皮和腺上皮中同样检测到信号且表达低于D6;在妊娠D19,FZD5 蛋白表达较低。

图2 围着床期山羊子宫组织中FZD5 蛋白的免疫组织化学染色结果(200×)

图3 FZD5 蛋白的Western blot 检测结果
Western blot 结果显示(图3-A),山羊妊娠(D6、D16、D19 和D25)子宫中均检测到FZD5 蛋白表达。在妊娠D6、D16 时FZD5 表达均高于D19 和D25(P<0.05),D6、D16 之间差异不显著,D19 和D25 之间差异不显著。表明FZD5 在妊娠早期(D6、D16)表达高于胚胎黏附完成(D19)和胎盘发生的早期(D25),推测FZD5 蛋白参与山羊孕体着床过程。
2.2.2 FZD5 蛋白在山羊发情周期子宫中的表达 如图3-B所示,在山羊发情周期(ED0、ED6、ED12 和ED16)的子宫中均有FZD5 蛋白表达,但表达无显著差异。
2.3 FZD5 蛋白在类固醇激素处理子宫中的表达 如图3-C 所示,与Oil 处理组相比较,孕酮处理组FZD5 蛋白表达降低极显著(P<0.01);雌激素处理组FZD5蛋白表达下降但并不显著;雌激素和孕酮共同处理组FZD5 蛋白表达显著降低(P<0.05)。这一结果表明,孕酮抑制FZD5 蛋白的表达,雌激素对抑制FZD5 蛋白的表达不显著。
3 讨 论
胚胎着床的方式分为侵入型和非侵入型着床,山羊属于非侵入式着床,与小鼠相比,山羊子宫内膜不进行蜕膜化且孕体与子宫腔上皮黏附,同时还伴随着孕体在子宫腔内的延长,使山羊整个黏附过程持续时间较长,所以山羊是研究胚胎黏附的良好模型。在山羊早期妊娠中,第6 天囊胚进入子宫腔并从透明带中孵出,随后孕体在子宫腔内开始延长;妊娠第14 天时,孕体开始分泌妊娠识别信号干扰素-tau(interferon-tau,IFNT),IFNT 能够阻碍黄体溶解,继续产生孕酮[7-8]。在孕酮作用下孕体延长并与子宫肉阜的上皮细胞粘附;妊娠第16~17 天,胚胎粘附广泛发生,IFNT 分泌达到峰值,在第20 天分泌水平降低;第19 天孕体与子宫肉阜处子宫内膜建立稳固黏附;随着妊娠进行,在孕体和子宫肉阜粘附处,组织增生血管发生,逐渐形成子叶状胎盘[9]。
在胚胎着床过程中,Wnt 信号转导通过直接开启和关闭大量的基因,如C-MYC、CYCLIN-D1、HOX A-10/11、环氧合酶-2(COX-2)基因等,以及与其他信号通路共同作用调节胚胎着床过程和胚胎发育[10]。Sonderegger 等[11]研究发现,重组配体Wnt3a 处理人滋养层细胞可激活Wnt/β-catenin 信号通路,引起基质金属蛋白酶2(MMP2)分泌,有助于促进滋养细胞在子宫内膜的迁移和侵袭;Carmon 等[12]研究显示,在人子宫内膜癌细胞中,高水平FZD5 与Wnt7a 结合显示激活β-catenin 经典Wnt 信号并增加上皮细胞增殖。有研究表明,FZD5 是分泌的卷曲相关蛋白(Secreted Frizzled-related Proteins,SFRPs)的受体,并通过内皮细胞中的钙调神经磷酸酶/ NFATc3 途径介导SFRP2诱导的血管生成[13]。本研究结果显示,山羊孕体黏附之前,FZD5 表达较高,提示FZD5 可能参与子宫腔上皮的增殖。胚胎伸展黏附期结束后,在妊娠第25 天,FZD5 表达上升,可能参与后续的血管发生胎盘形成过程。已有研究表明,在小鼠中胚胎着床“窗口”期子宫内膜β-catenin 蛋白表达暂时性下调或缺失,有利于促进子宫内膜上皮细胞分化来同步植入前胚胎的发育[14]。本实验结果证明在山羊胚胎黏附期,Wnt 受体FZD5 的表达也下调,FZD5 可能参与孕体与山羊子宫腔上皮的黏附过程。
孕酮能够激活和维持子宫内膜功能,是孕体生长、植入、胎盘形成以及后期发育所必需。反刍动物妊娠早期孕体分泌IFNT 阻碍黄体退化,使母体处于较高的孕酮水平。肉牛、奶牛和绵羊排卵后高浓度孕酮水平能够增加孕体长度;在牛的妊娠周期子宫中孕酮诱导子宫内环境改变,支持囊胚生长成卵形状和延伸成纤维状孕体[15-16]。孕酮通过影响子宫内膜作用于胚胎生长和孕体延长,孕酮诱导子宫上皮细胞分泌增殖因子(GRP)、葡萄糖转运蛋白(SLC5A11)、分泌型黏附蛋白(SPP1),钙/磷酸盐稳态的候选调节剂(STC1)和免疫调节因子等。这些基因进一步受到胚胎来源的IFNT 和皮质醇的刺激,导致妊娠期子宫腔液成分改变,进而影响滋养层细胞增殖和迁移,调节胎体伸长[17-18]。本实验中,孕酮处理导致山羊子宫中FZD5 蛋白表达极显著降低,孕酮可以通过调控FZD5 影响Wnt 信号通路影响妊娠的相关分子事件。
4 结 论
FZD5 蛋白定位于山羊子宫腔上皮和腺上皮中;在山羊妊娠早期过程中,胚胎黏附之前FZD5 mRNA 和蛋白表达水平较高,黏附期表达水平逐渐下降。在山羊发情周期中FZD5 蛋白表达无明显差异;孕酮下调山羊子宫中FZD5 蛋白表达。FZD5 在山羊早期妊娠子宫中的表达具有胚胎着床特异性,胚胎黏附期FZD5 下调有利于山羊黏附过程,且FZD5 蛋白表达受孕酮影响下调。本研究为山羊着床机制提供研究实验依据,为提高反刍动物的繁殖力,为提高胚胎工程操作技术的效率提供研究思路。
