复合乳酸菌制剂的耐受性和抑菌性研究
2019-06-18邓露芳郭上铭孙林芳王光晴
辛 娜,郭 亮,邓露芳,郭上铭,孙林芳,张 勇,王光晴
(北京三元种业科技股份有限公司饲料分公司,北京101105)
抗生素在提高养殖效益、保证动物健康乃至促进畜牧养殖业发展方面发挥了非常重要的作用,但是由于长时间对抗生素过度依赖和滥用,其弊端日益显现,如破坏消化道微生物稳态、提高细菌病原体抗生素耐受性、降低机体免疫力等(Li等,2013;杨波,2007),探寻抗生素替代品已成为国内外研究的热点。益生菌因其具有无毒、无残留、无抗药性等特点在众多抗生素替代品中脱颖而出。乳酸菌作为使用最早、应用最广泛的益生菌之一,其能够调节肠道微生物区系的平衡,增强机体的抵抗力和免疫力,提高动物生产性能及饲料转化率(杨玲,2014)。近年来,大量学者从乳酸菌株的耐酸和胆盐及对胃肠道的耐受性、抗病原菌的活性、抗生素耐受性、安全性等方面进行体外评价(刘明珠,2013;Collado 等,2006)。
本试验将四株乳酸菌制成复合乳酸菌制剂,在实验室条件下研究其对温度 (水浴模拟制粒)、不同pH、胆盐、常用饲料抗生素的耐受性及对致病菌的抑制作用,以期为乳酸菌制剂在饲料及动物上的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 乳酸菌株H1、H4、H5、H6为北京绿荷康牧生物科技有限公司实验室筛选并保存。经生理生化反应及16sRNA结合鉴定为嗜酸乳杆菌、植物乳杆菌、长双歧杆菌、屎肠球菌。
1.1.2 试剂 磷酸盐缓冲液、禽胆盐、牛胆盐、猪胆盐。
1.1.3 抗生素 20%土霉素、15%金霉素、50%吉他霉素、10%杆菌肽锌、15%亚甲基水杨酸杆菌肽、20%莫能菌素、12%盐霉素、4%黄霉素,均为市售产品,由北京三元种业科技股份有限公司饲料分公司提供。
1.1.4 指示菌 大肠埃希氏菌(ATCC25922)、金黄色葡萄球菌 (ATCC25923)、鼠伤寒沙门氏菌(ATCC14028)购于广东环凯生物科技有限公司。
1.1.5 培养基 营养琼脂、营养肉汤、MRSbroth、MRS agar、M-H琼脂购自北京陆桥技术股份有限公司。
1.1.6 复合乳酸菌制剂 复合乳酸菌制剂由四株乳酸菌复合发酵复配而成,为北京绿荷康牧生物科技有限公司产品。
1.2 方法
1.2.1 耐温试验 参照张璐(2008)方法,100 g基础日粮装于试剂瓶中,封口。121℃灭菌30 min,冷却后按照0.1%的添加量将复合乳酸菌制剂与基础日粮混合均匀后,饲料水分控制在17%~18%。用水浴模拟制粒温度,取1 g于灭菌三角瓶中,分别置于 65、85 ℃水浴中作用 2.5、5、7.5 min,每个处理三个重复。水浴结束后立即置于冷水中进行冷却。进行梯度稀释,选择合适的稀释梯度,取1 mL样液至培养皿中。将冷却至45~55℃的MRS培养基倾注于每个平皿中,小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,37℃倒置培养2 d。计算存活率:
存活率/%=处理后活菌数/未处理活菌数×100。
1.2.2 耐酸试验 将磷酸盐缓冲液分装至250 mL的试剂瓶中,每瓶分装90 mL稀释液。用1 mol/L的 NaOH 和 HCl将稀释液的 pH 调至 2、3、4、5、6,空白对照组pH为6.8,将稀释液高压灭菌30 min。称取复合乳酸菌制剂10 g至各pH的试剂瓶中。37℃水浴处理30、60、90 min,每个处理三个重复。进行梯度稀释,选取合适的稀释倍数,取1 mL至培养皿中。及时将冷却至45~55℃的MRS培养基倾注于每个平皿中,小心旋转平皿,将培养基与样液充分混匀。待琼脂凝固后,37℃倒置培养2 d。计算存活率。
1.2.3 耐胆盐试验 取10 g复合乳酸菌制剂分别加入0、0.3%的胆盐(猪胆盐、禽胆盐、牛胆盐)溶液90 mL,混匀于37℃水浴中分别处理1、2、3 h,每个处理三个重复。进行梯度稀释,选取合适的稀释倍数,取1 mL至培养皿中。及时将冷却为45~55℃的MRS培养基倾注于每个平皿中,小心旋转平皿,将培养基与样液充分混匀。待琼脂凝固后,37℃倒置培养2 d。计算存活率。
1.2.4 耐抗生素试验 本实验室采用胡生梅等(2015)琼脂稀释法测定复合乳酸菌对药物饲料添加剂的最低抑菌浓度(MIC)。将药物饲料添加剂分别用相应溶剂溶解后,再用灭菌蒸馏水成比例稀释成所需浓度。将抗生素加入灭菌并冷却至50℃左右的M-H琼脂中,充分振荡,使抗生素与培养基混合均匀。(用培养基将抗生素稀释20倍)。将混有抗生素的培养基倾倒入培养皿中。培养皿标记抗生素种类及稀释后浓度。每一浓度做两个平皿,即平行样。待培养基凝固后,取活化培养18 h的复合乳酸菌制剂 (约0.5麦氏浓度)10 mL加入90 mL灭菌稀释液中,混匀,梯度为10-1。取稀释度10-1菌液100 μL置于平板上,进行平板涂抹。37℃,倒置培养。结果以完全抑制菌落生长的最低药物浓度为MIC。各抗生素配制浓度梯度见表1。

表1 不同抗生素的配制浓度
1.2.5 对致病菌的抑制试验 参照刘冬梅等(2006)牛津杯扩散法。取灭菌营养琼脂,待温度降至50℃左右时倒平板,每个平皿约15 mL。待琼脂凝固后,用灭菌的镊子夹牛津杯置于营养琼脂平板中。每个平板放置4个牛津杯。分别取大肠埃希氏菌、金黄色葡萄球菌、沙门氏菌0.1 mL(108cfu/mL)加入到已灭菌100 mL营养琼脂中(冷却至50℃左右),摇匀后倾倒,注意不要起泡。待琼脂凝固后,用镊子将牛津杯夹出来,将孔进行标记(牛津杯外径 8 mm),标记为 1、2、3、4。 孔 1 中加入灭菌MRS液体培养基100 μL作对照,取活化培养18 h的复合乳酸菌制剂稀释液100 μL,加入2、3、4孔中,3个重复。置于4℃冰箱放置1 h后,置于37℃培养24 h。用游标卡尺量抑菌圈大小。
2 结果与分析
2.1 不同温度对复合乳酸菌制剂的影响 从表2可见,随着处理温度及处理时间的增加,乳酸菌数呈下降趋势。 65℃处理 2.5、5、7.5 min,85 ℃处理2.5 min存活率均在96%以上。85℃处理复合乳酸菌制剂5、7.5 min,存活率下降至47.92%、29.84%。
2.2 不同pH对复合乳酸菌制剂的影响 从表3可以看出,在 pH为2时活菌数受到影响较为严重,处理90 min存活率为59.46%。随着pH的增加,复合乳酸菌的存活率呈增加趋势。处理90 min,pH为3时存活率高达80.54%,pH为4、5、6时存活率均在 90%以上。且在 pH为 3、4时,处理90 min的存活率较处理60 min均略有提高。总体来说,复合乳酸菌制剂在弱酸性环境下,存活率较高。

表2 复合乳酸菌制剂对不同温度处理的存活率%%%%

表3 复合乳酸菌制剂对不同pH处理的存活率%
2.3 复合乳酸菌制剂对0.3%胆盐耐受性试验从表4可以看出,随着胆盐处理时间的延长,复合乳酸菌制剂存活率明显下降。复合乳酸菌制剂对0.3%猪胆盐的耐受性较好,对0.3%牛胆盐耐受性较差,对0.3%禽胆盐耐受性最差。0.3%猪胆盐处理1 h,存活率为73.52%,处理2 h,存活率为60.63%。复合乳酸菌制剂可以更好耐受0.3%猪胆盐,可以作为猪的饲料添加剂。
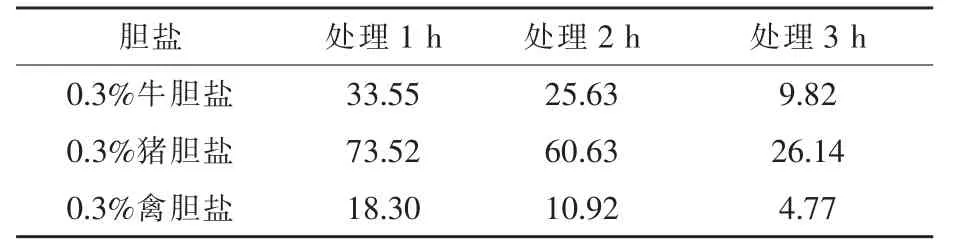
表4 复合乳酸菌制剂对0.3%胆盐(不同种类)的存活率%
2.4 复合乳酸菌制剂耐抗生素试验 从表5可知,复合乳酸菌制剂对8种药物饲料添加剂有不同程度的耐受性,其中对杆菌肽锌、亚甲基水杨酸杆菌肽的耐受性最强,最小抑菌浓度(MIC)大于1280 mg/kg。其次是黄霉素,以下依次是土霉素钙、莫能菌素、盐霉素、金霉素。复合乳酸菌制剂对这些抗生素的耐受浓度均超过国家规定添加剂量,在添加这些药物饲料添加剂的饲料中,可以使用复合乳酸菌制剂。其对吉他霉素的耐受性最差,低于国家规定配合饲料的最大添加量。因此,在添加吉他霉素的配合饲料中,使用复合乳酸菌制剂可能没有效果。
2.5 复合乳酸菌制剂对致病菌的抑制作用试验从表6可知,复合乳酸菌制剂对大肠埃希氏菌有抑制作用,抑制圈直径为10.2 mm,对金黄色葡萄球菌、鼠伤寒沙门氏菌没有抑菌作用。
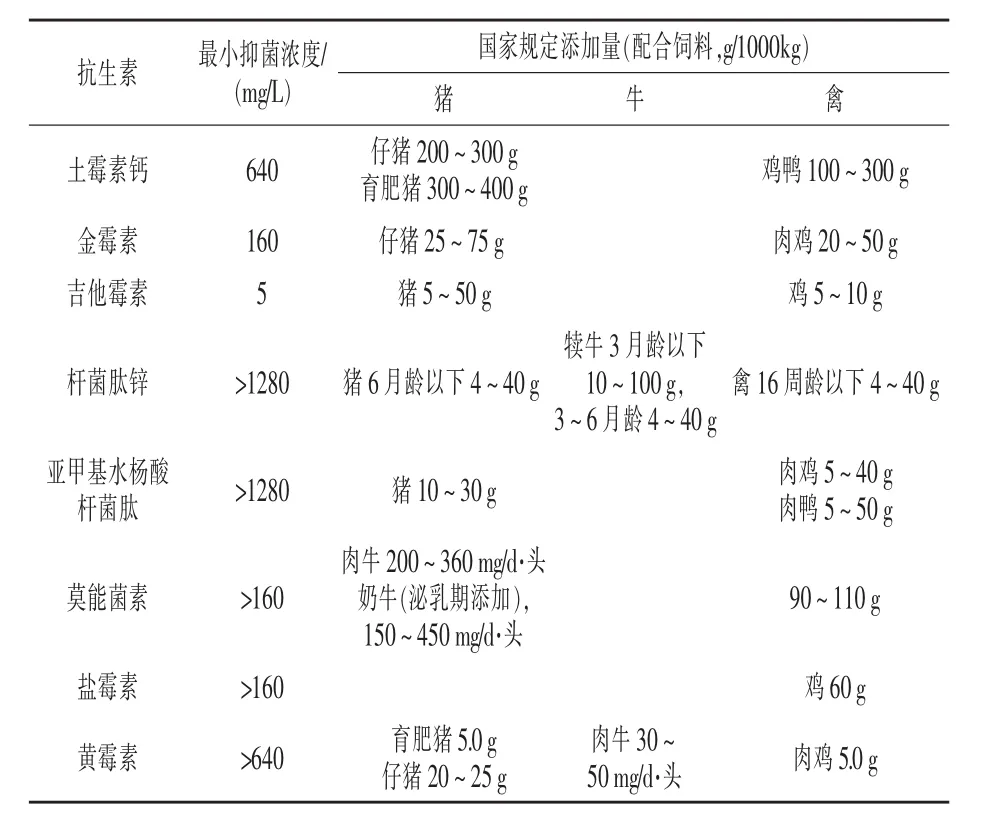
表5 复合乳酸菌制剂对抗生素的耐受性

表6 复合乳酸菌制剂对致病菌的抑制作用
3 讨论
饲用乳酸菌发挥益生作用,首先要有一定的活菌数,在进入动物胃肠道时,能够耐受胃肠道环境,抑制病原菌的生长。同时,在饲料加工过程中,能够耐受高温制粒、耐受饲料药物添加剂 (李舒宁,2014;龚慧,2014)。
3.1 复合乳酸菌制剂对温度的耐受性 益生菌在饲料制粒和膨化过程中,都会经过高温高压处理。颗粒饲料蒸汽调质时间一般为30 s~2 min,温度一般为60~80℃(韩庆功等,2018;单春乔,2017),所以,乳酸菌的耐温考察非常有必要。不同微生物对热有不同的耐受能力,这与菌龄、菌种、基质pH等有关。一般革兰氏阳性菌大于阴性菌,嗜热菌大于嗜温菌和嗜冷菌,菌体细胞处于稳定期大于对数期,基质pH为7左右,菌抗热能力最强。乳杆菌属、微球菌属、肠球菌属、链球菌属的部分菌株都有一定的耐热能力(张宜凤,2008)。刘超齐等(2016)报道,干酪乳杆菌不耐受50℃及超过50℃高温,乳酸链球菌能耐受60℃,其存活率为96%。韩庆功等(2018)试验表明,植物乳杆菌在温度70℃条件下处理2 min,存活率可以达到88.9%,但当温度升高到80℃时处理2 min,存活率则下降至34.95%。本试验65℃处理2.5、5 min及7.5 min,85℃处理2.5 min存活率均在96%以上,对存活率几乎没有影响。85℃处理复合乳酸菌制剂 5、7.5 min,存活率下降至 47.92%、29.84%,复合乳酸菌制剂能较好的耐受高温主要与固体饲料导热性差,乳杆菌属、肠球菌属具有一定的耐热能力及配方中有保护剂有关。
3.2 复合乳酸菌制剂对pH、胆盐的耐受性 仔猪出生时胃内pH为5~6,数小时后pH降至4左右,2月龄前胃内pH保持在3左右,食物在胃内的消化时间相对较短,一般为1~2 h(吴慧芬等,2005;凌代文,1993)。研究表明,不同乳酸菌菌株对不同pH的耐受性不同。顾瑞霞等(1996)报道嗜酸乳杆菌在37℃,20 min后,活菌数迅速下降,婴儿双歧杆菌在pH为2时,37℃处理1 h,活菌数基本不变。单春乔等(2017)研究表明,饲用屎肠球菌M74在pH为3的条件下,保持3 h后,存活率为11.57%。王彦萍等(2016)研究饲用乳酸菌NCU156在pH为2.5的MRS培养基中,作用4 h存活率为 87.31%。本试验在 pH为2时活菌数受到影响较为严重,但随着pH的增加,复合乳酸菌的存活率呈增加趋势,主要是因为pH过低时,乳酸菌细胞膜结构遭到破坏,通透性、渗透压等增加,最终导致细胞破裂。在pH为3、4时,处理90 min的存活率均较处理60 min略有提高,说明其能通过自身的应急反应来抵抗胁迫所造成的危害。总体来说,复合乳酸菌制剂在酸性环境下,存活率较高。
猪消化道中的胆盐含量为0.03%~0.3%。十二指肠中的胆汁酸盐对外源细菌具有抑制作用,细菌在肠道的存活和增殖,必须能够耐受0.3%胆盐的环境(Wasson 等,2000;Hyronimus等,2000),通常0.3%胆盐浓度被认为是筛选抗性菌 (益生菌)的标准(Gilliland 等,1984)。 研究表明,乳酸菌能够耐受一定浓度的胆盐,对致病菌有不同程度的抑制作用(董晓丽等,2012)。本试验采用0.3%作为菌株耐胆盐性能测定的浓度,0.3%猪胆盐处理1 h存活率为73.52%,2 h存活率为60.63%,表明复合乳酸菌制剂能够很好的耐受0.3%猪胆盐。
3.3 复合乳酸菌制剂对抗生素及致病菌的抑制作用 益生菌制剂要想部分替代抗生素必须要考虑抗生素和益生菌是否存在协同作用,即益生菌对抗生素的耐受性。不同菌株对不同抗生素的耐受性也不尽相同。刘明珠(2013)研究表明,乳酸粪肠球菌对阿散酸、杆菌肽锌、金霉素、喹乙醇、硫酸黏杆菌等5种药物有较强的耐受作用,对吉他霉素、盐霉素的耐受性相对较差。孙笑非(2009)研究得出,芽孢杆菌对吉他霉素、喹乙醇、金霉素、黄霉素、杆菌肽锌、盐霉素、阿散酸、维吉尼亚霉素、硫酸黏杆菌素的耐受性均超过国家规定添加剂量。本研究中,除吉他霉素外,复合乳酸菌制剂对其他几种抗生素的耐受浓度均超过国家规定添加剂量。在实际应用中,在含有上述7种抗生素 (除吉他霉素)的饲料中添加复合乳酸菌制剂,不会影响乳酸菌数。若吉他霉素与乳酸菌制剂配合应用,可通过增加益生菌用量或者减少抗生素用量来实现。同时,其对大肠埃希氏菌有抑制作用。乳酸菌制剂抑制有害菌主要是因为乳酸菌及其代谢产物中富含乙酸、乳酸等有机酸,以及细菌素和过氧化氢等各种抑菌成分(Zhang等,2007)。 罗睿(2011)试验表明,极端的酸性环境能够在一定程度上抑制病原微生物的生长,但酸度不是抑菌的唯一因素,其与代谢产物协同作用才能真正达到抑菌效果。
4 结论
本试验结果表明,复合乳酸菌制剂对0.3%猪胆盐、酸性环境、高温具有很好的耐受性,对病原菌大肠埃希氏菌有抑制作用,能够耐受除吉他霉素外的其他7种抗生素。因此,可进一步研究其作为微生物添加剂对动物生长性能的影响。
