适用于制备对虾发酵饲料的益生芽孢杆菌复配组合的筛选和评价
2019-06-18王竞儒余政豪乔秀亭程镇燕王庆奎孙金辉白东清
王竞儒, 王 洋*, 余政豪, 乔秀亭, 程镇燕,崔 培, 王庆奎, 孙金辉,曹 鹏,白东清
(1.天津农学院水产系,天津西青 300384;2.天津市宝坻区渔翁水产科技发展有限公司,天津宝坻 301800)
益生菌是指一类可以直接饲喂动物的有益活体或死的微生物。在水产动物养殖过程中,益生菌可作为水产动物饲料添加剂,或用于制备发酵饲料。目前,在水产养殖中应用较广的水产益生菌主要包括芽孢杆菌属 (Bacillus)、酵母菌(Saccharomyces)和光合细菌(Photorophic bacterium)。 益生菌在对虾养殖中的应用非常广泛 (朱金星等,2017),最主要的应用方式为直接添加到饲料中(Azadis等,2005)。然而,虾类的消化道较短,饲料在体内停留时间约2 h(李健等,1993)。因此,如果采用拌料投喂的方式添加益生菌,无法充分发挥其降解饲料大分子物质,提高消化吸收率的作用。研究表明,直接投喂芽孢杆菌仅能使斑节对虾的饲料干物质、蛋白质、脂肪水解率增加不到2%(於叶兵等,2007)。相比之下,复合益生菌发酵后的饲料中大分子物质转化成小分子,如氨基酸等,可提升饲料的可消化性(胡红伟等,2017)。同时益生菌发酵可以降低饲料原料中的抗营养因子,提高对虾肠道消化酶活性,还能产生抑菌物质,提高水产动物抗病性(吴东,2015)。
研究证明,多株益生菌混合发酵效果优于单一菌株(陈树河等,2016)。因此本研究拟筛选适用于制备对虾发酵饲料的益生芽孢杆菌复配组合,并对组合菌株的产酶活性进行评价,以初步优化发酵对虾饲料的条件。
1 材料与方法
1.1 试验菌株 益生芽孢杆菌菌株7株,保存于天津农学院水产学院,使用前以LB液体培养基活化至活菌数 1×109~ 3×109cfu/mL。
1.2 试验试剂 磷酸氢二钠、磷酸二氢钠、氢氧化钠、三氯乙酸、无水碳酸钠、L-酪氨酸、盐酸、三水乙酸钠、冰乙酸、羧甲基纤维素钠、3,5-二硝基水杨酸、四水酒石酸钾钠、苯酚、无水亚硫酸钠、无水葡萄糖、柠檬酸、蒸馏水、柠檬酸钠、麦芽糖、酒石酸钾钠、干酪素等,均为国产分析纯。
1.3 主要试验仪器 W-CJ-2FO洁净工作台:苏净集团苏州安泰空气技术有限公司;DK-98-11A电热恒温水浴锅:天津市泰斯特仪器有限公司;SMLS-3780高压蒸汽灭菌锅:日本Sanyo公司;FA2104电子天平:上海舜宇恒平科学仪器有限公司;UV-5500紫外可见分光光度计:上海元析仪器有限公司;SHP-250型微生物生化培养箱:上海三发科学仪器有限公司;YZB-GER 1841-2014高速冷冻离心机:奥默飞世尔科技(中国)有限公司。
1.4 LB培养基 按照张士伟等(2013)的方法制备LB种子培养基(固体培养基需加入细菌琼脂粉1.5% ~2.0%),pH 7.0,121℃灭菌20 min后使用。
1.5 益生芽孢杆菌复配组合的筛选 根据表1,各菌株按照OD600值1∶1∶1比例组合,接种于LB培养基,37℃培养12 h后测定上清液酶活性。
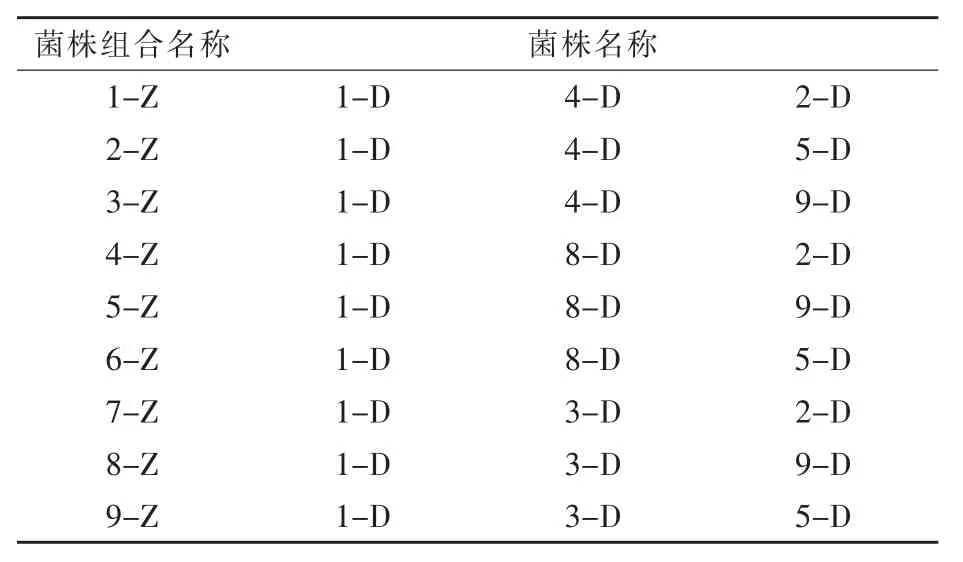
表1 菌株组合情况表
蛋白酶活性的定量测定采用福林酚法 (中国国家标准委员会,2009),淀粉酶活性的定量测定采用3,5-二硝基水杨酸法 (张龙翔等,1982),纤维素酶活性的定量测定采用DNS法 (杨海峰等,2014)。使用SPSS 16.0软件进行单因素方差分析(One-way ANOVA)。以三种酶活性的综合响应值作为评价指标,选取最优组合。计算公式为:
响应值=蛋白酶活性×50%+(淀粉酶活性+纤维素酶活性)×25%。
1.6 优良芽孢杆菌复配组合发酵饲料 采用单因素优化法,使用自封袋模拟发酵容器,分别控制加水量(0.8、1.0、1.3、1.5 mL/g 饲料)、接种量(0.1%、0.5%、1%、5%),置于 37℃恒温箱发酵 24 h,对比饲料颗粒黏合状态,以确定发酵饲料的最适注水量;采用平板法进行活菌计数,以确定最适接种量;在最佳注水量和接种量条件下,分别发酵对虾开口饵料(南美白对虾配合饲料-开口料,唐山三发普林饲料有限公司)和对虾成虾饲料(通威南美白对虾配合饲料-成虾料,通威股份有限公司),发酵24 h后进行活菌计数,以确定适用的饲料种类;选用适宜饲料种类,向自封袋内注入无菌空气(10、20、30、40、50 mL/g 饲料)、适宜水量和接种量,发酵24 h后进行活菌计数以确定最适通气量。
2 结果与分析
2.1 组合菌酶活性定量测定和响应值结果 表2可知,在所测的9组芽孢杆菌组合菌中,组合8-Z所产蛋白酶活性明显高于其他组合,达到(28.58±0.34)U/mL。复配菌株应用于对虾饲料或者制备发酵饲料过程中,产生的消化酶可以与水产动物内源酶相互补充,从而提高消化率(阳艳林等,2017;仉明军等,2013)。许多研究发现,为水产动物补充外源性消化酶,能够提高水产动物的饲料利用率。张娟娟等(2012)试验证明,在虹鳟鱼的低鱼粉饲料中添加蛋白酶,可提高其胃肠蛋白酶活性,进而改善生长性能。与其他报道相比,本研究中所测得的各菌株蛋白酶活性并不高,这可能与培养时间短(陈营等,2004)以及培养基成分的差异有关。因此,本试验各菌株在LB培养基中仅培养12 h后测得的酶活性,并不能完全代表菌株在发酵饲料或者宿主肠道内的产酶能力。
组合3-Z所产的淀粉酶活性较其他复配组合高,达到(5.8±0.34)U/mL。 其淀粉酶活性显著高于其他报道,如经紫外诱变育种得到的高产淀粉酶菌株,淀粉酶活性只达到2.264 U/mL(马颖辉等,2011);游龙等(2018)测定的野生型芽孢杆菌,胞外淀粉酶活性最高为3.0 U/mL。表明本试验所筛选的芽孢杆菌产淀粉酶活性较高,更具研究和实际应用价值。有试验证明,芽孢杆菌的淀粉酶活性会随温度变化而发生改变,在0~40℃其淀粉酶活性随温度升高而上升,之后随温度升高而下降(高永生等,2011)。
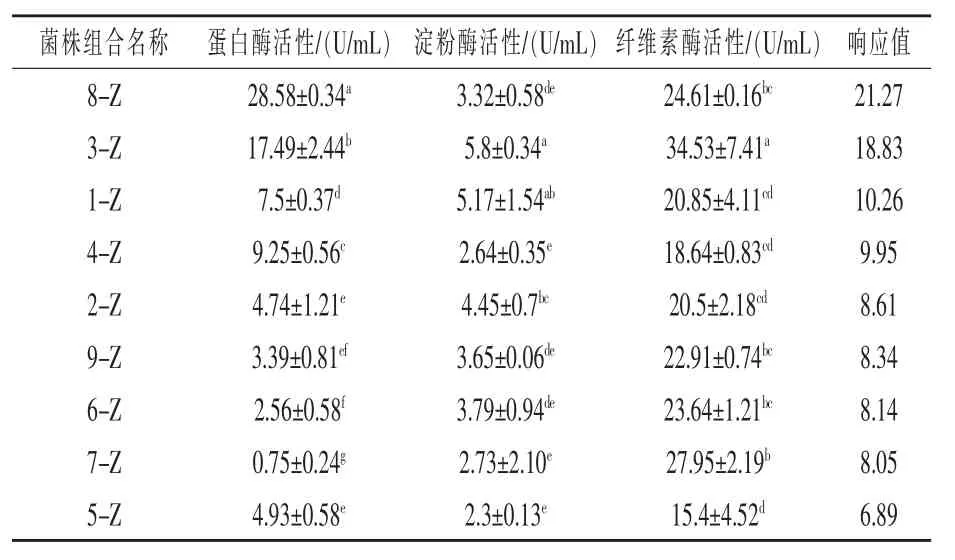
表2 组合菌株蛋白酶、淀粉酶和纤维素酶酶活性定量和响应值结果
菌株组合3-Z所产纤维素酶活性最高,达到(34.53±7.41)U/mL。 此结果高于屈二军等(2008)经过紫外诱变得到的高酶活枯草芽孢杆菌以及江国忠 (2010)所筛选的野生型高酶活枯草芽孢杆菌。在饲料中添加纤维素酶,可改善养殖动物对粗纤维的利用率(张新武等,2002)。纤维素酶可以刺激内源酶分泌,还可以与其他内源酶共同作用,从而促进动物的消化和吸收(王仁华等,2011)。
2.2 优选芽孢杆菌形态 7株菌均为革兰氏阳性杆菌,大小和长短有菌株特异性,无特殊排列方式。
2.3 16S rDNA测序结果 测定上述优选菌株的16S rDNA序列,通过与数据库其他菌株的序列信息进行比对,得出鉴定结论:菌株8-D、4-D、9-D、3-D、7-D、5-D均为枯草芽孢杆菌;菌株2-D为地衣芽孢杆菌;菌株6-D为地衣形芽孢杆菌;菌株1-D为解淀粉芽孢杆菌。使用MEGA3.1软件构建系统发育树,图1为菌株2-D的系统发育树。
2.4 饲料发酵条件优化
2.4.1 不同加水量发酵饲料形态观察 通过观察,加入0.8 mL蒸馏水的饲料(1 g)经过24 h发酵后,饲料颗粒呈现较干燥状态,故不能充分发酵;而加水量1.3 mL和1.5 mL的两组则呈现较为潮湿、易碎状态,会影响发酵后配合饲料在水中的稳定性;加水量1.0 mL的饲料发酵24 h后呈现较为理想的状态。

图1 菌株2-D系统发育树
2.4.2 不同接种量发酵饲料的活菌数 由表3可知,接种芽孢杆菌组合8-Z的接种量为5%的饲料(成虾饲料和开口料)在发酵24 h后,所得的活菌数最高,其中成虾饲料活菌数为9.47×108cfu/g,开口料活菌数为4.33×108cfu/g。其次为接种量0.50%的饲料(成虾饲料和开口料),其中成虾饲料的活菌计数结果为4.23×108cfu/g,开口料的活菌计数结果为3.67×108cfu/g。出于对饲料成本和活菌数的综合考虑,选择接种量为0.50%作为芽孢杆菌组合菌8-Z的最适接种量。

表3 不同接种量发酵24 h后虾开口饵料和成虾饲料活菌数cfu/g
2.4.3 不同通气量发酵饲料的活菌数 如表4所示,通入空气量为20 mL的饲料发酵后活菌数最高,为 6.48×108cfu/g。
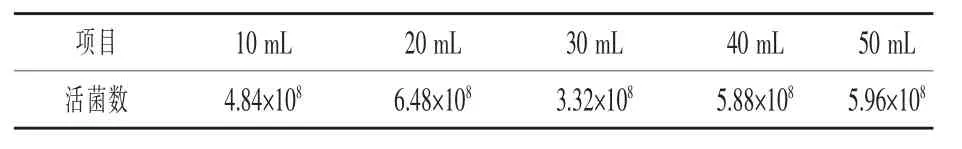
表4 不同通气量发酵24 h后成虾饲料的活菌数cfu/g
3 结论
适用于制备对虾发酵饲料的益生芽孢杆菌组合为8-Z(包含解淀粉芽孢杆菌1-D,枯草芽孢杆菌3-D和枯草芽孢杆菌9-D)。制备对虾发酵饲料的适宜参数为:加水量1 mL/g,接种量0.50%(0.5×107~ 1.5×107cfu/g),充气量 20 mL/g,发酵24 h成虾饲料的活菌数为6.48×108cfu/g。
