一株烟草青枯拮抗细菌的筛选、鉴定和培养特性研究
2019-06-18甘炳成谢丽源黄忠乾彭卫红
吴 翔,甘炳成,谢丽源,谭 昊,黄忠乾,彭卫红,唐 杰
(四川省农业科学院土壤肥料研究所,农业农村部西南区域农业微生物资源利用科学观测实验站,农业农村部西南山地农业环境重点实验室,四川 成都 610066)
青枯病是由青枯劳尔氏菌(Ralstonias olanacearum)引起的细菌性枯萎病,该病原菌可以侵染50多个科近200多种植物[1],是一种在世界范围内危害大、分布广、造成损失极其严重的植物病害之一。如今,青枯病的侵染影响范围越来越广,其感染的植物种属也在不断增加。就农业栽培作物而言,茄科类作物受R.solanacearum的影响最为严重,其中以烟草、番茄、辣椒等作物更为突出。烟草青枯病于1908年被Smith[2]发现,它是一种土传病害,目前烟草青枯病在我国大部分烟草种植区大面积发病,造成的损失已居烟草病害的第4位[3],引起广大科学工作者的重视。目前有化学防治、选育抗病烟草品种、改善耕作制度管理、生物防治等方法应用于烟草青枯病的防治,与常用的化学防治方法相比,生物防治方法具有成本低、无二次污染和效果持久等优点,而相对于选育抗病烟草品种和耕作制度管理两种方法,生物防治方法分别具有研发周期相对短以及节约劳力等优点,因此生物防治是目前烟草青枯病防治中最热门的研究方向,而筛选更多效果好、易培养的拮抗菌是烟草青枯病生物防治的基础工作,具有重要意义。本研究从高粱根际土中分离获得的一株细菌MT-002-B-7对烟草青枯病原菌具有良好的拮抗效果,对该菌进行了鉴定,并对其拮抗菌液的发酵条件进行了研究,以期为该菌用于烟草青枯病防治的生物有机肥研制提供基础数据。
1 材料与方法
1.1 材料
烟草青枯病病原菌:由云南省烟草科学研究院惠赠。
TM培养基:蛋白胨10.0 g,葡萄糖5.0 g,酪素水解物(Trypticase)1.0 g,琼脂粉18.0 g,蒸馏水1 000 mL;
NA 培 养 基: 牛 肉 浸 膏 3.0 g, 蛋 白 胨 5.0 g,葡 萄 糖 20.0 g, 琼 脂 20.0 g, 蒸 馏 水 1 000 mL,pH值6.8~7.2;
LB液体培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,蒸馏水 1 000 mL,pH 值 7.4;
牛肉膏蛋白胨培养基:牛肉浸膏3.0 g,蛋白胨5.0 g,NaCl 5.0 g,琼脂 20.0 g,蒸馏水 1 000 mL,pH值6.8~7.2;
碳氮源筛选基础培养基∶氮源10.0 g(蛋白胨5.0 g,硫酸铵5.0 g),碳源(葡萄糖)10.0 g,Na2HPO4·12H2O 4.0 g,NaH2PO4·2H2O 2.0 g,MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.2 g,蒸馏水 1 000 mL,pH值7.0~7.5。
生理生化指标检测试剂和培养基参照赵斌等[4]的《微生物学实验》。
1.2 方法
1.2.1 拮抗菌的初筛
初筛采用喷雾法和双层平板法[4-6],将病原菌接种于液体TM培养基,30℃、170 r/min振荡培养36 h,离心收集菌体并用无菌水重悬,放置于经70%酒精和10%双氧水消毒的无菌喷瓶里,然后均匀地喷洒在TM平板上,每皿喷雾约0.2 mL,制成含菌平板。晾干后再倒上一层薄薄的NA培养基,制成双层平板。将纯培养微生物点接于上层培养基,30℃倒置培养,通过观察菌株是否产生拮抗透明圈判断该菌是否具有拮抗烟草青枯病原菌的能力。
1.2.2 拮抗菌的复筛
在直径9 cm培养皿中准确倒入20 mL TM培养基,用与初筛相同方法制成含病原菌的平板,在离平板中心距离相等的3个方向分别用6 mm无菌打孔器打孔备用。将初筛所得菌株于液体牛肉膏蛋白胨培养基中30℃、170 r/min振荡培养24 h,每孔中注入30 μ L发酵液,于30℃正置培养36 h后,记录孔周围的抑菌圈直径,抑菌圈直径大小代表各菌株对病原菌抑制能力的大小。
1.2.3 盆栽试验验证拮抗菌对烟草青枯病的抑制效果
处理设置:CK:不施菌液;菌液:MT-002-B-7发酵液。各处理5个重复。病原菌及供试处理菌液的施用方法:两个处理的青枯病原菌的接入方法采用茎基部穿刺接种法,每个植株注入1 mL病原菌菌悬液。将菌株MT-002-B-7在LB培养液中发酵,28℃、180 r/min发酵培养24~ 56 h,获得浓度为108cfu/mL的菌液。施用时采取灌根的方法,吸取5 mL原液,将其用水稀释至100 mL,每个处理5个重复。分别在移栽当天、移栽第25 d、40 d各施用1次,盆栽试验共进行65 d。病情调查方法参考烟草病虫害分级及调查方法进行[7]。
1.2.4 菌株拮抗条件优化
1.2.4.1 培养基础条件 菌株特性研究以LB培养液为基础培养液,特性研究和碳氮源筛选的基础培养条件:接种量为1%、装液量40%、初始pH值7.0、温度 28℃、转速 170 r/min、培养 24 h 为基础培养条件。
1.2.4.2 菌株培养特性研究 培养时间:分别在培养 5、10、16、21、25、30、40 和 45 h 时取样检测;装液量:10%、20%、30%、40%、60%(v/v)LB液体培养液;培养温度:分别设置培养温度为20、25、30、35和40℃;初始pH值:用1 mol/L NaOH和1 mol/L HCl调节LB液体培养基的初始pH值分别为4.0、5.0、6.0、7.0、8.0、9.0和10.0;摇床转速:将摇床转速分别设置为100、120、150、180、200 r/min;菌种接种量:分别设置菌液接种量为1%、2%、3%、5%、10%。将各处理于基础培养条件下培养,用复筛方法测定各种条件下待测菌株对烟草青枯病的拮抗效果,同时测定菌株在600 nm处的吸光度了解菌株生长情况,每个处理设3个重复,计算其平均值。
1.2.4.3 不同碳源和氮源对菌株拮抗效果的影响固定碳氮源筛选基础培养基中其它元素,分别将10 g/L碳源和10 g/L氮源的备选碳源、氮源加入至基础培养基,测定菌株的拮抗效果,在基础培养条件下培养,用复筛方法测定各发酵液对烟草青枯病的拮抗效果,同时测定菌株在600 nm处的吸光度了解菌株生长情况,每个处理设3个重复,计算其平均值。
1.2.5 菌株的鉴定
1.2.5.1 显微形态、培养形态和生理生化特征分析将菌株于牛肉膏蛋白胨培养基上划线培养,于培养箱适温、适时培养,对菌落形态拍照,挑取单菌落进行革兰氏染色,并于光学显微镜下观察其显微形态。菌株大部分生理生化特征利用BiologGenⅢ型细菌鉴定仪的微孔板检测,具体按照Biolog-GenⅢMicroPlateTM使用说明书步骤操作,其微孔板布局如图1所示。其它生理生化试验检测内容参照赵斌等[4]的《微生物学实验》进行操作。将培养基pH值调节为5、6、7、8、9、10、11,NaCl含量调节为1%、4%、8%和10%(w/v)检测菌株生长pH值范围和NaCl耐受情况,检测菌株在7、15、25、30、40、45和50℃条件下的生长情况。
1.2.5.2 细菌总DNA提取与PCR扩增 细菌基因组DNA的提取采用杭州博日科技有限公司的试剂盒进行,按厂商说明书操作。用细菌通用引物对(正向引物 27F 5’-AGAGTTTGATCCTGGCTCAG-3’,反向引物 1492R 5’-GGTTACCTTGTTACGACTT-3’)扩增菌株16S rDNA基因。PCR反应体系为20 μ L,所用程序为:95℃ 3 min,95℃ 30 s,55℃ 45 s,72℃90 s,共 25 个循环;72℃ 10 min。由上海生工生物工程有限公司对PCR产物测序。

图1 Biolog GEN Ⅲ MicroPlate微孔板测试布局
1.2.5.3 系统发育树的构建 得到DNA序列后,首先利用计算机对其序列进行分析处理并进行排序,如果是反向引物得到的序列,还要将之转化成互补链的序列;利用Blast软件在GenBank、NCBI等数据库中进行相似性搜索;选取同源性比较高的典型菌株的16S rDNA序列作为参比对象;用CLUSTALW 1.8软件进行多序列比对并计算供试菌株与参比菌株之间的序列相似性;应用MEGA5.0软件,将测序获得各菌株的16S rDNA序列进行多序列完全比对,去掉两端差异序列后,利用Neighbor-Joining法根据Kimura-2法计算各类群间的核苷酸差异值,运行1 000次bootstrap构建获得系统发育。将测得的16S rDNA序列提交GenBank,获得各菌株核酸登录号。
2 结果与分析
2.1 拮抗菌筛选
通过判断菌株在检测培养基上的透明圈,初步筛选出对烟草青枯病具有拮抗作用的微生物菌株28株;再通过判断28株初筛菌株发酵液在复筛培养基上的抑菌圈大小,复筛出1株拮抗效果较好的细菌MT-002-B-7,该菌的发酵液在培养基上的抑菌圈明显,抑菌圈直径达到28.67 mm,如图2所示。

图2 MT-002-B-7发酵液打孔拮抗病原菌情况
2.2 盆栽试验验证拮抗菌对烟草青枯病的抑制效果
在盆栽试验期间,共进行3次病情调查,调查结果如表1所示。菌液处理在盆栽的整个试验期都无烟草青枯病的发病现象,而对照在第25 d的发病率达到100%,在3次病情调查中其病情指数逐渐升高。试验结果证明菌株MT-002-B-7对烟草青枯病具有良好的抑制效果。
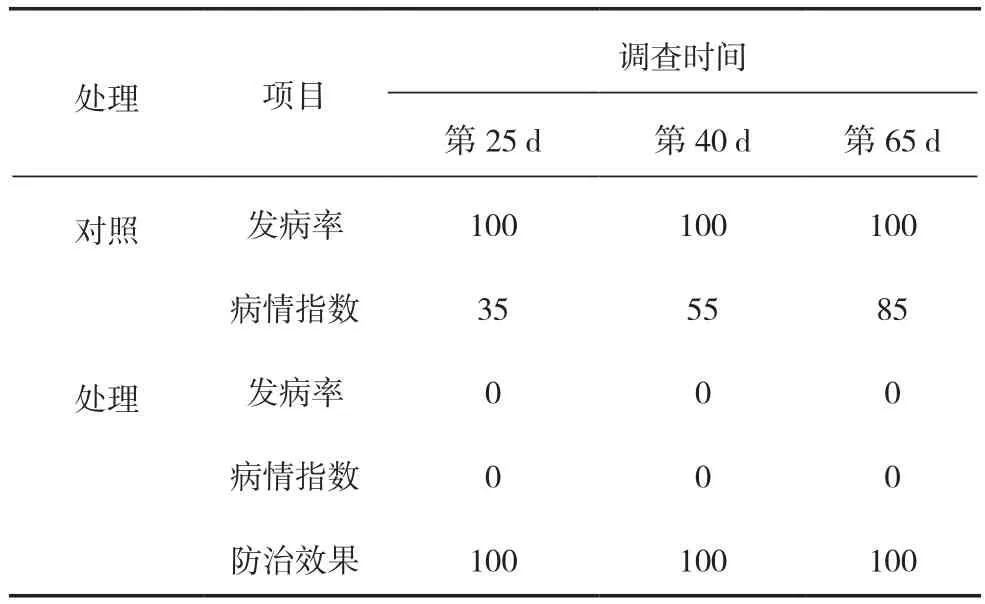
表1 各处理菌液施用后对烟草青枯病的防治效果(%)
2.3 MT-002-B-7液体发酵条件优化
从图3的8种因素对菌株MT-002-B-7拮抗烟草青枯病的影响结果中可以看出,当发酵液以葡萄糖为碳源时和以谷氨酸为氮源时最利于该菌抑制烟草青枯病原菌,同时分别以这两种物质为碳、氮源时菌液的浓度亦是最大。以促进MT-002-B-7抑制烟草青枯病的效果排序,则供试6种碳源的顺序如下:葡萄糖>麦芽糖>乳糖>甘露醇>蔗糖>木糖,供试6种氮源的顺序如下:谷氨酸>酵母粉 > 蛋白胨 >(NH4)2SO4>NH4NO3>KNO3;以促进MT-002-B-7生长的效果排序,则供试6种碳源的顺序如下:葡萄糖>乳糖>甘露醇>麦芽糖>蔗糖>木糖,供试6种氮源的顺序如下:谷氨酸>酵母粉 > 蛋白胨 >NH4NO3>(NH4)2SO4>KNO3。由4项排序结果可以看出,最利于该菌抑制烟草青枯病原菌和促进菌株生长的葡萄糖和谷氨酸以及最不利于该菌抑制烟草青枯病原菌和促进菌株生长的木糖和KNO3在各自组的排序相同,而其它10种碳、氮源在对该菌抑制烟草青枯病原菌和促进菌株生长的时候有些许变化,如碳源中的麦芽糖和氮源中的NH4NO3,可能是因为它们的发酵产物仅仅利于促进拮抗物质的分泌,却对菌株的生长帮助不大。
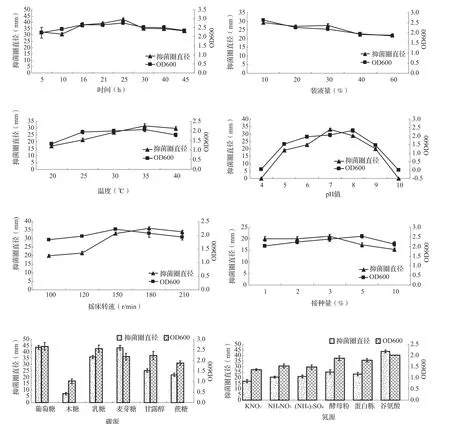
图3 8种因素对菌株MT-002-B-7拮抗烟草青枯病的影响
从图3中也可以看出,就利于菌株MT-002-B-7产生拮抗物质的最优水平而言,培养温度呈现不规律的变化,在5~16 h拮抗物质活性出现下降后再上升的情况,直到培养25 h最利于其产生拮抗物质,之后逐渐下降,而随着培养时间的增加菌液浓度逐渐升高,仍然在第25 h达到最高的菌液浓度,之后逐渐下降;随着装液量的增加,菌株MT-002-B-7产生拮抗物质的量逐渐降低,菌株生长浓度亦是逐渐降低。
另外,将培养液的初始pH值调节为7.0的情况下,装液量10%,接种3 mL(即接种量3%)的菌株母液,并将摇床温度控制在35℃,摇床转速设定为150 r/min的条件下培养25 h,该菌株对烟草青枯病原菌的抑制效果最好。而与以上条件不同的是,将pH值调节为8.0、摇床转速调为180 r/min以及接种量控制在5%,其它条件不变则最利于该菌株的生长。
2.4 菌株MT-002-B-7的鉴定结果
2.4.1 菌株MT-002-B-7的形态特征
菌株MT-002-B-7在牛肉膏蛋白胨培养基上微隆起,边缘整齐,呈蓝绿色,培养基在其生长过程中颜色变化较大,起初为黄绿色,之后逐渐加深,在培养基加深的过程中,菌落表面出现金属光泽。该菌是革兰氏阴性的好氧细菌,其光学显微形态呈短杆状,如图4所示。
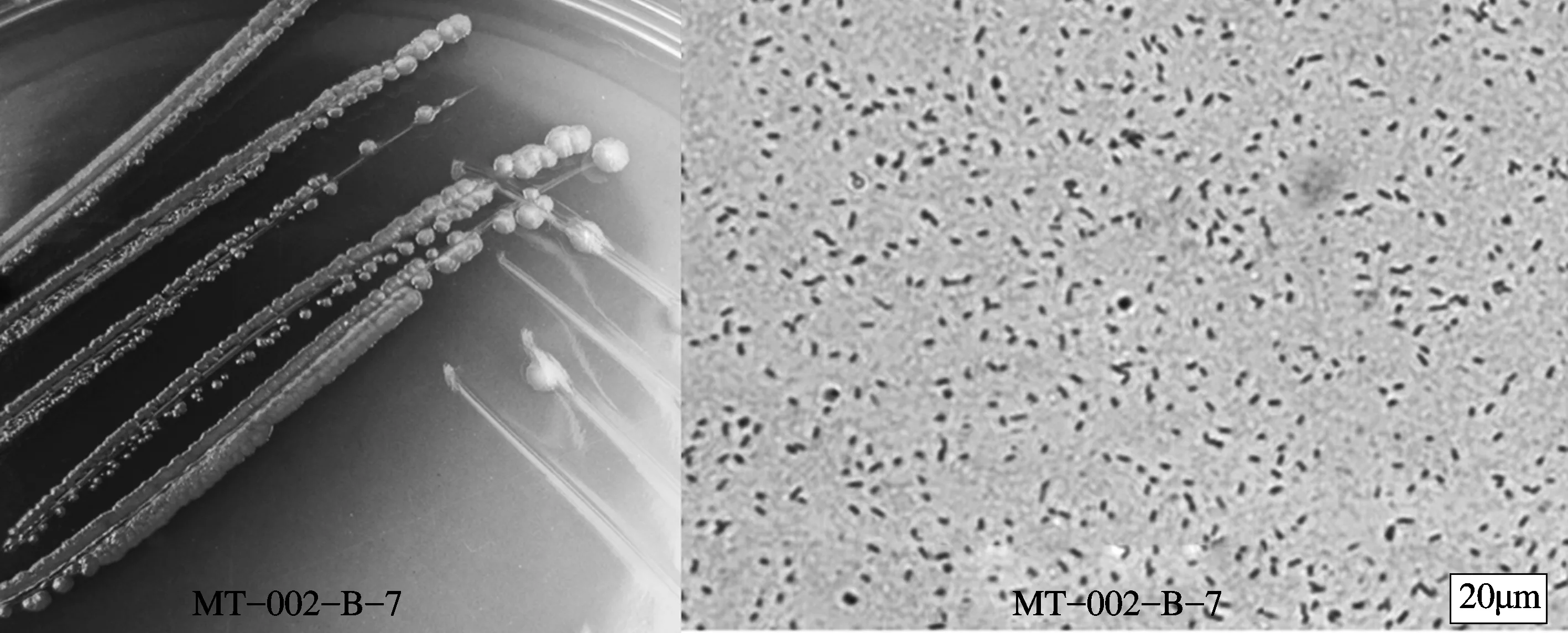
图4 菌株MT-002-B-7在牛肉膏蛋白胨培养基上的菌落形态及其光学显微形态(×1 000)
2.4.2 菌株MT-002-B-7的生理生化检测结果
菌株MT-002-B-7的pH值生长范围是5~9,最适生长pH值为6和7,耐受NaCl的能力一般,能在含4% NaCl的培养基中生长,生长温度为15~45℃,温度在30~40℃时,菌株长势都好。油脂水解,甲基红反应、明胶液化、牛奶凝固、产硫化氢反应、硝酸盐还原反应和过氧化氢酶反应为阳性,水解淀粉、纤维素水解反应呈阴性,如表2所示,位置对应内容如图5。
从菌株MT-002-B-7培养22 h后在Biolog鉴定板上的鉴定结果可知,该菌与Pseudomonas aeruginosa相似形最高,其中二甲胺四环素反应、L-组胺利用、葡糖醛酰胺利用和γ-氨基-丁酸的反应结果有所不同,其余的反应结果相同,如图5所示。它们的相似度(SIM)为0.595,距离(DIST)为4.031,匹配的可能性(PROB)为82.8%,根据SIM>0.5,DIST<5表示匹配良好的原则,从鉴定板结果初步判定菌株MT-002-B-7为Pseudomonas aeruginosa。
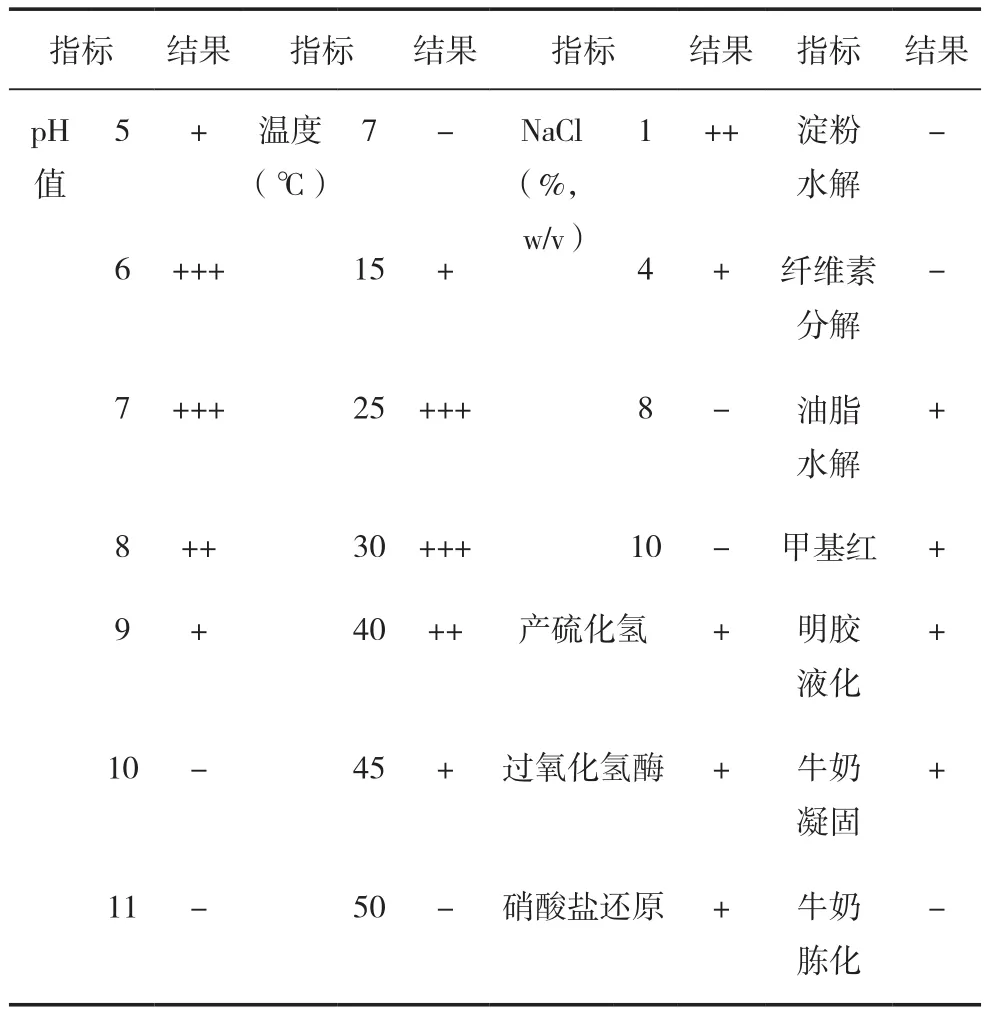
表2 菌株MT-002-B-7的部分生理生化特征
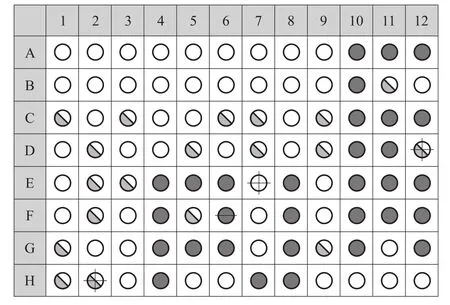
图5 MT-002-B-7和Pseudomonas aeruginosa在微孔板上的反应结果对比
2.4.3 菌株 MT-002-B-7 16S rRNA 基因部分序列分析
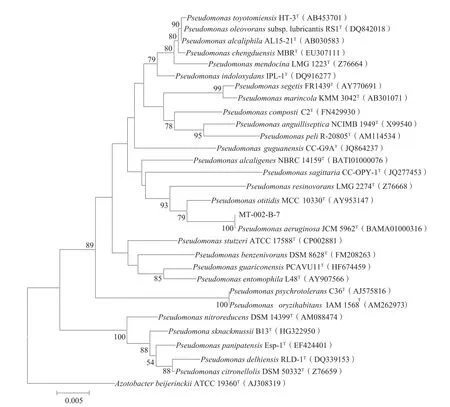
图6 通过邻接法构建的基于菌株MT-002-B-7及相关菌株16S rDNA序列的系统发育树
菌株MT-002-B-7的16S rRNA基因部分序列 长 度 为 1 461 bp, 在 GenBank 核 酸 登 录 号 为KR136350。根据菌株MT-002-B-7系统发育分析,菌株MT-002-B-7属于假单胞菌(Pseudomonas)细菌,与其系统发育关系最近的典型菌株(铜绿假 单 胞 菌 )Pseudomonas aeruginosa JCM 5962T聚为一簇,其16S rRNA基因相似性为99.4%,其次 是 典 型 菌 株 Pseudomonas otitidis MCC10330T和Pseudomonas alcaligenes NBRC 14159T,其 16S rRNA基因相似性分别为98.0%和97.0%。菌株与假单胞菌(Pseudomonas)其它典型菌株的相似性<97.0%。通过邻接法构建的基于菌株MT-002-B-7及相关菌株16S rDNA序列的系统发育树如图6所示。结合其形态特征、生理生化特征和16S rRNA基因部分序列分析结果[8-9],判定菌株MT-002-B-7属于假单胞菌属的铜绿假单胞菌。
3 讨论与结论
从高粱根际土中分离获得一株对烟草青枯病原菌具有较好拮抗效果的细菌MT-002-B-7,基于形态、培养和生理特征,结合16S rDNA序列分析,初步鉴定为铜绿假单胞菌。该菌对烟草青枯病原菌的抑菌圈直径可以达到28.67 mm,和易有金等[10]筛选的拮抗菌B-001的抑菌圈直径为25 mm、缪莉等[11]筛选获得的真菌抑菌圈直径为2.6 cm、董夏伟等[12]分离所得的拮抗菌对病原菌的抑菌圈为28.9 mm等研究效果相比,该菌抑菌效果较好。
关于铜绿假单胞菌拮抗烟草青枯病的特性已有不少报道[12-15],结合已有报道中的研究方法,本研究经过单因素优化后,获得利于菌株MT-002-B-7抑制烟草青枯病原菌的最佳培养基碳氮源和培养条件为:以葡萄糖为碳源,以谷氨酸为氮源,装液量10%,培养基初始pH值7.0,接种量3%,温度35℃,转速150 r/min,培养25 h。该优化结果为工业生产该菌株提供了基础数据,同时也根据菌株MT-002-B-7能在常规条件下进行发酵生产、对发酵条件无苛刻要求的情况,可以初步判断该菌具有一定的环境适应能力。
关于铜绿假单胞菌最多的研究集中在医学领域,它是伤口感染较常见的一种细菌,被医学界广泛、深入地进行了多方面的研究。尽管如此,由于铜绿假单胞菌的次生代谢产物种类极其丰富,就已被研究鉴定的就有24种[16],这些次生代谢产物在抑制作物病原菌生长和促进作物生长等方面的作用显著,不仅对青枯病具有抑制作用,也能够抑制除了青枯病外的腐霉菌、灰葡萄孢菌、稻瘟菌、尖镰刀菌、链格孢菌、黑曲霉、纹枯病等众多植物病原菌[17-23],因此该类菌在农业生物防治方面的作用不容忽视。本研究说明铜绿假单胞菌对烟草青枯病具有防治效果,具有进一步研究的价值。
