一株动性球菌对苜蓿的促生和缓解NaHCO3胁迫作用
2019-06-18李建伟唐呈瑞向君亮申永瑞殷奎德张兴梅
李建伟,唐呈瑞,向君亮,刘 瑀,申永瑞,殷奎德,张兴梅*
(1.黑龙江八一农垦大学农学院,黑龙江 大庆 163319;2.中国科学院沈阳应用生态研究所,辽宁 沈阳 110016;3.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319;4.黑龙江八一农垦大学,黑龙江 大庆 163319)
土壤盐碱化会使其自身营养下降,破坏其内部良好的团粒结构,对植物造成严重的渗透胁迫,严重影响植物的生长发育[1]。而通过接种或浸种的方式将耐盐碱微生物与植物共生,可缓解胁迫对植物的危害,降低盐碱对植物的不利影响,从而利用微生物改良盐碱土[1-3]。苜蓿(Medicago sativa L.)是世界上利用最早、栽植最广的多年生豆科牧草,因其具有营养丰富,品质好,蛋白含量高,能生物固氮等优点,被誉为“牧草之王”[4]。它不只是重要的饲草作物,还能改良土壤和保持水土,对畜牧业发展和生态环境建设做出了重要贡献。然而,随着土地盐碱化面积的逐渐扩大,苜蓿产业化受到严重威胁。对于微生物改善盐碱胁迫并提高苜蓿生长的研究报道较少,目前丛枝菌根真菌已经被证实可促进盐碱胁迫下苜蓿的生长。如,赵琦等[5]在盐碱混合胁迫条件下,接种丛枝菌根真菌(AMF)能够改变紫花苜蓿体内酚酸的含量,积累渗透调节物质,促进自身生长,从而提高其耐盐碱性。但耐盐碱细菌对NaHCO3胁迫下苜蓿的生长并未见报道。本研究从大庆草原盐碱土中分离筛选到一株动性球菌属的细菌,该菌具有耐盐性、固氮和产ACC脱氨酶等促生特性;测试该菌株对苜蓿种子萌发和NaHCO3胁迫下苜蓿幼苗生长的影响,对其进行分析,以期初步揭示其对苜蓿的促生和缓解NaHCO3胁迫的作用机理,在微生物缓解NaHCO3胁迫对植物的伤害方面有着重要的作用。
1 材料与方法
1.1 盐碱土的采集与处理
采用5点法于黑龙江省大庆市龙凤区采集未经人为破坏的盐碱土,挑出枯草、草根及石块,混合均匀,放置于无菌袋中冷藏运送回实验室。经测定其盐碱土的理化性质为pH 8.34,碱解氮为315 mg/kg,有效磷为 19.2 mg/kg,速效钾为 398 mg/kg,有机质含量为33.7 g/kg,含盐量为0.30%。
1.2 供试材料
供试苜蓿为敖汉苜蓿,由黑龙江八一农垦大学生命学院草业科学实验室提供。
1.3 主要试剂和培养基
分别按照李艳星等[6]和刘莎莎[7]的方法进行菌株的固氮和产ACC脱氨酶能力鉴定。
1.4 S38的分离和鉴定
采用传统涂布划线法于筛选培养基上分离获得该菌,获得纯培养物后,利用引物27F和1492R扩增其16S rDNA基因,纯化PCR产物后与pGM-T载体连接,转入大肠杆菌DH5α中,经蓝白斑筛选后,用引物T7和SP6进行PCR验证,验证正确后,委托上海生工公司完成序列的测定。利用NCBI Blastn寻找一致性高的序列(构建16S rRNA基因系统树时选一致性高的模式种序列)作为系统发育分析的参比序列;然后用MEGA 7.0软件内置的Clustal W程序对获得的序列进行对比,用Neighbor-Joining法构建系统发育进化树,其中,Bootstrap method值设为 1 000,其余参数为默认值。
1.5 苜蓿种植和碱胁迫处理
苜蓿萌发期处理:将菌株接种于S-G改良培养基中,在 37 ℃,175 r/min 培养 24 h,于 10 000 g 离心15 min,弃上清液,沉淀用无菌蒸馏水洗涤并重悬,重复3次后调节OD600至0.5,将表面消毒后的苜蓿种子分别浸泡于重悬菌液(S1)和无菌蒸馏水(CK1)中,24 h后分别将其摆放于无菌培养皿中并加入10 mL无菌蒸馏水,放置于培养箱中(温度25 ℃,光暗周期 12 h/ 12 h),培养过程中适量补充水分。
苜蓿幼苗期处理:实验采用蛭石浇灌营养液的培养方式,每盆中央分别播种5粒刚刚萌发的苜蓿种子,覆蛭石1 cm。实验过程中,设置2种处理和3次重复,即NaHCO3胁迫处理不施加菌液和施加菌液,2种处理分别以CK2和S2表示,S2的菌液量为每盆施加 20 mL(OD=0.5,108cfu/mL),同时 CK2相应施加等量的无菌蒸馏水20 mL;每个处理播种20盆,放置于温室培养(温度25℃,光暗周期14 h/10 h);为了模拟取样的盐碱土pH,每隔7 d浇一次含有 25 mmol/L 的 pH 8.5 NaHCO3的营养液,每次50 mL,施用后 24 h 测量其 pH,使之恒定 pH 8.5。
1.6 苜蓿生长性状及生理指标测定
苜蓿萌发期:待培养5 d后统计种子发芽率,7 d后测定其芽长、根长和鲜重。
苜蓿幼苗时期:苜蓿出苗生长22 d后,观察并测定其形态、株高、根长、鲜重和干重等生长指标;采用95%乙醇提取法测定叶片中叶绿素含量;利用半微量凯氏定氮法测定地上部及地下部氮含量和离子含量(K+);应用蒽酮比色法测定地上部和地下部可溶性糖含量;参照张志良等[8]著《植物生理学实验指导》测定地上部和地下部抗氧化酶(SOD、POD、CAT)活性。
1.7 数据统计分析
采用 SPSS 18.0 对测定的数据进行统计分析及差异显著性分析(显著差异水平0.05,用小写字母表示),用 Excel 2016 处理数据和作图。
2 结果与分析
2.1 菌种分离和鉴定
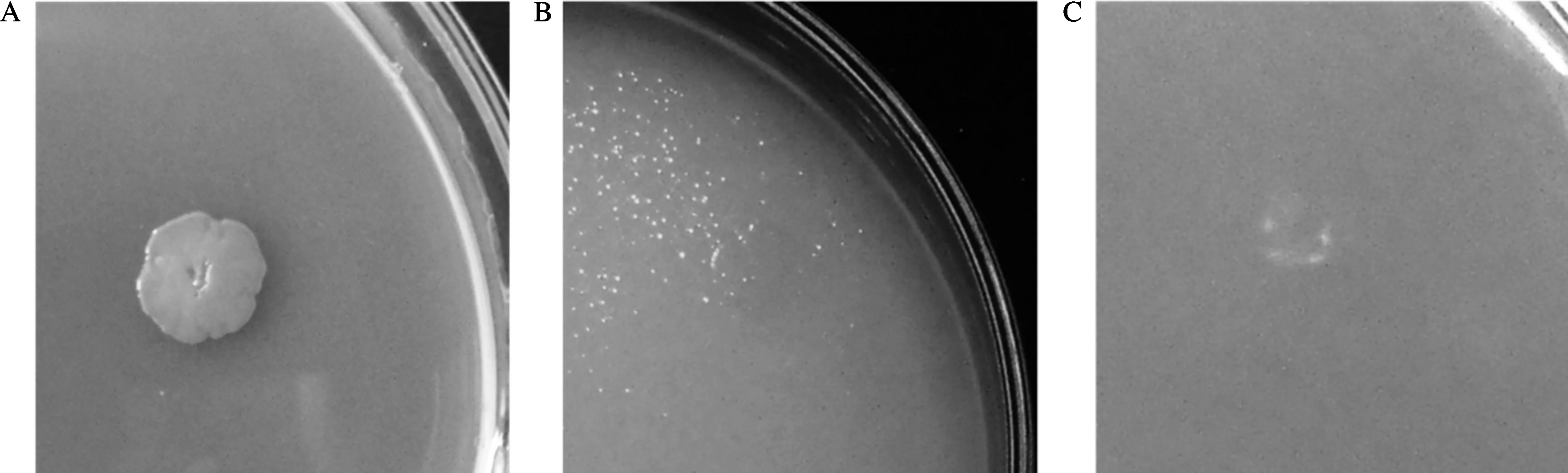
图1 菌落形态和促生特性鉴定
采集的盐碱土分别在pH 8.5终浓度为50 mmol/L Na2CO3和 100 mmol/L NaHCO3的筛选压力下,经过分离纯化共获得43株不同菌落形态的耐盐碱细菌。其中1株编号为38的细菌(S38)(图1A)对植株促生有较明显的作用,将其在阿须贝无氮培养基和以ACC为唯一碳源的ADF培养基上生长(图1B和C),从而预测38号菌株具有固氮和产ACC脱氨酶的能力。基于16S rRNA基因序列测定,S38部分16S rRNA 基因序列长度为 1 455 bp。该序列经 NCBI Blastn分析表明,此株细菌的16S rRNA基因序列与现有模式菌株Planococcus rif i etoensisM8T(CP013659)的相似性最高,为98.14%。系统发育分析结果(图2)也表明,S38 与Planococcus rifietoensisM8T(CP013659)菌株亲缘关系最近,且其处于进化树Planococcus属模式种进化支上,表明该菌株属于Planococcus属。

图2 S38基于16S rRNA的系统发育进化树
2.2 S38对苜蓿种子萌发的影响
从表1中可以发现,S1(菌液处理)与CK1(无菌蒸馏水)相比,培养5 d的苜蓿种子发芽率显著提高,达到了93.33%;培养7 d的苜蓿苗长增加了1.04倍,鲜重增加69.57%,均在0.05水平下达到了显著水平。可见,菌液对苜蓿种子有显著的促生作用,这更有助于其后期的继续生长发育。

表1 苜蓿生长性状
2.3 S38对NaHCO3胁迫苜蓿幼苗生长性状及生理特性的影响
2.3.1 幼苗生长性状
NaHCO3胁迫下苜蓿幼苗生长22 d时,对比观察和测定了地上部和地下部生物量、株高和根长。结果(图3,表2)表明,CK2(NaHCO3胁迫处理)与S2(NaHCO3胁迫加菌液处理)对碱胁迫下苜蓿幼苗生长影响有显著差异。S2与CK2相比,株高增高了8.44%,根长增长了12.34%,地上部和地下部生物量分别提高32%和50%,根冠比增加16.76%;其中,除地上部和地下部生物量在0.05水平下达到显著差异以外,其它均未达到显著水平。可见,S38可以影响NaHCO3胁迫下苜蓿形态,尤其是根形态的建成。
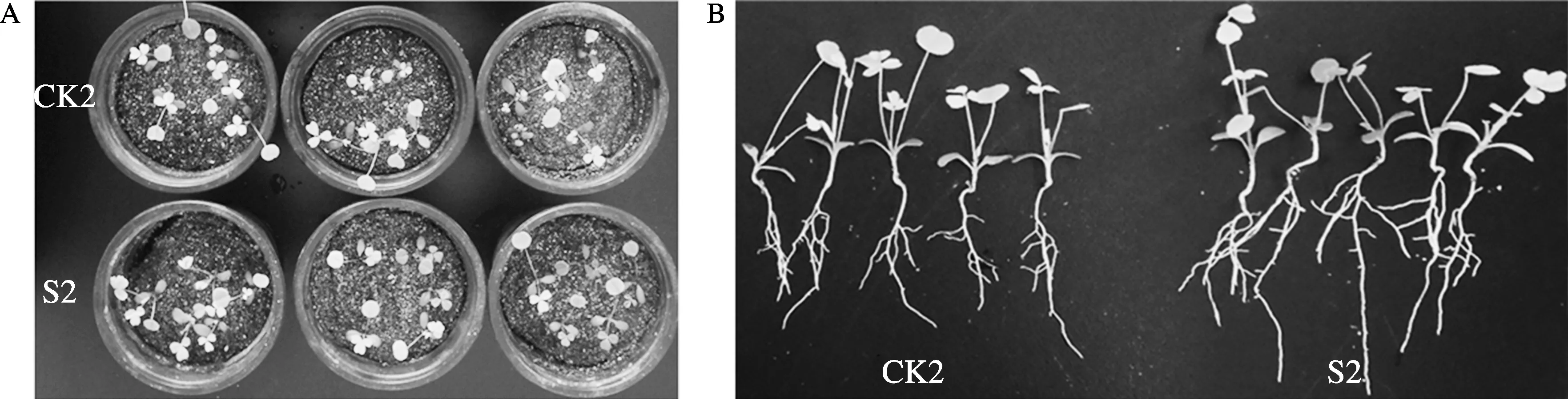
图3 NaHCO3胁迫下苜蓿植株形态
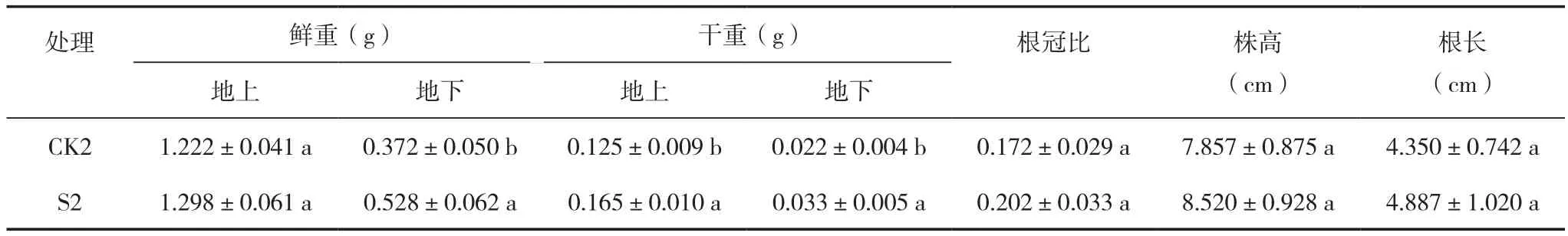
表2 NaHCO3胁迫苜蓿生长性状
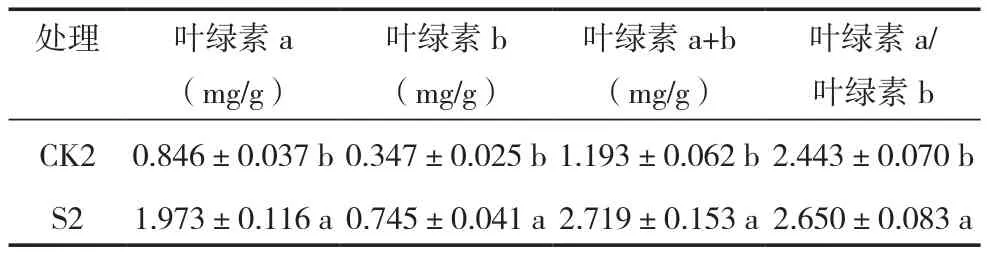
表3 NaHCO3胁迫苜蓿光合色素含量
2.3.2 光合色素含量
叶绿素包括叶绿素a(Chla)和叶绿素b(Chlb),叶绿素在植物体内负责光能的吸收、传递和转化,其中一部分特殊的Chla负责将植物吸收的光能转化为化学能;Chla和Chlb分别吸收红橙光和蓝紫光,Chla/Chlb提高更有利于叶片对长波光聚集。因此,植物的光合色素含量的高低是衡量植物光合作用的重要指标。从表3可以看出,S2与CK2相比,Chla、Chlb和Chla+Chlb含量分别增加了1.33、1.15和1.28倍,Chla/Chlb增加了8.47%,且均达到了显著水平(P<0.05)。可见,S38可以影响NaHCO3胁迫下苜蓿光合作用,对苜蓿幼苗生长产生积极作用。
2.3.3 氮含量
碱胁迫下营养缺乏是形成植物受害的重要原因之一,并且植物同化氮素的能力降低,造成氮营养的缺乏,维持较高的氮同化能力对于增强植物的耐性具有重要作用。如图4所示,CK2与S2对NaHCO3胁迫下苜蓿幼苗氮含量影响无显著差异。
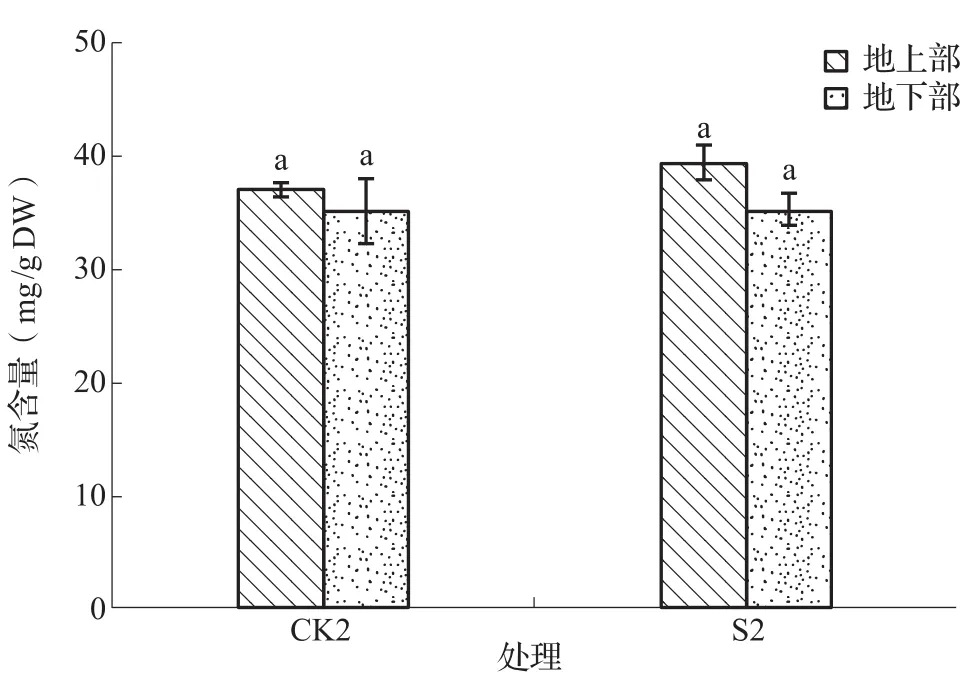
图4 NaHCO3胁迫下苜蓿幼苗氮含量
2.3.4 渗透调节物质(可溶性糖含量)
可溶性糖作为有机渗透调节物质合成的能量和碳骨架的来源,在碱胁迫条件下,植株体内细胞液可溶性糖含量增加使其浓度增大,从而增强细胞吸水能力,保持细胞的膨压,以便水分在跨膜运输过程中保证植物细胞对水分需求,从而保持细胞生理生化过程在正常状态,使植物免受生理干旱。如图5所示,S2与CK2相比,地上部可溶性糖含量降低了8.59%,地下部可溶性糖含量降低了17.56%,且均达到了显著水平。由此可见,S38能够降低NaHCO3胁迫下苜蓿幼苗的可溶性糖含量,缓解了苜蓿幼苗通过积累可溶性糖含量来进行保水以对抗NaHCO3胁迫伤害的作用。
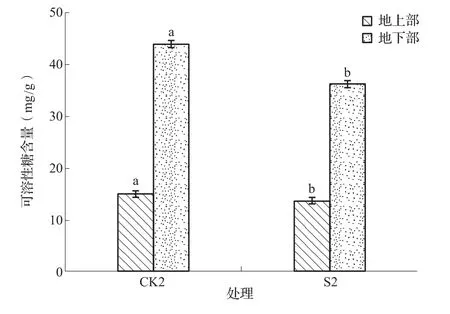
图5 NaHCO3胁迫下苜蓿幼苗可溶性糖含量
2.3.5 抗氧化酶活性(SOD、POD、CAT)
植物在自然条件下生长也可能会受到逆境胁迫,这些胁迫会导致植物形成过量的活性氧自由基(reactive oxide species,ROS),而 ROS 对细胞膜系统、脂类、蛋白质和核酸等大分子具有很强的破坏作用,同时,植物体内的抗氧化保护酶系统也可以清除体内多余的氧自由基,防止ROS的毒害,提高抗逆性,ROS清除系统由许多酶和还原性物质组成。其中,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)是主要的抗氧化酶。SOD是清除超氧自由基的关键酶,从图6A可知,S2与CK2相比,地上部和地下部SOD活性分别降低了31.22%和41.21%,且均达到了显著水平。POD是逆境条件下酶促防御系统的关键酶,由图6B可以发现,S2与CK2相比,地上部和地下部POD活性均有所降低,但均未达到显著水平。在植物体中,CAT具有双重作用,第一,适量的过氧化氢通过诱导一系列防御机制来保护植物细胞免受氧化胁迫;第二,过量的过氧化氢则导致过氧化损伤,对植物体造成伤害,如图6C所示,S2与CK2相比,地上部和地下部CAT活性分别降低了20.73%和29.72%,且均达到了显著水平。可见,碱胁迫导致了叶片活性氧的积累,进而通过反馈调节,增加了SOD和CAT活性,而S38缓解了NaHCO3胁迫对苜蓿幼苗的负向影响,以维持其正常的生长发育。
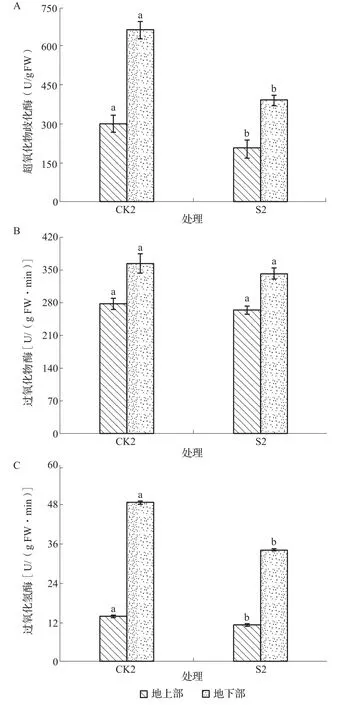
图6 NaHCO3胁迫下苜蓿幼苗抗氧化酶活性
2.3.6 无机阳离子含量(K+)
植物在碱胁迫下被迫吸收无机离子,造成植物体内离子平衡遭到破坏,造成离子毒害。K+是维持细胞膨压的主要阳离子。从图7中可以发现,S2与CK2相比,地上部和地下部K+含量分别增加了11.66%和18.25%,且均达到了显著水平。可见,NaHCO3胁迫使苜蓿的生长环境增加大量Na+,从而影响苜蓿体内水势,为了维持体内Na+/K+含量平衡,K+含量降低,而S38缓解了Na+在苜蓿体内的积累,使苜蓿体内K+含量增加。
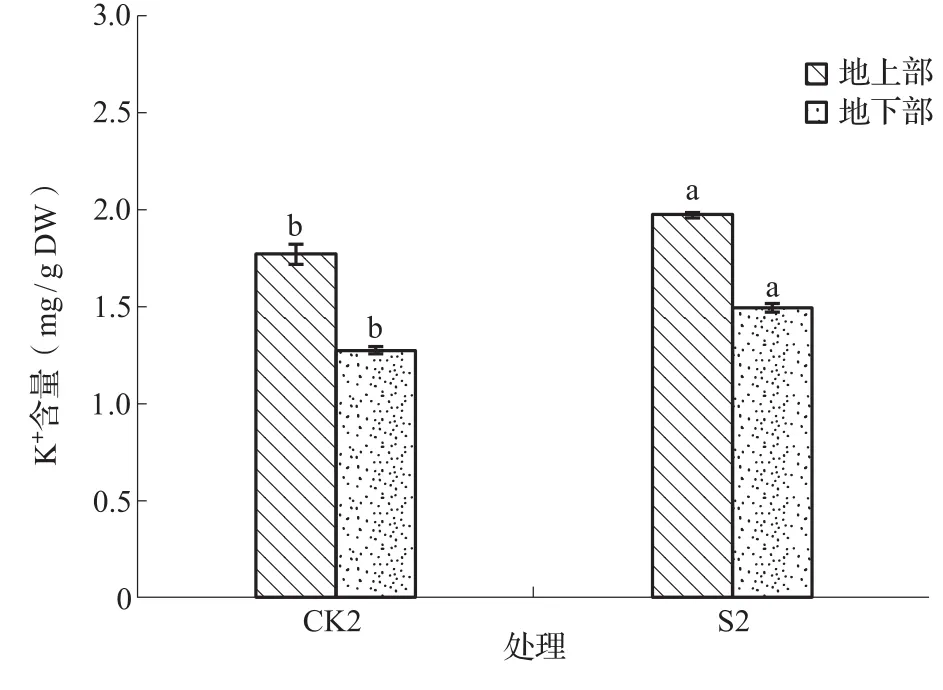
图7 NaHCO3胁迫下苜蓿幼苗K+含量
3 小结与讨论
以促进植物生长为特性的耐盐细菌,自发现对促进盐渍土壤植物生长以来而备受关注[9-10]。本文以传统的涂布划线法,在采集的盐碱土中筛选获得1株耐盐碱且预测具有固氮和产ACC脱氨酶能力的细菌,为验证该菌的功能还需要补充固氮基因等相关实验。通过系统发育树分析可知,该菌是 Planococcus属细菌,与 Planococcus rif i etoensis M8T(CP013659)相似性极大(98.14%),很可能菌本身的特性和对植株的作用也很相似。Planococcus rif i etoensis M8T(CP013659)是一种中度耐盐菌,它能通过将氨转化为氮,从而促进小麦生长[11];2016年,See-Too等[12]第一次对Planococcus rif i etoensis M8T进行了完整的基因组分析;在高盐胁迫的土壤中施入Planococcus rif i etoensis,可以减少植物细胞的离子失衡[13];在盐胁迫下,Planococcus rif i etoensis可以改善植物生长和土壤肥力[14];同时,Planococcus rif i etoensis在甜菜上也有应用,不仅增加了种子的发芽和生物量,更提高了甜菜的光合能力和降低了甜菜在不同NaCl浓度(50 ~ 125 mmol/L)下乙烯的产量[15]。本研究利用S38对苜蓿种子进行浸种处理,结果发现,浸种后苜蓿种子的发芽率、苗长和鲜重均明显地增加。逆境对植物个体形态发育具有显著影响,主要表现就是逆境抑制了植物组织和器官的生长。生长抑制是植物对逆境胁迫最直接的表现,也是评价植物耐性最直观的指标。本研究在NaHCO3胁迫下,施加S38菌液相比不施加菌液处理的苜蓿幼苗,地上部和地下部干重均显著增加,这可能是施加S38菌液促进苜蓿幼苗光合色素含量增加(Chla、Chlb和Chla+Chlb均显著提高),导致光合能力增强,积累更多的有机物,同时运输到地下部,故苜蓿幼苗地上部和地下部生物量显著增加。在植物细胞的正常代谢过程中,几乎所有的需氧反应都可以产生活性氧,ROS的产生与清除始终处于动态平衡。逆境胁迫下,ROS浓度会增加,使细胞产生大量的ROS,会诱导抗氧化酶类活性、积累抗氧化物质,以清除植物体内过多的ROS,缓解对植物的伤害,维持植物正常的生长发育。渗透调节也是植物对逆境胁迫的应激手段之一,可溶性糖等渗透调节物质在逆境条件下会大量积累,以降低细胞渗透势,缓解水分的流失。本研究发现在NaHCO3胁迫下,施加S38菌液与不施加菌液处理相比,苜蓿幼苗地上部与地下部可溶性糖含量、SOD和CAT活性均显著降低,可能是施加S38菌液促进了植株的无机阳离子含量显著增加(地上部和地下部K+含量分别增加了11.66%和18.25%)并适当积累,足以维持苜蓿幼苗正常的生理代谢,因此,施加38号菌液的苜蓿幼苗不需要产生过多的抗氧化酶,合成大量的可溶性糖就可以维持细胞内的渗透平衡。虽然本研究表明了S38对苜蓿种子萌发有促进作用,也对NaHCO3胁迫下的苜蓿幼苗有缓解作用,说明该菌在促进植物适应逆境胁迫方面具有良好的应用潜力,但对NaHCO3胁迫下苜蓿整个生长周期的生长和产量等的影响及其机理等方面还有待更进一步的研究。
