热蒸煮及模拟胃肠消化处理对海产品中砷形态物转化的影响研究
2019-06-17梅光明常家琪朱羽庄孟春英
梅光明,常家琪,朱羽庄,严 国,孟春英
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
海产品是人体摄入砷的主要贡献者[1-3],特别是贝类、蟹类为砷元素的高富集品种。为了提高海产品的可口性,通常会对其进行烹饪加工,不同的加工方式有可能会使产品中的砷含量及形态发生变化,造成毒性降低或产生毒性更大的化合物[4]。有研究报道无毒的砷糖在一些人为条件下可转化为二甲基砷酸、二乙基砷酰乙醇等毒性较强的砷化合物[5]。ICHIKAWA,et al 等[6]研究发现样品经过浸泡、蒸煮等步骤就能去除约90%的砷;SARTAL,et al[1]对煮熟海藻样品、烹饪水以及模拟体外消化获得的熟海藻透析液定量定性研究发现,海藻样品中的部分砷会在烹饪过程中从海藻基质移出并释放到水中,不同砷化合物在不同品种海藻中的透析性或溶解性有所差异。因此科学评价海产品中砷污染带来的健康影响程度,一方面需要对其进行砷污染状况测定,另一方面还要关注样品中砷化合物的生物可给性和生物利用度研究。生物可给性指从胃肠道中的基质中释放出类可用于肠吸收的部分,生物利用度指的是能够到达全身循环代谢的外部剂量。生物可给性可以通过体外或者体内模拟实验进行评估,体内实验和体外实验是研究污染物生物可给性的主要评价方法[7-8]。采用与人体结构相似的动物模型进行体内实验的结果一般被认为是准确可靠的,但动物实验因其所需周期长、实验成本高、不可控因子多等因素导致其应用受到限制[9-10]。体外环境模拟实验成为研究污染物在人体生物有效性的又一有效方法,该方法因具有简单易操作、可重现性良好、精确度高且实验成本低等优点而获得广泛应用[11-14]。本实验以砷元素富集能力较强的厚壳贻贝Mytilus coruscus 和三疣梭子蟹Portunus trituberculatus 为研究对象,采用体外仿生消化模拟实验,分别对原料样品、蒸煮样品、蒸煮水和胃肠仿生消化处理样品中的总砷及砷形态进行定量与定性测定,初步探讨食品加工处理和胃肠消化下砷元素化合物转化规律。
1 材料与方法
1.1 材料与试剂
梭子蟹和贻贝均购于浙江舟山丰茂菜场,正值上市销售的健康鲜活品。三疣梭子蟹规格为300~400 g/只,厚壳贻贝壳长8~9 cm/粒。
砷甜菜碱AsB 溶液标准物质(GBW 08670)、一甲基砷MMA 溶液标准物质(GBW 08668)、二甲基砷DMA 溶液标准物质(GBW 08669)、砷酸根As(Ⅴ)溶液标准物质(GBW 08667)、亚砷酸根As(Ⅲ)溶液(GBW 08666),中国计量科学研究院;砷单元素标准溶液(1 000 μg·mL-1,GSB04-1714-2004),国家有色金属及电子材料分析测试中心;大虾粉(GBW10050)生物成分分析标准物质、紫菜粉(GBW10023)生物成分分析标准物质,地球物理地球化学勘查研究所;BCR-627 金枪鱼组织中砷不同形态标准物质,欧洲标准局;碳酸铵,德国Sigma 公司;正己烷(色谱纯),德国Merck 公司;浓硝酸(农残级),美国J.T.Baker 公司;浓盐酸、氨水,均为优级纯,国药集团化学试剂有限公司;质谱调谐液(10 μg·L-1Ce、Co、Li、Tl、Y)和内标溶液(100 μg·mL-1Rh),美国Agilent 公司;PIPES(哌嗪-1,4-双(2-乙磺酸)二钠盐),梯希爱(上海)化成工业发展有限公司;胆酸钠和脱氧胆酸钠,东京化成工业株式会社;胰液素(CFAD-P1750,来源于猪胰腺) 和胃蛋白酶(CFADP7012),上海安谱实验科技股份有限公司;实验用水为Milli-Q 制备超纯水(电阻率≥18.2 MΩ·cm)。
1.2 仪器与设备
AcquityTM H-class 液相色谱仪,美国Waters 公司;7900 型电感耦合等离子体质谱仪,美国Agilent 公司;Centrifuge 5810 高速离心机,德国Eppendorf 公司;MS2 漩涡混合器,德国IK 公司;AL204 型电子天平,瑞士梅特勒-托利多仪器有限公司;pH 计,德国Sartorius 公司;ETHOS 1 型微波消解仪,附有聚四氟乙烯消解罐,意大利Milestone 公司;EH20A plus 型微控数显电热板,北京菜伯泰科仪器股份有限公司;气浴恒温振荡器,江苏常州国华电器公司;FreeZone 型冷冻干燥机,美国Labconco 公司;Spectra/pro 6 Dialysis Menbrane(10 KD),美国Spectrum Laboratories 公司;Dionex IonPac As19 阴离子交换柱(250 mm×4 mm×10 μm)及保护住(50 mm×4 mm),美国Thermo 公司。
1.3 实验方法
1.3.1 溶液配制
透析溶液:称量PIPES(哌嗪-1,4-双(2-乙磺酸)二钠盐)5.194 8 g,超纯水定容至100 mL。
模拟新鲜胃液:准确称量0.3 g(精确至0.01 g)胃蛋白酶,用0.1 M 硝酸定容至5 mL。
模拟新鲜肠液:准确称取胰液素0.4 g,胆酸钠和脱氧胆酸钠各1.25 g,均溶于0.1 M 碳酸氢钠溶液中,超声均匀后用0.1 M 碳酸氢钠溶液定容至100 mL。
1.3.2 样品制备
1.3.2.1 原料样品制备
按照《GB/T 30891-2014 水产品抽样规范》[15]采集样品并处理后作为原料样品。
1.3.2.2 样品的蒸煮过程
将约1 kg 的梭子蟹(整蟹)置于煮锅内,锅内添加2 000 mL 超纯水,电磁炉功率设置2 000 W,进行梭子蟹蒸煮(3~5 min)。1 kg 贻贝蒸煮过程同上,时间控制5~8 min。两种样品的蒸煮水经0.22 μm 微孔滤膜过滤后储存聚乙烯瓶中保存。
1.3.2.3 样品的干燥
取上述煮熟后的梭子蟹和贻贝取可食组织后用研钵充分研细得到均匀样品(称煮熟样品),和原料样品一起经冷冻干燥36 h 后取出,置于4 ℃保存备用。
1.3.2.4 胃肠仿生消化处理
准确称量0.5 g(精确至0.000 1 g)置于100 mL 锥形瓶中,加入20 mL 超纯水充分振摇15 min 后用6 mol·L-1的HCl 调节溶液pH 至2.0。加入模拟新鲜胃液0.15 g,振摇均匀后用保鲜膜将锥形瓶封口,置于150 r·min-1、37 ℃恒温条件的气浴摇床孵育2 h。取出后于冰水浴中放置10~15 min 进行停止酶反应。溶液恢复至室温后,准确移取5 mL 模拟新鲜肠液加入上述锥形瓶内,同时在10 KD 透析袋内加入20 mL 透析溶液后用专用封口夹将其两端紧封后置于锥形瓶内,然后再次将锥形瓶置于150 r·min-1、37 ℃恒温条件的气浴摇床孵育2 h,取出后冰水浴10~15 min 停止酶反应。用超纯水冲洗透析袋表面后,将里面透析液转移至聚乙烯瓶中并称重,得到透析样品,置于-20 ℃下保存备用。
1.3.3 总砷测定前处理
准确称量0.2 g(精确至0.000 1 g)冷冻干燥过的样品于聚四氟乙烯消解罐中,依次加入6.0 mL 硝酸、2.0 mL 过氧化氢溶液,摇匀后加盖放置过夜,使样品进行预消解。次日将消解罐放入微波消解系统中,设置适宜的微波消解程序(表1),按照相关消解步骤进行消解。消解完毕后,170~180 ℃下于赶酸架上加热赶酸至1~2 mL,冷却至室温后用超纯水定容至50 mL,采用ICP-MS 上机测定。同时做试剂空白实验,采用大虾粉和紫菜粉作为质控样进行结果质量控制。
蒸煮水样品的总砷含量测定参照《HJ 700-2014 水质65 种元素的测定 电感耦合等离子体质谱法》[16]中的前处理进行。

表1 微波消解程序Tab.1 Microwave digestion procedure
1.3.4 砷形态前处理
准确称量0.25 g(精确至0.000 1 g)冷冻干燥后的待测样品于50 mL 离心管中,加入20 mL 0.15 mol·L-1硝酸溶液,3 000 r·min-1涡旋1 min,置于气浴恒温振荡器中(50 ℃、150 r·min-1),过夜振荡提取,提取完毕后次日取出,冷却至室温,3 000 r·min-1涡旋30 s,6 000 r·min-1离心8 min。移取5 mL 上清液于15 mL 离心管中,加入正己烷3 mL,3 000 r·min-1涡旋1 min 后再6 000 r·min-1离心8 min,弃去上方正己烷层。吸取下层清液,经0.22 μm 水相滤膜过滤后进行HPLC-ICP-MS 分析。按相同操作方法做试剂空白实验,同时采用样品加标计算回收率。
蒸煮水样品直接经0.22 μm 水相滤膜过滤后进行HPLC-ICP-MS 分析。
1.3.5 测定方法
1.3.5.1 总砷含量测定
使用1.0 μg·L-1Ce、Co、Li、Tl、Y 的调谐液在线优化ICP-MS 各项参数,使分辨率和灵敏度等各项仪器性能达到最佳。总砷含量测定时采用1.0 μg·mL-1103Rh 溶液在线加入内标,用于校正仪器响应信号的变化。优化后ICP-MS 的主要参数见表2。将砷元素标准曲线系列溶液从低浓度到高浓度依次于ICP-MS 中进样,测定相应的信号值。以标准溶液浓度为横坐标,相应的信号值(CPS 计数)为纵坐标,仪器自动绘制标准曲线,样品浓度与相应信号强度成正比。采用外标法定量分别测定总砷含量。

表2 ICP-MS 主要参数Tab.2 The major parameters of ICP-MS
同时用大虾粉(GBW10023)和紫菜粉(GBW10050)生物成分分析标准物质验证样品总砷含量测定方法的准确性。两种标准物质的标准值、测定值和RSD 值见表3。由表3 可知,2 种质控样品总砷含量测定值都在标准值范围内说明该方法准确度高、精密度好。

表3 质控样品总砷含量水平的测定(n=8)Tab.3 Determination of total arsenic levels in quality control samples(n=8)
1.3.5.2 砷形态的测定
色谱条件:Dionex IonPac As19 阴离子交换柱(250 mm×4 mm×10 μm)及保护柱(50 mm×4 mm);进样量50 μL;样品室温度10 ℃,柱温40 ℃;流动相为50 mmol·L-1、pH=9.5 的碳酸铵溶液;等度洗脱;流速1.0 ml·min-1。
质谱条件:采用具有同心雾化器的电感耦合等离子体质谱仪;选择元素75As;m/z 75;采集模式:TRA模式;As 积分时间:0.3 s;蠕动泵转速:0.5 r·s-1
砷形态测定方法的准确度用BCR-627 金枪鱼组织中砷形态标准物质来验证。准确称量BCR-627 金枪鱼组织中砷形态标准物质0.5 g,其中含砷甜菜碱参考值为3.9±0.225 mg·kg-1,二甲基砷含量参考值0.15±0.022 5 mg·kg-1。按照本实验方法进行的6 次平行测定结果为:砷甜菜碱含量范围为3.794~4.056 mg·kg-1,二甲基砷测定值范围0.132 8~0.167 4 mg·kg-1,相对偏差分别为4.2%和4.6%,均在参考值范围内,说明本方法测定结果准确度高。
2 结果与讨论
2.1 用ICP-MS 测定样品中的总砷
通过ICP-MS 分别测定未经加工的贻贝和梭子蟹样品原料样品、二者煮熟样品、蒸煮水和胃肠模拟消化液处理样品的总砷含量。未经加工的原始样品中贻贝含砷量为11.36±1.8 mg·kg-1,梭子蟹总砷含量为78.97±3.7 mg·kg-1;煮熟样品中贻贝的砷含量为10.47±0.3 mg·kg-1,梭子蟹的砷含量为73.37±1.4 mg·kg-1(考虑到烹饪过程中的质量损失,结果表示均以干重计)。对贻贝和梭子蟹的蒸煮水中总砷含量测定值分别为1.56±0.11 mg·kg-1和4.81±0.6 mg·kg-1。结果表明在蒸煮加热过程中,贻贝样品中13.7%±1.62%的总砷量和梭子蟹样品中6.1%±0.92%的总砷量从样品中转移至蒸煮水中。在静态体外胃肠模拟消化实验中,获得的贻贝透析样品总砷含量为0.24±0.06 mg·kg-1,梭子蟹透析样品总砷含量为2.59±0.13 mg·kg-1。该结果表明煮熟的贻贝样品中大约2.3%±0.47%的总砷量是可以经过透析袋,煮熟的梭子蟹样品中大约3.5%±0.75%的总砷量可透析。
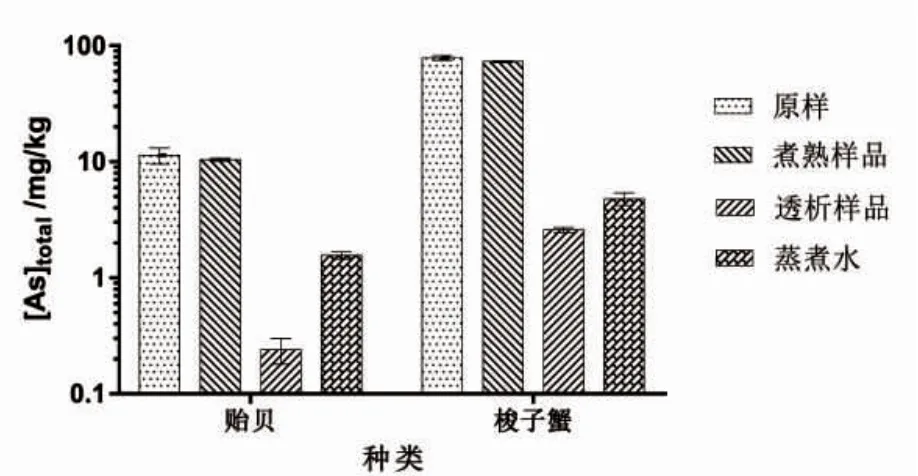
图1 贻贝和梭子蟹原样、煮熟样品、蒸煮液和模拟体外胃肠消化后获得的透析样品中总砷测定Fig.1 Total arsenic contents of mussels and crab in raw materials,cooked samples,cooking fluids and dialysis after vitro gastrointestinal digestion
2.2 通过阴离子交换HPLC-ICP-MS 分析砷形态
图3 为梭子蟹和贻贝未经加工时的原料样品中的砷形态HPLC-ICP-MS 测定图谱。与5 种砷化合物的标准溶液色谱图(图2)进行对比后,发现梭子蟹原始样品中砷元素存在形态以AsB 为主,含少量DMA;贻贝样品中含有4 种砷化合物,含量大小为AsB>MMA>As(Ⅴ)>DMA。
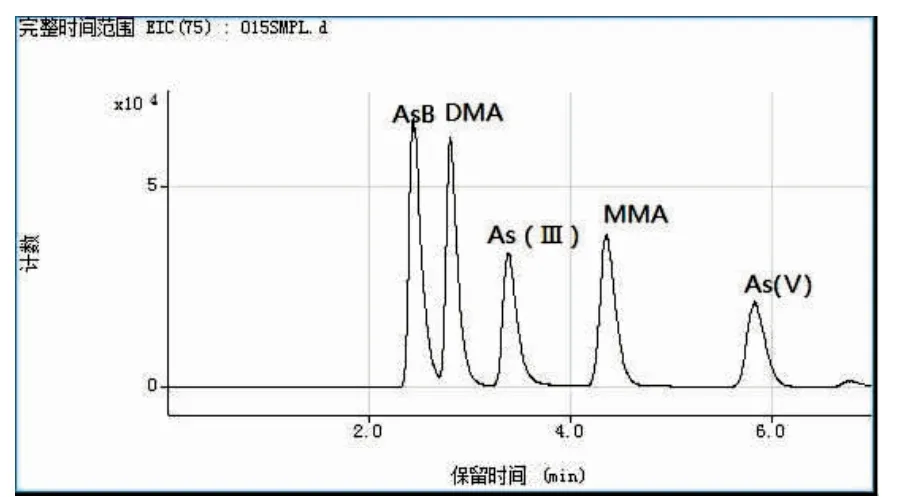
图2 5 种砷形态混合标准溶液色谱图Fig.2 Chromatogram of five arsenic speciation standard solution
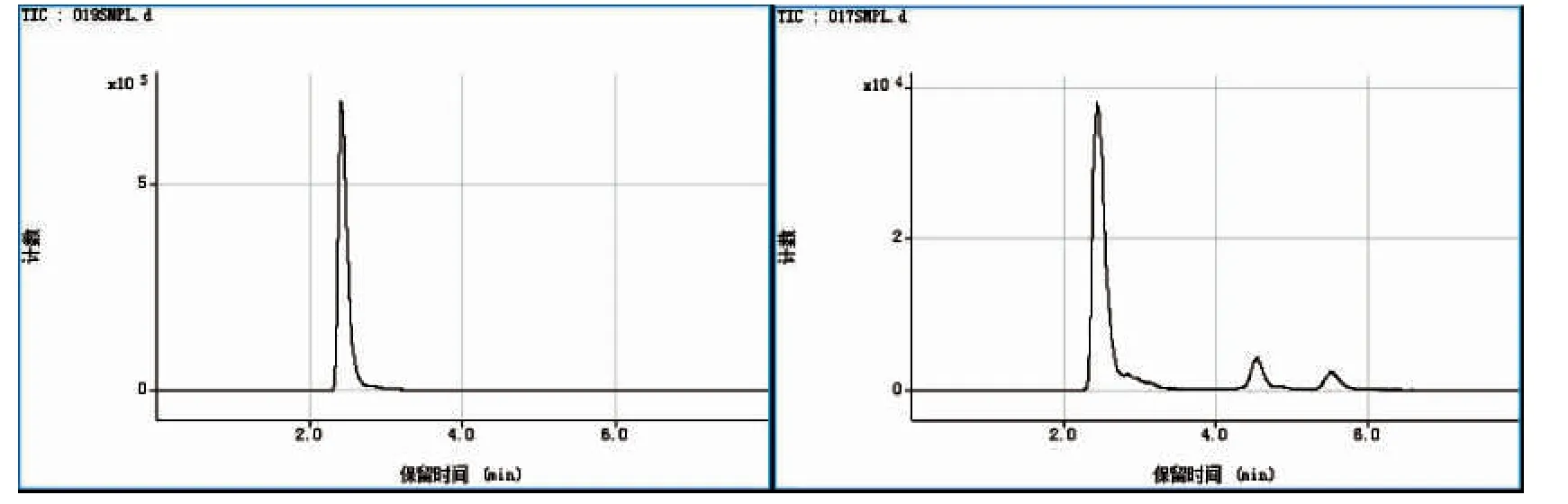
图3 HPLC-ICP-MS 测定梭子蟹原始样品(左)和贻贝原始样品(右)中的砷形态洗脱曲线Fig.3 Elution profiles of As species of mussels and crabs in raw by anion-exchange HPLC-ICP-MS
图4 为梭子蟹和贻贝煮熟样品中砷化合物的HPLC-ICP-MS 测定图谱。从图中发现,贻贝经过蒸煮过程后并未引起砷形态的改变,其砷形态种类与未蒸煮前相同;但梭子蟹蒸煮后,除AsB 外,有微量As(Ⅴ)检出。图3 和图4 比较可以看出,热处理过程几乎不会引起贻贝样品中砷形态的变化,但对梭子蟹产生了较小影响。
图5 显示了两种不同样品进行蒸煮后得到的蒸煮水中砷形态的HPLC-ICP-MS 测定图谱。在蒸煮过程中,砷化合物被释放到蒸煮水中,图4 和图5 比较发现,二者蒸煮水中的砷化合物种类与煮熟样品中发现的相同,以AsB 含量为主。
接着对梭子蟹和贻贝煮熟样品进行体外胃肠模拟消化后获得的透析样品进行砷形态定性研究。图6是透析样品的砷元素HPLC-ICP-MS 测定图谱,结果表明体外胃肠模拟消化过程中没有引起梭子蟹砷形态变化。而在贻贝透析样品中,新出现一未知形态的砷峰。
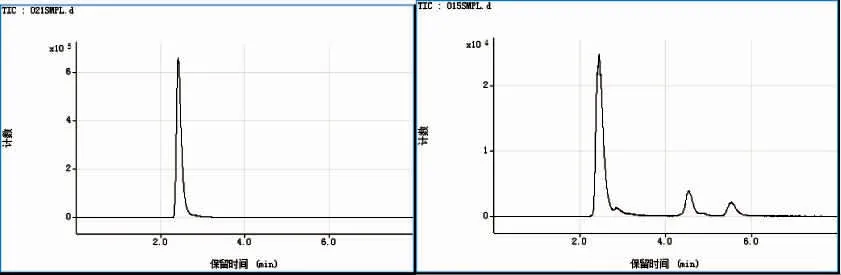
图4 HPLC-ICP-MS 测定梭子蟹(左)和贻贝(右)煮熟样品中的砷形态分布曲线Fig.4 Elution profiles of As species of cooked mussels and crabs by anion-exchange HPLC-ICP-MS
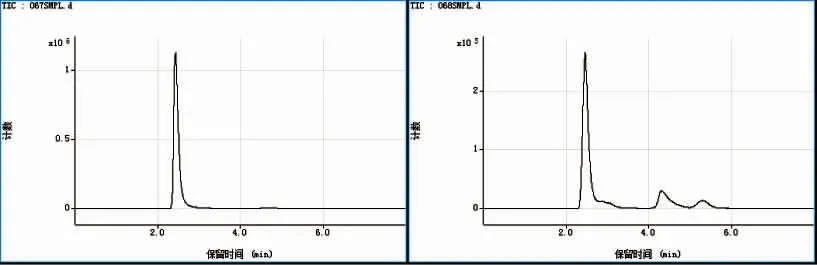
图5 HPLC-ICP-MS 测定梭子蟹(左)和贻贝(右)蒸煮水中的砷形态洗脱曲线Fig.5 Elution profiles of As species in the cooking water of mussels and crabs by anion-exchange HPLC-ICP-MS
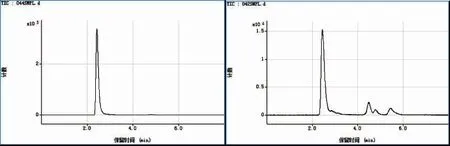
图6 HPLC-ICP-MS 测定梭子蟹(左)和贻贝(右)煮熟样品透析液中砷形态分布曲线Fig.6 Elution profiles of As species in the in-vitro obtained dialysates of cooked mussels and crabs by anion-exchange HPLC-ICP-MS
表4 为梭子蟹和贻贝原始样品、蒸煮样品、蒸煮水以及透析样品中5 种砷化合物的测定色谱峰面积相对百分比情况。结果表明AsB 作为梭子蟹和贻贝中含量最高的砷化合物,经过蒸煮、胃肠模拟消化和透析后,AsB 仍是所有样品中含量最高的砷形态物,其它砷形态物分布占比情况有所差别。AsB 是煮熟贻贝透析液中含量最高的砷形态,但透析液中As(Ⅴ)和MMA 增加了其相对面积百分比,AsB 和DMA 相对百分比减少,这表明在贻贝样品中,DMA 相对As(Ⅴ)和MMA 的溶解性差或者透析性低。梭子蟹中砷化合物也始终以AsB 为主,其面积相对百分比均大于99%。梭子蟹原始样品中有少量的DMA 检出,而在煮熟样品和透析样品中均没有检出DMA,而产生了微量的As(Ⅴ),在梭子蟹蒸煮水中仅检测出AsB。研究结果表明,加热蒸煮、胃肠模拟消化和透析等过程对样品中的砷形态物改变影响不显著。
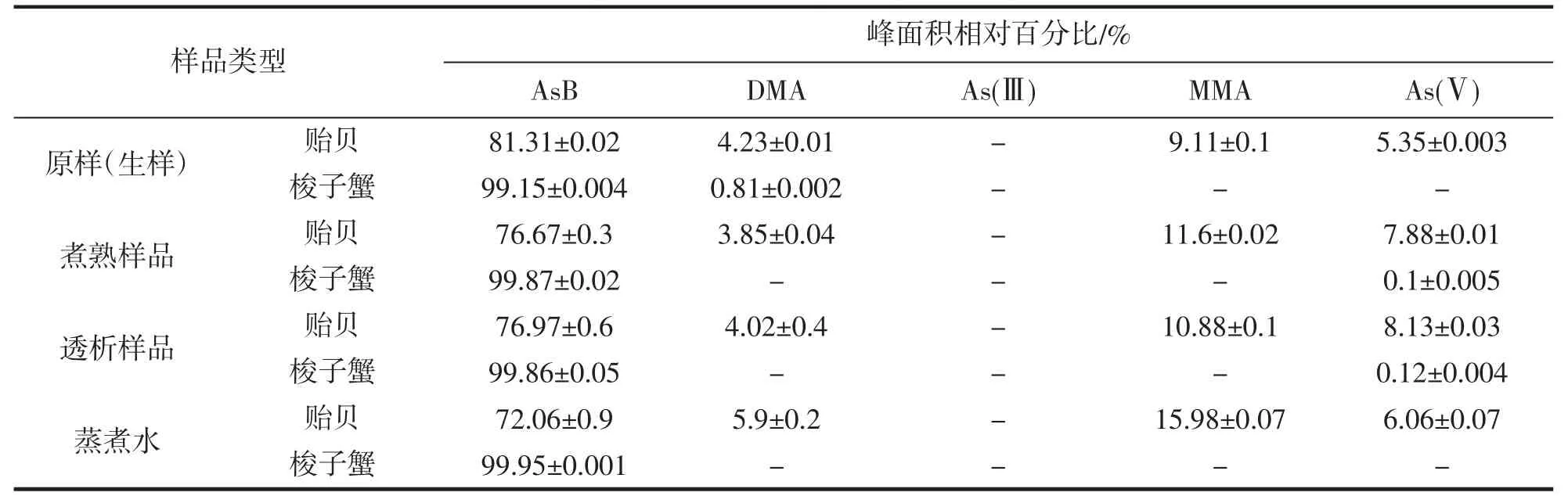
表4 原始样品、煮熟样品、蒸煮水和煮熟样品透析液中砷形态的相对面积百分比(n=8)Tab.4 Relative area percentages of arsenic species in raw samples,cooked samples,cooking water and dialysates of cooking samples(n=8)
3 结论
通过建立静态体外胃肠模拟实验,分别对梭子蟹和贻贝原料样品、蒸煮样品、蒸煮水和蒸煮样品经胃肠模拟消化及透析后的样品中砷形态分布特征进行定量与定性研究。结果显示贻贝样品中13.7%±1.62%的总砷和梭子蟹样品中6.1%±0.92%的总砷量在蒸煮过程中可以从样品基质转移并释放到蒸煮水中;煮熟的贻贝样品经模拟胃肠消化液处理后有2.3%±0.47%的总砷量和煮熟的梭子蟹样品经模拟胃肠消化液处理后有3.5%±0.75%的总砷量可透析并最终可能参与人体循环代谢;定性研究发现,加热蒸煮和胃肠模拟消化等过程对样品中的砷形态物种类及含量影响改变不显著。
