磁性二氧化锰对U(Ⅵ)的吸附性能
2019-06-14张志宾潘素素曹小红刘云海郑智阳王有群
肖 哲,张志宾,潘素素,曹小红,刘云海,郑智阳,王有群
(东华理工大学 核资源与环境国家重点实验室,江西 南昌 330013)
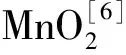
试验采用一锅法制备Fe3O4@MnO2材料,用Zeta电位仪、XRD和FT-IR等表征Fe3O4、MnO2、Fe3O4@MnO2的结构,比较3种材料对U(Ⅵ)的吸附性能,考察不同因素对3种材料吸附U(Ⅵ)的影响,并进一步探讨MnO2、Fe3O4和Fe3O4@MnO2吸附U(Ⅵ)的机制和规律。
1 试验部分
1.1 主要试剂与仪器
主要试剂:HNO3(68%)、NaOH、FeSO4·7H2O,国药化学试剂有限公司;2,4-二硝基苯酚、MnCl2·4H2O,上海三爱司化学试剂有限公司;氯乙酸、KMnO4,成都西亚化工股份有限公司;聚乙烯吡咯烷酮(PVP)、偶氮胂Ⅲ、乙酸钠,上海阿拉丁生化科技股份有限公司。以上试剂均为分析纯,直接使用未纯化。
主要仪器:电子分析天平(BS124S,北京赛多利斯仪器系统有限公司),高温恒温鼓风干燥箱(DGX-8243B,杭州汇尔仪器设备有限公司),pH计(PB-10,上海精密科学仪器有限公司),紫外-可见分光光度计(SP-721E,德国Sartorius公司),卧式真彩触摸屏振荡器(ZW,上海智城仪器公司),XRD(D8 ADVANCE,荷兰FEI公司),红外光谱仪(FTS-65A,美国Bio-RAD公司),Zeta电位仪(Stabino PMX 400,美国Microtrac公司)。
1.2 吸附材料的制备
1.2.1 Fe3O4@MnO2的制备
准确称取0.556 g FeSO4·7H2O和1.000 g PVP于烧杯中,加入20 mL去离子水,搅拌溶解;将0.16 g NaOH溶解于80 mL水中,加热至90 ℃,搅拌;将FeSO4·7H2O和PVP的混合溶液加入到NaOH溶液中,待溶液变为绿色后,加入10 mL 0.2 mol/L KMnO4并搅拌3 h;冷却至室温后,用磁铁分离沉淀物,沉淀物用去离子水和乙醇洗涤后,于80 ℃下真空干燥。产物记为Fe3O4@MnO2。
1.2.2 MnO2的制备
将0.36 g NaOH溶解于80 mL去离子水中,于90 ℃油浴中搅拌;将1.00 g PVP和0.566 g MnCl2·4H2O溶解于20 mL水中,混合均匀后加入到NaOH溶液中;2 min后,加入 9.0 mL 0.2 mol/L KMnO4溶液,搅拌3 h;混合液冷却至室温,离心分离沉淀物,沉淀物用去离子水和乙醇洗涤后,于80 ℃下真空干燥。产物记为MnO2。
1.2.3 Fe3O4的制备
准确称取0.556 g FeSO4·7H2O和1.000 g PVP于烧杯中,加入20 mL去离子水,搅拌溶解;将0.16 g NaOH溶解于80 mL水中,加热至90 ℃,同时搅拌;将FeSO4·7H2O和PVP的混合溶液加入到NaOH溶液中,待溶液变为绿色后继续搅拌3 h,用磁铁分离沉淀,沉淀用去离子水和乙醇洗涤,于80 ℃下真空干燥。产物记为Fe3O4。
1.3 吸附材料的表征
采用Zeta电位仪分析Fe3O4、MnO2和Fe3O4@MnO2在U(Ⅵ)溶液中的电位,采用XRD、FT-IR分析3种材料的物相及官能基团。
1.4 吸附材料对溶液中U(Ⅵ)的吸附
称取0.010 g吸附材料于锥形瓶中,取50 mL料液于锥形瓶中,用0.1 mol/L NaOH和HNO3溶液调节pH,于恒温振荡箱中振荡一段时间后,取少量溶液进行离心,用偶氮胂Ⅲ法[13]测定上清液中U(Ⅵ)质量浓度,根据式(1)计算吸附量(qe):
(1)
式中:ρ0、ρe分别为吸附前、后U(Ⅵ)质量浓度,mg/L;V为含U(Ⅵ)溶液体积,L;m为Fe3O4、Fe3O4@MnO2或MnO2质量,g。
2 试验结果与讨论
2.1 吸附材料的表征
2.1.1 Zeta电位分析
Fe3O4@MnO2、Fe3O4、MnO2的Zeta电位曲线如图1所示。

—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。
由图1看出:溶液pH由2.0升至9.0,Fe3O4表面电位由16.5 mV降至12.3 mV,等电点时的pH为6.0;MnO2和Fe3O4@MnO2的电位也随pH升高而下降,二者等电点时的pH分别为2.3和2.6。这表明MnO2沉积于Fe3O4表面,已成功获得Fe3O4@MnO2复合材料。
2.1.2 XRD分析
Fe3O4@MnO2、Fe3O4、MnO2的XRD图谱如图2所示。可以看出:MnO2衍射峰不明显,表明其为无定形物相;Fe3O4@MnO2的衍射峰与Fe3O4的衍射峰一致,表明Fe3O4@MnO2复合材料是由Fe3O4和无定形MnO2组成。
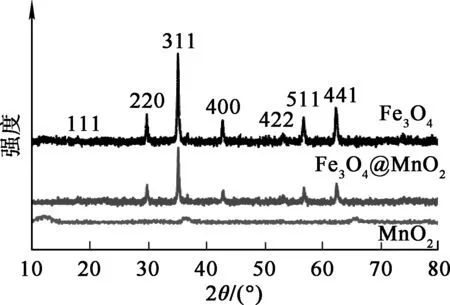
图2 Fe3O4@MnO2、Fe3O4和MnO2的XRD图谱
2.1.3 FT-IR分析
Fe3O4@MnO2、Fe3O4、MnO2的FT-IR图谱如图3所示。可以看出:3种吸附剂均于1 610 cm-1处出现吸附水的O—H弯曲振动峰[13];Fe3O4和Fe3O4@MnO2均于596 cm-1处出现Fe—O特征吸收峰,MnO2于510 cm-1处出现Mn—O吸收伸缩振动峰[13];Fe3O4@MnO2和MnO2均于1 111 cm-1附近出现Mn—OH吸收峰[14]。结果表明,Fe3O4@MnO2复合材料制备成功。

图3 Fe3O4@MnO2、Fe3O4和MnO2的FT-IR图谱
2.2 从溶液中吸附U(Ⅵ)
2.2.1 溶液pH对吸附材料吸附U(Ⅵ)的影响
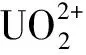
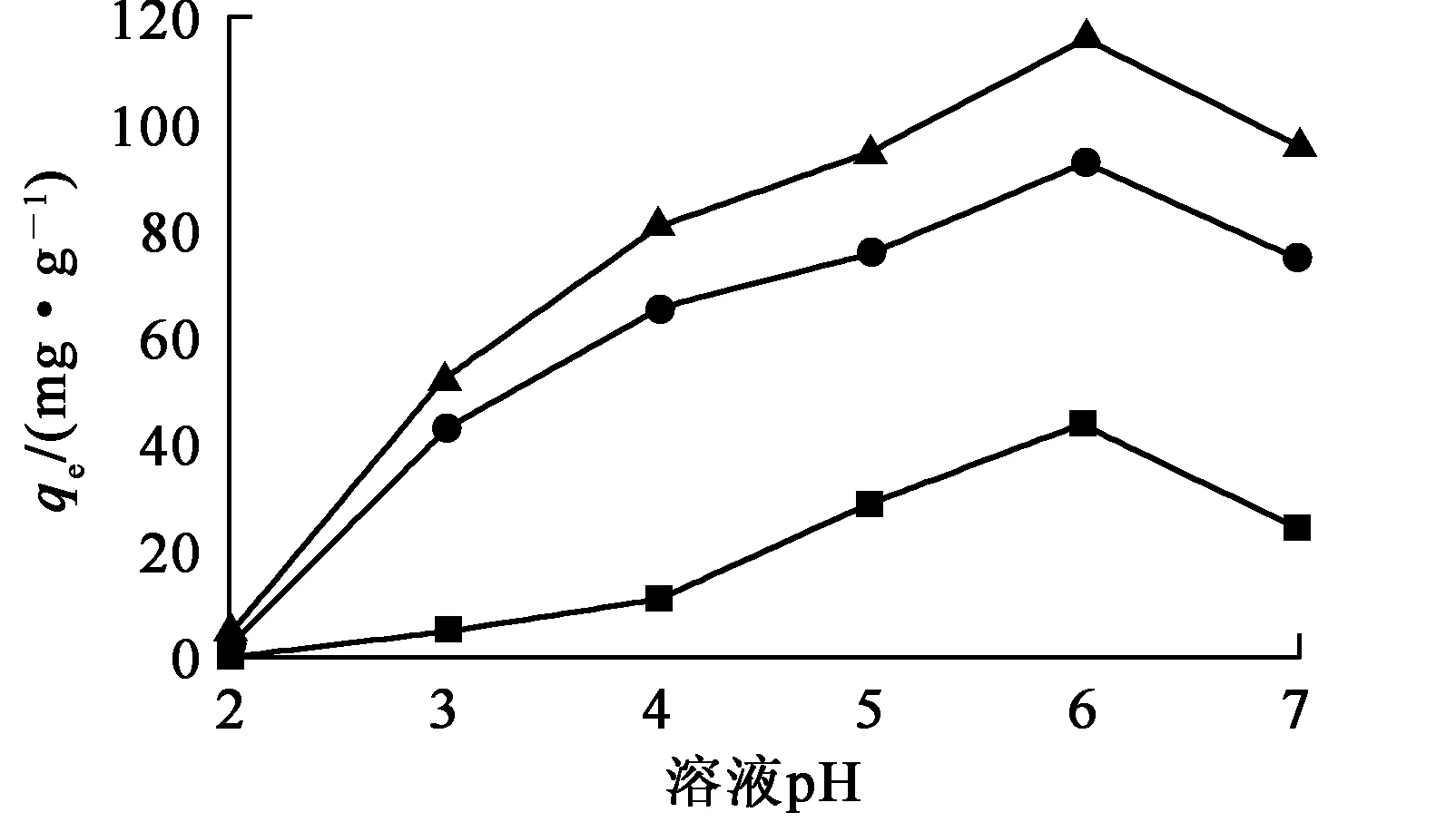
—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。
在无磁场条件下,Fe3O4@MnO2可均匀分散于溶液中;在有磁场条件下,Fe3O4@MnO2能与溶液良好分离。
2.2.2 吸附动力学
在吸附剂质量0.01 g、溶液体积50 mL、吸附前U(Ⅵ)质量浓度50 mg/L、溶液pH=6.0条件下,吸附时间对Fe3O4@MnO2、Fe3O4和MnO2吸附U(Ⅵ)的影响试验结果如图5所示。
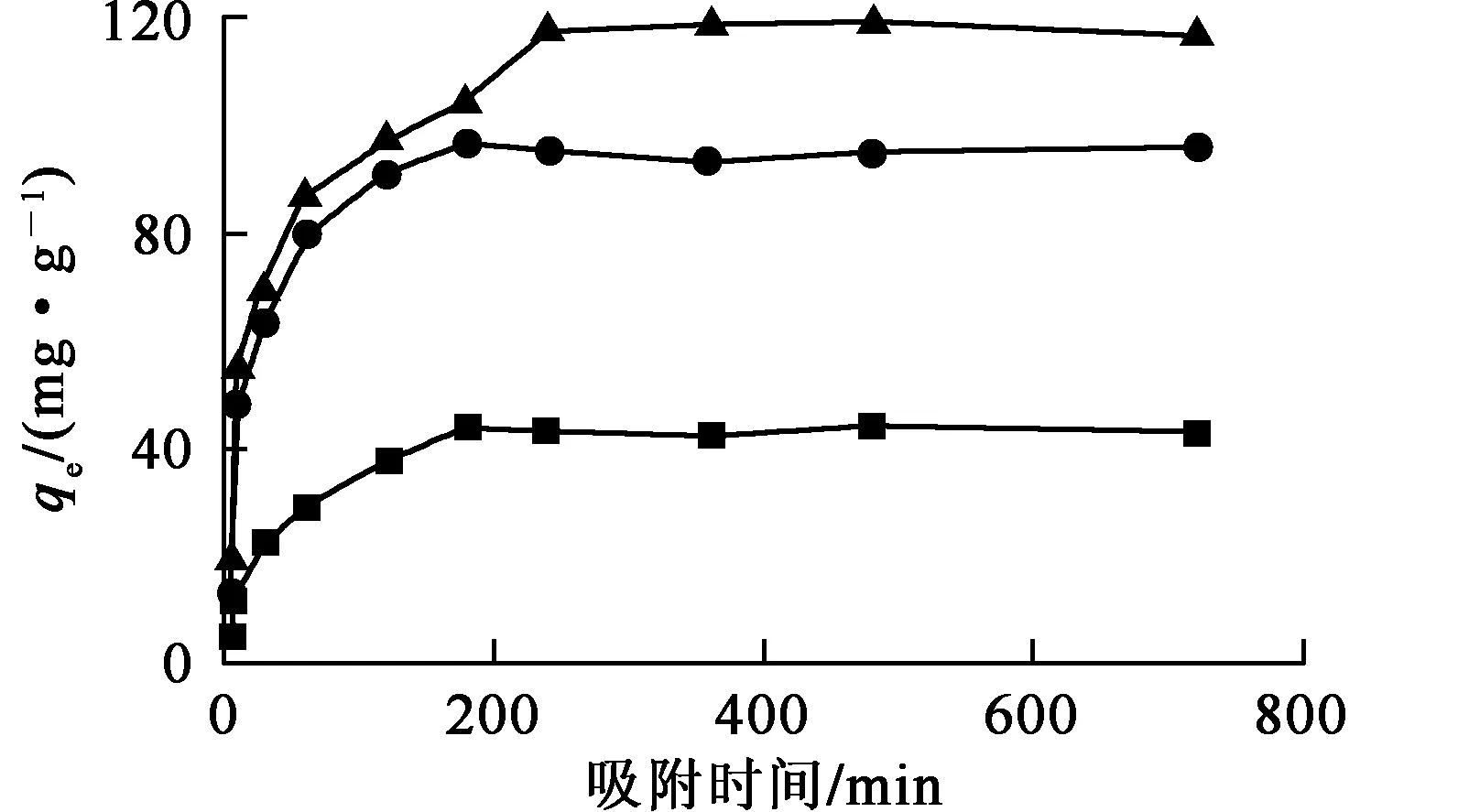
—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。
由图5看出:随吸附时间延长,Fe3O4、MnO2和Fe3O4@MnO2对U(Ⅵ)的吸附量均增大,分别在吸附180、180、240 min后达到平衡。
采用准一级[15]和准二级[16]吸附动力学模型研究Fe3O4@MnO2、Fe3O4和MnO2对U(Ⅵ)的吸附过程,确定吸附速率。
ln(qe-qt)=lnqe-k1t;
(2)
(3)
式中:qt为吸附t时间的吸附量,mg/g;k1为准一级吸附动力学模型的吸附速率常数,min-1;k2为准二级吸附动力学模型的吸附速率常数,g/(mg·min)。
不同吸附剂吸附U(Ⅵ)的准一级、准二级动力学拟合曲线如图6所示。根据拟合曲线斜率与截距计算得到的拟合参数见表1。
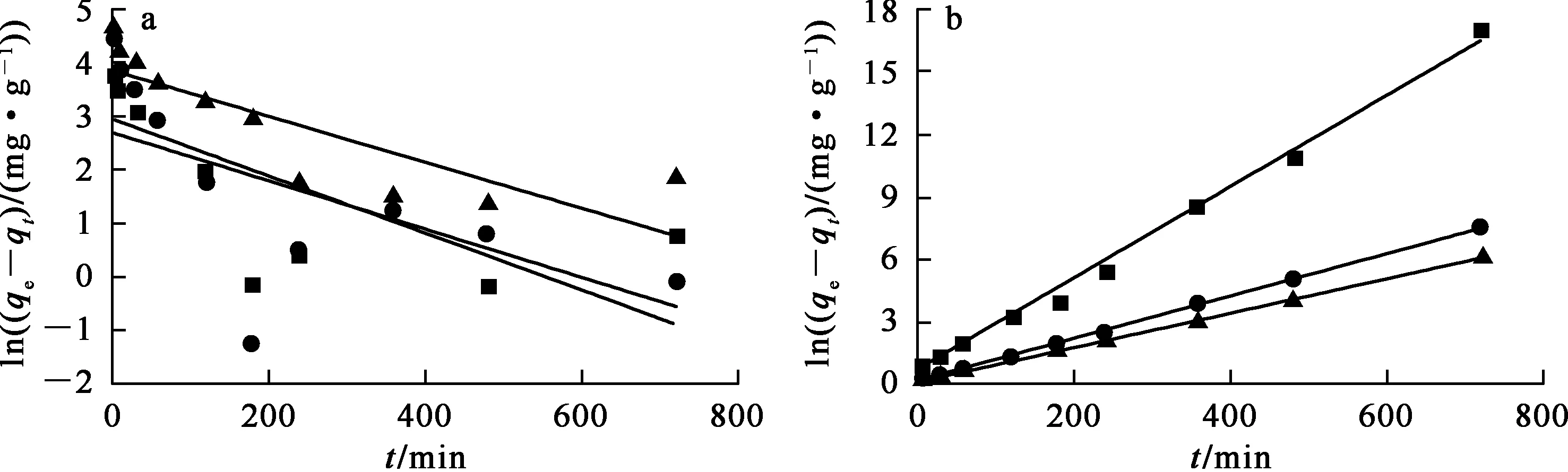
—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。

qe,exp/(mg·g-1)qe,cal/(mg·g-1)k1/(min-1)R2qe,cal/(mg·g-1)k2/(g·mg-1·min-1)R2Fe3O445.5414.730.0040.44545.279.05×10-40.997MnO292.3618.890.0050.38998.237.17×10-40.998Fe3O4@MnO2119.2146.900.0040.651121.953.90×10-40.998
由表1看出:Fe3O4、MnO2、Fe3O4@MnO2的准二级动力学拟合方程的相关系数R2>0.99,明显优于准一级动力学拟合方程的相关系数;准二级动力学方程拟合后得到的理论平衡吸附量qe,cal分别为45.27、98.23、121.95 mg/g,与试验实际平衡吸附量qe,exp(45.54、92.36、119.21 mg/g)接近。结果表明,Fe3O4、MnO2和Fe3O4@MnO2对U(Ⅵ)的吸附过程更符合准二级动力学,即吸附过程主要受化学作用控制。
2.2.3 吸附等温线
在吸附剂质量0.01 g、U(Ⅵ)溶液体积50 mL、吸附前U(Ⅵ)质量浓度50 mg/L、溶液pH=6.0、接触时间240 min条件下,U(Ⅵ)初始质量浓度对Fe3O4、MnO2和Fe3O4@MnO2吸附U(Ⅵ)的影响试验结果如图7所示。
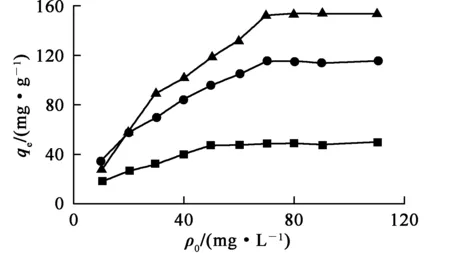
—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。
由图7看出:随U(Ⅵ)初始质量浓度升高,Fe3O4、MnO2和Fe3O4@MnO2对U(Ⅵ)的吸附量均升高然后达到饱和;达到饱和时的质量浓度分别为50、70和70 mg/L。
溶液中金属离子吸附行为用Langmuir和Freundlich等温吸附模型[17]分析。Langmuir等温吸附模型表达式为
(4)
式中:qm为单层饱和吸附量,mg/g;kL为与吸附能量相关的参数,g/mg。
Freundlich等温吸附模型线性表达式为

(5)
式中:kF为Freundlich常数,mg1-1/n·L1/n·g-1;1/n为分均质系数。
将吸附平衡数据代入公式,分别对Langmuir和Freundlich等温吸附模型进行线性拟合,结果如图8所示。根据拟合曲线的截距和斜率求得qm、kL、n、kF,与拟合线性相关系数R2列于表2中。
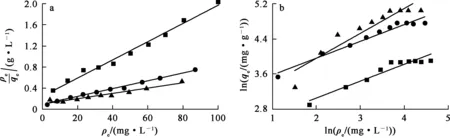
—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。

LangmuirFreundlichkL/(g·mg-1)qm/(mg·g-1)R2kF/(mg1-1/n·L1/n·g-1)nR2Fe3O40.0758.140.9879.752.600.916MnO20.08113.690.99124.322.610.936Fe3O4@MnO20.05204.080.95516.481.750.864
由表2看出,对于Fe3O4@MnO2、Fe3O4和MnO2吸附U(Ⅵ)的数据,Langmuir模型的拟合线性相关系数R2>0.95,而Freundlich模型的拟合线性相关系数R2<0.95。说明3种材料对U(Ⅵ)的吸附更符合Langmuir吸附等温模型,U(Ⅵ)在这3种材料上的吸附均为单分子层吸附,对吸附起主导作用的为表面功能基团与U(Ⅵ)的结合力;3种吸附材料的单层饱和吸附量qm分别为204.08、58.14和113.69 mg/g,说明MnO2与Fe3O4表面复合后提高了MnO2对U(Ⅵ)的吸附量,这是因为Fe3O4不仅可起磁性分离作用,同时也起分散作用,从而增大了MnO2的比表面积,使吸附量提高。
2.2.4 吸附热力学
在吸附剂质量0.01 g、U(Ⅵ)溶液体积50 mL、吸附前U(Ⅵ)质量浓度50 mg/L、溶液pH=6.0、接触时间240 min条件下,溶液温度由288 K升至318 K时,Fe3O4@MnO2、Fe3O4和MnO2对U(Ⅵ)的吸附试验结果如图9所示。
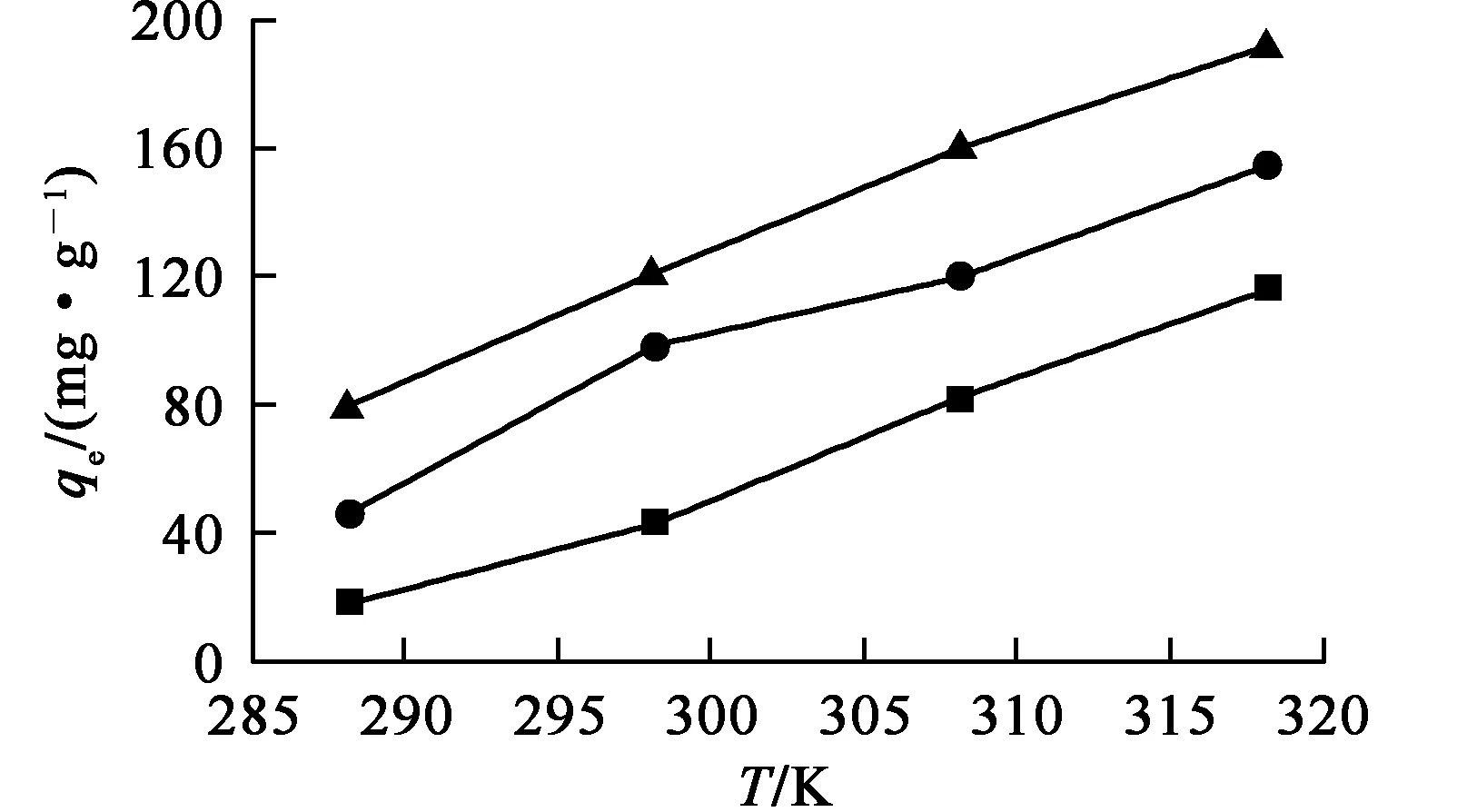
—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。
由图9看出,随溶液温度升高,Fe3O4、MnO2和Fe3O4@MnO2对U(Ⅵ)的吸附量均提高,表明3种材料在U(Ⅵ)的吸附过程中均吸热。
吸附反应的吉布斯自由能变(ΔG)、焓变(ΔH)、熵变(ΔS)[18]与分配系数kd之间的关系如下:
(6)
(7)
式中:R,气体摩尔常数,8.314 J/(K·mol);T,热力学温度,K。
吸附剂质量0.01 g,U(Ⅵ)溶液体积50 mL,吸附前U(Ⅵ)质量浓度50 mg/L,溶液pH=6.0,接触时间240 min。以lnkd为纵坐标,1/T为横坐标,绘制Fe3O4@MnO2、Fe3O4和MnO2吸附U(Ⅵ)的热力学曲线,结果如图10所示。由拟合曲线的斜率和截距分别得到ΔH和ΔS,不同温度下的ΔG由式(8)计算,结果见表3。
ΔG=ΔH-TΔS。
(8)

—■—Fe3O4;—●—MnO2;—▲—Fe3O4@MnO2。
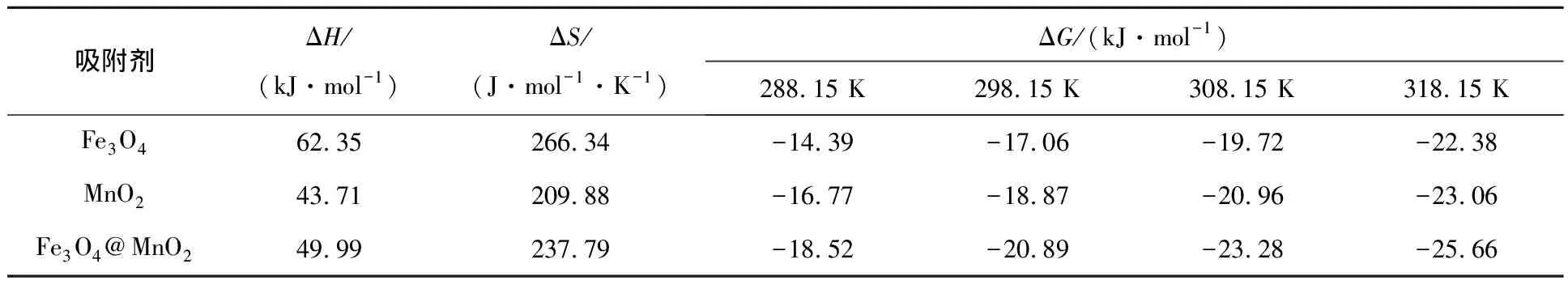
表3 Fe3O4@MnO2、Fe3O4和MnO2吸附U(Ⅵ)的热力学参数
由表3看出:ΔH>0,ΔG<0,这进一步表明,Fe3O4、MnO2和Fe3O4@MnO2吸附U(Ⅵ)的过程为自发吸热过程;ΔS>0,表明3种吸附剂吸附U(Ⅵ)均为表面混乱度增加过程;随温度升高,3种吸附剂的ΔG升高,绝对值增大,表明升温可促进3种材料对U(Ⅵ)的吸附。此外,相同温度条件下,Fe3O4@MnO2的ΔG绝对值大于Fe3O4和MnO2的ΔG绝对值,说明Fe3O4@MnO2对U(Ⅵ)的吸附性能更强。
3 结论
采用沉淀法可制备吸附材料Fe3O4@MnO2,Fe3O4@MnO2可用于从溶液中吸附U(Ⅵ),在溶液pH=6.0时,其对U(Ⅵ)的吸附量达最大,吸附过程符合Langmuir等温吸附模型。Fe3O4@MnO2的单分子层饱和吸附量为204.08 mg/g,明显高于Fe3O4和MnO2单分子层饱和吸附量,说明MnO2与Fe3O4的表面复合使MnO2对U(Ⅵ)的吸附量显著提高,这是由于Fe3O4既提供磁性分离作用,又起到分散MnO2作用,增大了MnO2比表面积,从而提高了MnO2吸附量。Fe3O4@MnO2对U(Ⅵ)的吸附过程符合准二级动力学模型,吸附反应主要受化学作用控制;Fe3O4、MnO2和Fe3O4@MnO2对U(Ⅵ)的吸附为自发吸热过程。Fe3O4@MnO2可用以分离回收废水中的铀。
