小麦食源性过敏原致敏亚基分析
2019-06-14姚亚亚刘阳星月李宇凡苗字叶李慧静
姚亚亚 刘阳星月 李宇凡 苗字叶 刘 壮 李慧静
(河北农业大学食品科技学院1,保定 071001) (北京食品营养与人类健康高精尖创新中心;北京工商大学2,北京 100048)
小麦过敏主要是指由小麦致敏蛋白引起的Ⅰ型超敏反应[1,2]。在研究小麦蛋白致敏机理、检测方法的建立以及脱敏方法筛选中,关键是了解小麦过敏原。小麦蛋白种类繁多,其中小麦致敏蛋白占大部分,根据世界卫生组织和国际免疫学会联合会(WHO/IUIS)过敏原命名小组委员,截止到2016年11月29日已批准13种食源性小麦过敏原[3],包括抑制蛋白、非特异性脂转换蛋白、同工麦胚凝集素、ω5-醇溶蛋白、α淀粉酶CM17、硫氧还蛋白、高分子量麦谷蛋白、低分子质量谷蛋白G1uB3-23、Y-醇溶蛋白、α-嘌呤硫素、线粒体NFKB1的泛素连接酶原激活剂、假定小麦蛋白、胚乳传递细胞特异性PR60前体、延伸因子1,其致敏亚基分子质量分布为9.5、12、13、16、17、20、26、27、32~38、39.5、65、83、88 ku的蛋白[4,5]。
目前,国外对小麦过敏原的鉴定开展了大量的研究。Sander等[6]以10名小麦致敏面包师患者血清为样本,其检测出IgE的主要结合蛋白亚基分子量为40、42、26 ku的蛋白。Weiss等[7]通过SDS-PAGE和免疫印迹证明20名对小麦粉过敏患者的血清含有与70、55、35、26~28、14~18 ku区域中的许多白蛋白/球蛋白多肽结合的IgE抗体。Venter等[8]在对小麦致敏的37名儿童检测中,3名(8.1%)对ω5-醇溶蛋白敏感,1名(2.7%)对小麦脂质转移蛋白敏感,1名(2.7%)对麦小麦醇溶蛋白敏感。Nilsson等[9]对63名被医生诊断为患有小麦过敏症的儿童进行致敏组分分析,其中ω-5麦醇溶蛋白,低分子量谷蛋白(LMW-glutenin)和高分子量谷蛋白(HMW-glutenin)以及天然麦醇溶蛋白四种小麦蛋白组分的免疫球蛋白E抗体(IgE-ab)水平显著较高(P<0.000 1)。
我国对小麦过敏原的鉴定方面鲜有报道,对引起我国小麦过敏患者过敏的主要过敏原致敏概率的研究还处于起步阶段。朱奕锜等[10]通过检测分析10例患有WDEIA的小麦过敏患者,结果显示患者对3-磷酸甘油醛脱氢酶过敏,对三聚淀粉酶抑制剂、ω-5醇溶和磷酸丙糖异构酶等蛋白敏感。冼静雯等[11]通过分离小麦过敏原和免疫印迹方法对小麦过敏原免疫学特性进行了鉴定,结果表明23 ku蛋白为主要的小麦过敏原。
师栾02-1小麦作为小麦主产区主要品种,且其等级达到国标一等,具有良好的烘焙等加工品质[12],因此,本实验选择师栾02-1小麦品种做过敏原分析。以我国12例小麦过敏患者的血清为探针,3例正常人的血清池为对照,与师栾02-1小麦粉进行电泳免疫印迹分析鉴定,引起我国小麦过敏人群过敏的小麦过敏原及其致敏概率,以期发现新的小麦过敏原,为后期建立适合引起我国小麦过敏人群过敏的主要过敏原检测技术提供参考。
1 材料与方法
1.1 材料和试剂
师栾02-1小麦(蛋白质量分数为14.93%),精细加工成小麦粉;小麦过敏患者血清由中国解放军白求恩国际和平医院和北京军区总医院提供;小麦正常者血清由河北农业大学校医院提供;丙烯酰胺(Acr);甲叉丙烯酰胺(Bis);过硫酸铵(AP);十二烷基磺酸钠(SDS);四甲基乙二胺(TEMED);巯基乙醇;三羟甲基氨基甲烷(Tris);考马斯亮蓝(R-250);牛血清白蛋白(BSA);标准蛋白;34079型ECL试剂盒;聚偏氟乙烯(PVDF)膜;其余试剂均为分析纯。
1.2 仪器和设备
ImmunoCAP 250全自动体外免疫检测系统;ZNCL-S140X140磁力搅拌器;PHS-3C型PH计;DYCZ-28A型单板夹芯式垂直电泳仪;Multiskan FC型酶标仪;凝胶成像仪。
1.3 实验方法
1.3.1 样品制备
采用正己烷脱脂,小麦粉与正己烷按照1∶2的质量体积比例混合,在密闭容器中用搅拌器搅拌4 h后静置0.5 h,然后将上层黄色液体倒出,之后再按小麦粉∶正己烷1∶2加正己烷,搅拌2 h后静置0.5 h,倒出上层黄色液体,重复操作,直到上层液呈无色为止。放置于通风橱干燥。将去脂小麦粉样品按照1∶20的质量体积比例加入样品缓冲液,提取24 h,于室温下4 000×g离心20 min,留其上清液,舍弃沉淀,再在10 000×g室温下离心15 min去除残存的脂肪和不溶性微粒。采用Bradford法测定上清液蛋白质浓度,并将在-20 ℃下储存备用。
1.3.2 不连续聚丙烯酰胺凝胶电泳(SDS-PAGE)
采用不连续SDS-PAGE垂直电泳,分离胶质量分数为12%,浓缩胶质量分数为5%。将所制备样品于室温下融化,沸水浴加热5 min,样品上样量为10 μg,电压待样品进入分离胶时,将电压调至160 V,待染料前沿迁移至橡胶框底边1 cm处,停止电泳。取下凝胶,将凝胶于固定液中固定2 h,倾去固定液,置于考马斯亮蓝(R-250)染色液染色2~5 h,倾去染色液,加入脱色液,几小时更换一次脱色液,直到凝胶的蓝色背景完全褪去,蛋白质的电泳条带清晰为止。量出溴酚蓝区带中心距加样端的距离(cm)和各蛋白质样品区带中心与加样端的距离(cm),计算蛋白质样品相对迁移率(mR)。
标准曲线为:
y=-0.717 4x+1.368 6,R2=0.997 5。
1.3.3 小麦过敏患者血清中小麦特异性IgE(sIgE)的测定
ImmunoCap 250全自动体外免疫检测系统测定小麦过敏患者血清中小麦特异性免疫蛋白,判定标准如表1,小麦过敏患者血清在-80 ℃冻存,使用前复融。
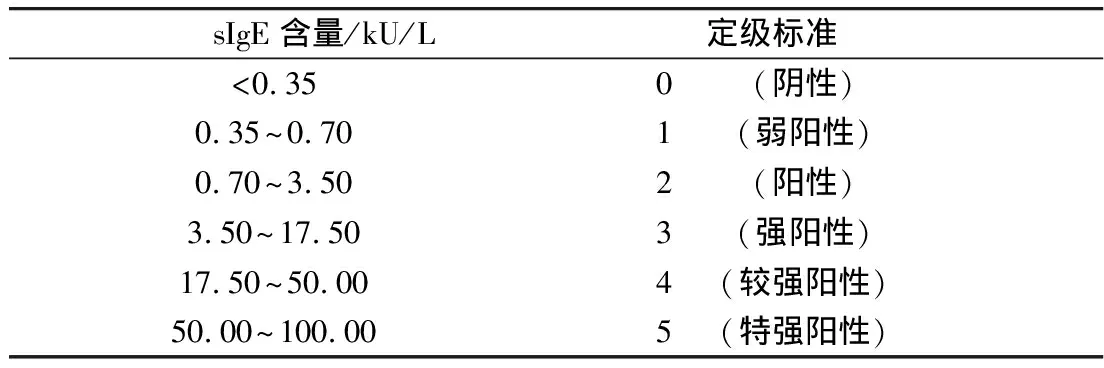
表1 国际上sIgE含量过敏定级标准
1.3.4 小麦非过敏患者与小麦粉的免疫印迹(Western-Blotting)
以3例正常人的血清和血清池为样本,采用免疫印迹技术进行免疫学特性分析鉴定小麦粉中存在的小麦非过敏原。首先采用不连续SDS-PAGE垂直电泳,分离胶浓度为12%,浓缩胶浓度为5%,进行电泳,电泳后再将胶放入电转液浸泡30 min,电转时,按照垫片、滤纸、PVDF膜、胶、滤纸、垫片的顺序组装在一起,将蛋白转移至PVDF膜;将PVDF膜放置于30%BSA中封闭60 min;之后进行洗膜,用1×TBST溶液洗涤5次,每次3 min;用3%BSA将血清按照1∶400的比例进行稀释,加入血清,37 ℃孵育2 h;同上洗膜,用1×TBST溶液洗涤5次,每次3 min;再加入用3%BSA将血清按照1∶5 000的比例进行稀释的二抗,置于摇床上37 ℃孵育1 h,同上洗膜5次后将ECL试剂盒中A液和B液按照1∶1比例混合取1 mL置于PVDF膜上;显影、定影后摄像分析相对分子质量。
1.3.5 小麦过敏患者与小麦粉的免疫印迹(Western blotting)
世界卫生组织和国际免疫学会联合会(WHO/IUIS)过敏原命名小组委员要求能够加入过敏原的官方列表标准为至少需要5例过敏患者血清[3]。采用免疫印迹技术对12例小麦过敏患者血清与小麦粉蛋白进行免疫学特性分析鉴定小麦粉中存在的小麦过敏原。其余步骤同1.3.4。
2 结果与分析
2.1 小麦粉SDS-PAGE
小麦粉SDS-PAGE图谱(图1)结果表明小麦粉含有丰富的蛋白亚基,其主要亚基分子量分布为117、97、83、72、69、64、62、58、54、43、40、37、27、26、25、21、20、19、18、17、16、15、14、13、12 ku,其条带的深浅代表亚基含量的高低。Akagawa等[13]利用SDS-PAGE分析了小麦粉中的全蛋白亚基分布,其亚基分布与本实验结果一致。小麦粉中蛋白含量丰富,是人们获取蛋白营养物质的主要来源,但其蛋白可能为潜在的过敏原,对小麦过敏患者产生健康危害。因此,明确具体的过敏原,鉴定致敏概率是为建立适合引起我国小麦过敏人群过敏的主要过敏原检测技术提供参考。
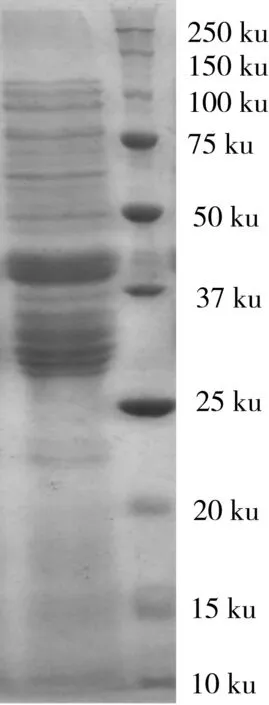
图1 小麦粉SDS-PAGE图谱
2.2 小麦过敏患者sIgE水平
由表2可知,在12例小麦过敏患者中,大部分患者属于阳性等级,占91.7%,弱阳性占8.3%。朱奕锜等[10]针对10名患有小麦依赖-运动诱发过敏反应(WDEIA)进行小麦过敏原sIgE检测,检测结果显示,50%患者为阳性,10%为强阳性,30%为弱阳性,与本结果几乎一致。尹佳等[14]测定了15例WDEIA患者的sIgE,结果同样表明大部分患者为阳性等级,其比例达到86.7%。Lee等[15]通过ImmunoCAP分析了6例小麦过敏患者血清sIgE,结果表明6例患者中33.3%属弱阳性范围,66.7%属阳性等级。与本结果基本一致,因此本实验所选择的12例血清具有代表性,可进行进一步分析。

表2 小麦过敏患者sIgE水平
2.3 小麦粉非过敏患者血清免疫印迹图谱分析
由于过敏原的识别存在非特异性吸附造成结果为假阳性,尽管在实验过程中加入牛血清白蛋白作为封闭液消除,但人的血清样本中会存在一些非特异性干扰物质,从而影响实验结果[16,17]。因此,首先要排除过敏原假阳性结果,为后期过敏患者血清免疫印迹结果的可靠性,选择3例非过敏患者血清的血清池作为阴性对照,由图2可知,3例正常血清池免疫结果表明分子量49、42、39 ku亚基为非过敏原。

图2 小麦粉与小麦非过敏患者血清池反应的免疫印迹图
2.4 小麦粉过敏患者血清免疫印迹图谱分析

注:1~10分别为10、15、25、35、40、55、70、100、130、170 ku。图3 小麦粉与小麦过敏患者血清反应的免疫印迹图
以我国12例小麦过敏患者的血清和血清池样本为探针,3例正常人的血清和血清池样本为对照,进行小麦过敏者血清与还原态一维电泳分离的小麦粉的免疫印迹反应,结果如图3所示。结果表明引起我国小麦过敏患者过敏的小麦过敏原包括288、230、207、193、188、166、156、135、134、125、118、113、112、109、106、103、101、100、94、83、81、79、75、73、72、69、68、67、66、63、62、60、58、57、56、54、52、50、49、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10 ku等亚基;这些亚基致敏概率自高至低依次为17 ku(6/12)、28 ku(6/12)、14 ku(5/12)、19 ku(5/12)、22 ku(5/12)、24 ku(5/12)、25 ku(5/12)、26 ku(5/12)、11 ku(4/12)、12 ku(4/12)、16 ku(4/12)、21 ku(4/12)、27 ku(4/12)、18 ku(3/12)、30 ku(3/12)、31 ku(3/12)、36 ku(3/12)、47 ku(3/12)、83 ku(3/12),其他亚基致敏概率为1/6或1/12。
用12种不同血清获得的IgE免疫印迹在识别的过敏原中显示显著的差异性,每名小麦粉患者表现出不同过敏原斑点的个体敏化模式(表3)。对于大多数过敏原来源,针对不同个体建立的IgE结合模式在常见或主要过敏原存在的基础上非常相似,偶尔存在罕见或次要过敏原,抗体应答的个体差异可能是由于患者的倾向或单变应原的可变暴露水平[18]。Sander等[6]以10名小麦致敏面包师患者血清,通过二维电泳免疫印迹分析,结果显示,10种不同血清获得的IgE免疫印迹呈现显著的差异性,每位患者都显示出一种单独的IgE结合模式,其中有4至50种不同的过敏原斑点,总共检测到100多种IgE结合蛋白斑点,其检测出IgE的主要结合蛋白亚基分子量为40、42、26 ku的蛋白,与本实验所鉴定42 kD为非特异性免疫蛋白存在差异,此差异可能源于不同个体人群免疫水平的差异。Weiss等[7]通过SDS-PAGE和免疫印迹证明20名对小麦粉过敏患者的血清含有与70、55、35、26~28、14~18ku区域中的许多白蛋白/球蛋白多肽结合的IgE抗体,本实验结果除了70、55 ku,其余致敏亚基与本实验结果一致,该差异可能由于所用血清样本及所选小麦品种不同。

表3 小麦粉与小麦过敏者血清的免疫印迹图致敏亚基分子质量分析结果/ku
注:每列序号与免疫印迹图3序号一致。
3 结论
以我国12例小麦过敏患者的血清为探针,3例正常人的血清池为对照,与师栾02-1小麦粉进行还原态一维电泳免疫印迹分析鉴定引起我国小麦过敏人群过敏的小麦过敏原及其致敏概率。鉴定结果表明,小麦过敏原蛋白亚基的致敏概率自高至低的顺序依次为17 ku(6/12)、28 ku(6/12)、14 ku(5/12)、19 ku(5/12)、22 ku(5/12)、24 ku(5/12)、25 ku(5/12)、26 ku(5/12)、11 ku(4/12)、12 ku(4/12)、16 ku(4/12)、21 ku(4/12)、27 ku(4/12)、18 ku(3/12)、30 ku(3/12)、31 ku(3/12)、36 ku(3/12)、47 ku(3/12)、83 ku(3/12),其他亚基致敏概率为1/6或1/12。
目前,市场上过敏原检测试剂盒主要为进口试剂盒,国内公司试剂盒的研制大多是基于引起外国人群过敏的小麦过敏原进行开发。然而,本研究结果表明不同人群过敏原分布差距较大,故急需开发适合我国小麦过敏人群得检测方法。本研究为建立适合引起我国小麦过敏人群过敏的主要过敏原检测方法提供了借鉴。
