山茶油抑菌性能和机理的研究
2019-06-14李桥妹黎冬明洪艳平郑国栋
李桥妹 黎冬明 洪艳平 郑国栋
(江西农业大学食品科学与工程学院;江西省天然产物与功能食品重点实验室,南昌 330045)
山茶油属于山茶科油茶树种子的提取物,是我国唯一能与西方橄榄油相媲美的高含油酸的特种油脂,被誉为“东方的橄榄油”[1]。山茶油具有良好的保健功能,不饱和脂肪酸可以有效预防冠心病、高血压等心血管疾病,活性物质、山茶皂素、茶多酚等分别具有强心、溶血栓及降低胆固醇等作用,甾醇、生育酚、角鳖烯等能增强兔疫功能,提高人体抗病能力,延缓人体衰老[2]。
山茶油在临床应用上具有较好的消炎作用,它不仅能解决幼儿因尿布引起的湿疹等皮肤疾病,也能用于皮肤轻度烧伤、烫伤等,具有很好的治疗效果[3]。此外,山茶油还具有清热抗炎、抗紫外线、抗菌等功效。
目前对山茶油抑菌机理的研究还鲜见相关报道,蒋艳玲等[4~5]比较了粗制茶油与精制茶油对各种微生物的抑菌效果,研究结果表明,无论粗制还是精制的山茶油在较低体积浓度都可抑制菌体生长,而且抑菌作用受pH和温度的影响较小,在pH4~9之间,茶油具有较好的抑菌效果,其抑菌作用在120 ℃的高温下不受影响,充分说明山茶油抑制微生物的成分具有很高的稳定性。
当前,我国的茶油主要以食用为主,在医疗、食品和化妆领域均有广阔的发展前景[6-8]。从目前对山茶油抑菌效果的研究可知,山茶油具有很好的抑菌作用,但是抑菌机理尚不明确。本研究以大肠杆菌和金黄色葡萄球菌为实验菌,对山茶油的抑菌机理进行探讨,皆在为山茶油的进一步开发应用提供参考。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验材料
山茶油;牛血清白蛋白(BSA);考马斯亮蓝G-2509;丙酮、95%乙醇、85%磷酸、NaCl:AR;大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)。
1.1.2 主要仪器
V-5600型可见分光光度计;DDS-308+型智能电导率仪。
1.2 方法
1.2.1 丙酮的抑菌作用验证
移取10mL培养液于各试管中,加入0.2 mL菌悬液,加入0、0.6、1.2、1.56、1.68、1.74、1.764 mL丙酮,再加入相对应体积的无菌生理盐水,配制成总体积为12 mL的混合液,于37 ℃恒温培养24 h后,测定各试管中OD600值。
1.2.2 山茶油最低抑菌浓度(MIC)的测定
参照吕淑霞等[9]对乳酸链球菌素(Nisin)抑菌作用及其抑菌机理的研究。移取10 mL培养液于试管中,加入0.2 mL菌悬液,加入相对应体积的山茶油和丙酮,使其配制成一系列浓度的总体积为12 mL的混合液:10%、5%、2%、1%、0.5%、0.3%,于37 ℃恒温培养24 h。阳性对照:仅含菌,不含山茶油和丙酮;阴性对照:不加菌悬液,为同一系列浓度的山茶油混合液。测定各试管中OD600值,与阴性对照管OD600值相同的最小山茶油浓度,即为最低抑菌浓度。
1.2.3 山茶油对菌生长曲线的影响
参照吕淑霞等[9]的研究。向培养液中加入菌悬液、山茶油、丙酮,配制成最低抑菌浓度的混合液,于37 ℃恒温培养,以不加山茶油与丙酮为对照组,每隔1 h取样测定OD600值,平行测定3次,取平均值,绘制OD600值随时间而变化的曲线。
1.2.4 碱性磷酸酶含量测定
参照周先汉等[10]对蜂胶提取物抑菌活性及其抑菌机理的研究。向培养液中加入菌悬液、山茶油、丙酮,配制成最低抑菌浓度的混合液,于37 ℃恒温培养,作用0、5、15、30、90、120、180 min后,取样于510 nm下测吸光度,平行测定3次,取平均值,同时做不含山茶油与丙酮的对照,绘制OD510值随时间而变化的曲线[12]。
1.2.5 电导率值测定
参照孙京新等[11]对茶多酚对假单胞菌抑菌机理研究。向培养液中加入菌悬液、山茶油、丙酮,配制成最低抑菌浓度的混合液,于37 ℃恒温培养,作用0、5、15、30、90、120、180 min后,从中移取一小部分,用于电导率的测定,同时测定不含山茶油与丙酮的对照,以时间为横坐标,电导率值为纵坐标,绘制变化曲线。
1.2.6 还原糖含量测定
向培养液中加入菌悬液、山茶油、丙酮,配制成最低抑菌浓度的混合液,于37 ℃恒温培养,作用1、2、3、4、5、6、17 h后,取1 mL待测液于试管中,将1 mL DNS溶液加入其中,在沸水中煮沸5 min后,取出,立即加入8 mL蒸馏水,使其快速降温,于540 nm处测吸光值,平行测定,同时测定不含山茶油与丙酮的对照。根据葡萄糖标准曲线,将OD540值转换成相对应的还原糖含量值,绘制还原糖含量随时间而变化的曲线。
1.2.7 蛋白质含量测定
参照张赟彬等[12]荷叶精油对肉类食品中常见致病菌的抑菌机理研究及赵英永等[13]对考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量的研究进行测定。向培养液中加入菌悬液、山茶油、丙酮,配制成最低抑菌浓度的混合液,于37 ℃恒温培养,用考马斯亮蓝G-250法测定培养液中蛋白质含量,于0、3、6、18、36 h取样,于595 nm处测吸光度,同时设正常组对照[12~13]。根据蛋白质标准曲线,将OD540值转换成相对应的蛋白质含量值,绘制出OD540值随时间变化的曲线。
2 结果与讨论
2.1 丙酮的抑菌作用验证
比较加入一定体积丙酮的混合液吸光值与仅含菌悬液的吸光值,见表1。两者之间相差较小,可得大肠杆菌和金黄色葡萄球菌的生长繁殖受丙酮的影响较小。
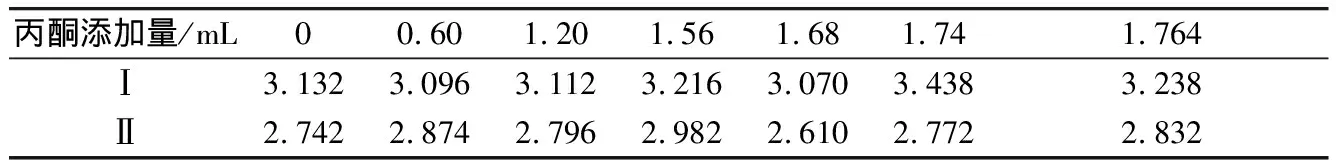
表1 丙酮的抑菌性验证
注:“Ⅰ”代表含大肠杆菌的混合液吸光值,“Ⅱ”代表含金黄色葡萄球菌的混合液吸光值。
2.2 山茶油抑菌性能
2.2.1 山茶油最低抑菌浓度的测定
以金黄色葡萄球菌、大肠杆菌为试验菌,通过测定各试管的OD600值,来判断菌的生长情况。由表2可知,当山茶油浓度为10%、5%、2%、1%、0.5%时,含大肠杆菌的混合液吸光值与未加菌的山茶油混合液吸光值几乎一致,即无菌生长;而当山茶油浓度降为0.3%时,含大肠杆菌的混合液吸光值剧增至1.244,由此可证明0.3%的山茶油浓度已经不能抑制大肠杆菌的生长了,即有菌生长,由此可说明能抑制大肠杆菌的最低山茶油浓度为0.5%,同理可知能抑制金黄色葡萄球菌的最低山茶油浓度为1%,由表3可知:山茶油对大肠杆菌的抑制效果强于金黄色葡萄球菌。

表2 不同浓度OD600值测定
注:Ⅰ代表山茶油混合液吸光值,Ⅱ代表含大肠杆菌的混合液吸光值,Ⅲ代表含金黄色葡萄球菌的混合液吸光值,—代表无此实验。
注:+代表有菌生长,—代表无菌生长,Ⅰ代表大肠杆菌生长情况,Ⅱ代表金黄色葡萄球菌生长情况。
2.2.2 山茶油对细菌生长曲线的影响
细菌的生长曲线可分为4个阶段:延滞期、指数期、稳定期和衰亡期。
由图1可知,不加山茶油与丙酮的对照组,其生长曲线呈较典型的“S”型;而实验组的生长曲线则发生明显变化,由此可知,山茶油在延滞期便对金黄色葡萄球菌和大肠杆菌产生作用,从而抑制细菌的繁殖,使其生长曲线呈现为一条平缓线。
由实验组变化率可知,金黄色葡萄球菌实验组变化率更大,抑制效果更弱,从而表明山茶油对G+细菌的抑制效果弱于G-细菌,这可能是因为G+细菌细胞壁厚度大,肽聚糖和磷壁酸的含量多,而G-细菌细胞壁厚度比G+细菌薄,肽聚糖层也很薄,故机械强度较G+细菌弱,山茶油更易对G-细菌起作用,即山茶油对大肠杆菌的抑制效果强于金黄色葡萄球菌。

图1 山茶油对金黄色葡萄球菌与大肠杆菌的生长曲线的影响
2.3 山茶油抑菌机理
2.3.1 山茶油对碱性磷酸酶的影响
在细菌细胞壁与细胞膜的间隙中存在着碱性磷酸酶,它在一般情况下不会外泄,当细菌处于不利条件或受到抑菌剂的作用时,细胞壁通透性便增大,碱性磷酸酶便渗出[10]。通过在510 nm下测定碱性磷酸酶的含量,探究山茶油对大肠杆菌和金黄色葡萄球菌的作用方式。

图2 金黄色葡萄球菌与大肠杆菌的碱性磷酸酶含量变化
由图2可知,碱性磷酸酶含量的初始值不为0,这有可能是因为菌悬液中存在裂解死亡的菌体,从而使碱性磷酸酶外泄,导致初始值不为0;未加山茶油与丙酮的对照组,其碱性磷酸酶含量无明显变化,而加了山茶油与丙酮的实验组,其碱性磷酸酶含量先增加后趋于平缓。由此可证明,山茶油通过改变细胞壁的通透性,致使存在于细胞壁与细胞膜之间的碱性磷酸酶外泄,碱性磷酸酶含量上升;而随着时间的延长,碱性磷酸酶含量变化趋于平缓,这可能是因为山茶油与细菌已作用完全,抑菌效果减弱,故后期碱性磷酸酶含量无明显变化。
实验组变化率可知,大肠杆菌的碱性磷酸酶含量变化率更大,与本研究得出的山茶油对大肠杆菌的抑制效果强于金黄色葡萄球菌的结论相呼应。
2.3.2 山茶油对电导率值的影响
细胞膜是维持细胞内正常渗透压的结构屏障,能选择性地控制细胞内外营养物质和代谢产物的运送,是包围细胞质的最佳“容器”。当细菌受到不利影响时,细胞膜渗透性有所改变,细胞内小分子物质逸出,导致电导率值增大[14]。通过测定电导率的变化,来判断山茶油对细菌细胞膜渗透性的影响。
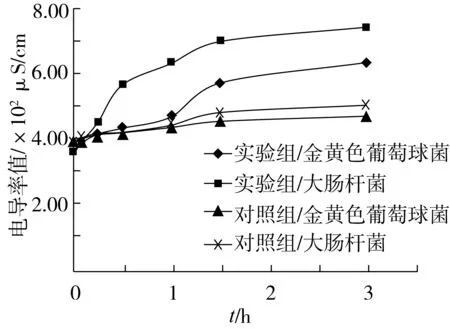
图3 金黄色葡萄球菌与大肠杆菌的电导率值变化
由图3可知,未加山茶油与丙酮的对照组,其电导率值增长趋势较缓,说明对照组的细菌正常生长,细胞膜渗透性良好;而加了山茶油与丙酮的实验组,其电导率值有明显的增大,细胞内容物渗出。由此可说明,山茶油可通过影响细胞膜的渗透性,使细胞内小分子物质逸出,影响细菌的正常生理功能,从而起到抑菌作用。
由实验组电导率的变化值可知,添加了山茶油溶液的大肠杆菌电导率值变化率更大,由此可知,山茶油对大肠杆菌的抑制效果强于金黄色葡萄球菌。
2.3.3 山茶油对还原糖的影响
用葡萄糖标准溶液测定葡萄糖含量-吸光度标准曲线,如图4,其线性方程为y=0.541 8x-0.032 6。
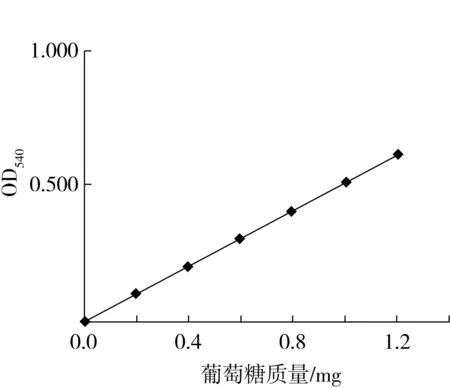
图4 葡萄糖标准曲线
将已测的大肠杆菌混合液及金黄色葡萄球菌混合液的还原糖吸光值通过线性方程进行计算,由此可得还原糖含量随时间的变化曲线,如图5。
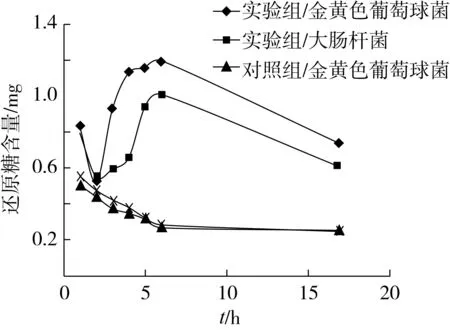
图5 金黄色葡萄球菌与大肠杆菌的还原糖变化曲线
由图5可知,对照组还原糖含量随时间变化趋势为先减小后趋于平稳,这可能是因为培养基中存在还原糖,细菌生长繁殖需要还原糖,因此还原糖含量先降低;而后期趋于平缓则有可能是因为还原糖已基本耗尽,利用率下降,或者是因为细菌已达到衰亡期,利用还原糖能力下降[15]。
实验组还原糖的变化趋势则为先减小后急剧增大最后减小,前期还原糖含量降低有可能是因为山茶油对细菌的作用还未影响细胞膜的完整性,细胞内容物包括糖类未泄出,细菌正常地利用培养基中的还原糖进行生长,因此还原糖含量降低;而后急剧增大则可能是因为山茶油已影响细胞膜的完整性,使细胞内容物泄出,因此还原糖含量增大;最后还原糖含量降低,可能是因为山茶油对细菌的影响已作用完全,存活的细菌继续利用培养基中的还原糖生长繁殖。
2.3.4 山茶油对蛋白质含量的影响
用牛血清白蛋白测定蛋白质含量与吸光度的标准曲线,如图6,其线性方程为y=1.61x+2.420 6。

图6 蛋白质标准曲线
将已测的大肠杆菌混合液及金黄色葡萄球菌混合液的蛋白质吸光值通过线性方程进行计算,由此可得蛋白质含量随时间的变化曲线,如图7。
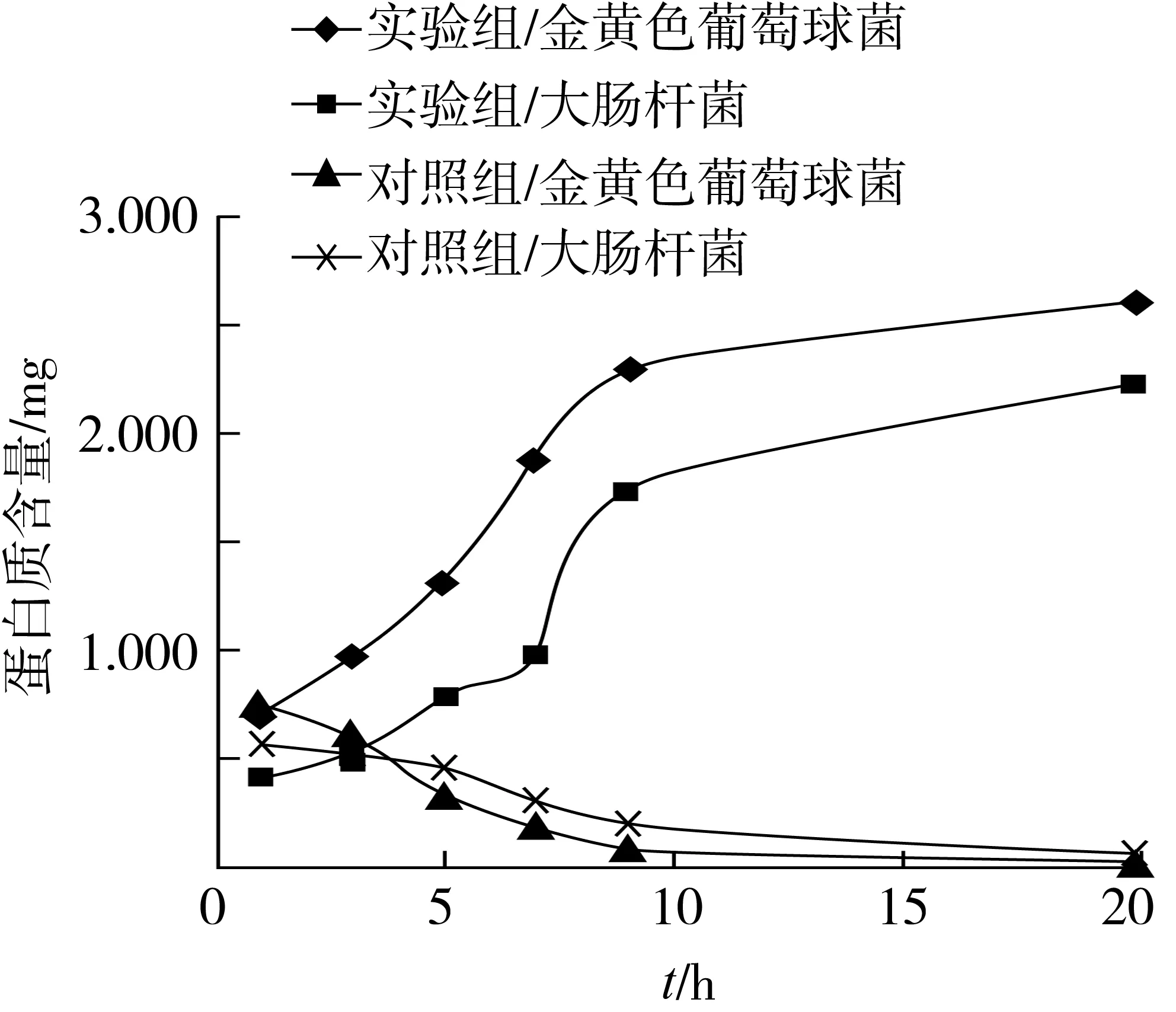
图7 金黄色葡萄球菌与大肠杆菌的蛋白质变化曲线
由图7可知,对照组蛋白质含量变化曲线呈先下降平缓的趋势,这可能是因为细菌生长需要氮源,牛肉膏和蛋白胨为细菌繁殖提供氮源,因此对照组中蛋白质含量先下降,后期呈渐缓的趋势则可能是因为牛肉膏和蛋白胨含量已几乎耗尽,或者是因为细菌的生长已达到衰亡期,消耗蛋白质的能力下降[16]。
而实验组中蛋白质含量呈增长趋势,这有可能是因为细胞膜的完整性被破坏,使细胞内容物包括蛋白质泄出,由此可知:山茶油通过破坏细胞膜的完整性,来起到抑菌作用。由实验组变化率可知,大肠杆菌蛋白质含量增长趋势强于金黄色葡萄球菌,即山茶油对大肠杆菌的抑菌效果强于金黄色葡萄球菌。
3 结论
山茶油具有较好的抑菌效果。山茶油对细菌的作用始于延滞期,其对大肠杆菌与金黄色葡萄球菌的最低抑菌浓度分别为0.5%、1%,对G-的抑制效果强于G+。
由碱性磷酸酶含量、电导率值、还原糖含量以及蛋白质含量变化,可知山茶油的抑菌机理主要是通过影响细胞壁和细胞膜的通透性甚至破坏细胞膜的完整性来达到抑菌作用。
