Bag-1和P53蛋白在甲状腺乳头状癌中的表达与术后效果的关系
2019-06-13吕金锋裴继花王晓明
吕金锋 裴继花 王晓明
焦作煤业(集团)中央医院 1 普外科 2 耳鼻喉科,河南省焦作市 454150
甲状腺乳头状癌(Papillary thyroid carcinoma,PTC)是甲状腺癌中发生率最高的病理类型,具有组织分化程度好、恶性程度低的特点;但仍有30%~50%高分化PTC患者早期可发生颈部淋巴结转移或术后复发[1]。恶性肿瘤的发生、增殖和转移特性往往与凋亡机制障碍有关。Bag-1(Bcl-2-associated athanogene 1)是新近发现与膀胱癌、胃癌、白血病等多种恶性肿瘤的发生密切相关的基因,作为一种重要的肿瘤凋亡抑制基因,其表达上调可能参与肿瘤细胞的恶性增殖[2-3]。但也有研究认为[4],其表达增加可预测较好的临床结局。此外,P53作为一种重要的抑癌基因,其表达失活或突变可诱导肿瘤的发生[5]。基于此,该研究旨在分析Bag-1和P53相关表达蛋白在PTC中的表达与术后效果的关系。
1 对象与方法
1.1 对象资料 选择2014年1月—2016年10月我院诊断的PTC患者96例,手术切除肿瘤组织和癌旁正常组织。纳入标准:(1)年龄18~70岁;(2)病理证实为PTC,未行手术、放化疗及内分泌等治疗;(3)能获得完整病灶组织;(4)患者知情同意。排除标准:(1)妊娠、哺乳期妇女;(2)其他部位原发恶性肿瘤,严重基础疾病;(3)同时参与其他研究,失随访等。其中男30例,女66例,年龄38~66岁,平均年龄(48.7±9.2)岁,TNM分期Ⅰ~Ⅱ期63例,Ⅲ~Ⅳ期33例,肿瘤最大径1.5~4.8cm,平均最大径(2.9±1.2)cm,颈部淋巴结转移20例。
1.2 研究方法 采用免疫组织化学染色法比较Bag-1和P53蛋白的阳性表达率;采用Western blot法检测Bag-1和P53蛋白定量水平;分析Bag-1和P53蛋白表达与肿瘤临床特征的关系。采用根治性肿瘤切除和淋巴结清扫治疗,随访时间10.0~45.0个月,中位时间30.0个月,比较Bag-1和P53蛋白阳性与阴性表达患者的无疾病进展时间(PFS)、复发率和总生存率。
1.2.1 免疫组化法:常规制作组织切片,厚度5μm,二甲苯脱蜡、梯度乙醇水化,抗原修复,加入3% H2O2溶液27℃孵育 20min,滴加正常山羊血清工作液,27℃孵育30min;滴加鼠抗人Bag-1和P53单克隆抗体一抗(江苏碧云天科技有限公司,工作浓度1∶2 000),置于湿盒内 4℃孵育过夜,以正常小鼠 IgG 代替一抗作为阴性对照;滴加兔抗鼠IgG多克隆抗体二抗(江苏碧云天科技有限公司,工作浓度1∶500),置于湿盒中27℃孵育20min;滴加辣根酶标记链霉卵白素工作液(江苏碧云天科技有限公司),置于湿盒中27℃孵育20min,PBS振荡洗涤5min×3次;DAB显色、苏木素复染、盐酸酒精分化、氨水返蓝、梯度乙醇脱水、二甲苯透明、中性树胶封片、室温晾干、光学显微镜下观察。结果判定:采用半定量法,依据染色强度和染色细胞所占比率;以胞浆或胞核黄染至深棕色为阳性,染色强度中无阳性染色为0分,弱染色为1 分,中等强度染色为2分,强染色为3分;阳性细胞数比率≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;两项乘积0~3分为阴性,4~12分为阳性。
1.2.2 Western blot法:组织匀浆后加RIPA裂解液,提取细胞总蛋白,考马斯亮蓝法进行粗定量,每次检测蛋白前使用β-actin抗体对各样本的蛋白量进行剂量标准化检测。取30μg总蛋白,8%SDS-PAGE电泳分离,将分离区带电转移至PVDF膜,加鼠抗VEGF和p38-MAPK单克隆抗体(1∶2 000,美国sigma 公司)静置过夜,加兔抗鼠多克隆抗体二抗(1∶500,美国sigma 公司)室温孵育4h,PBS洗涤,ECL显色。结果扫描保存,Lab Works4.5凝胶成像软件(美国Invitrogen 公司)行半定量分析,以积分光密度(IOD)表示。

2 结果
2.1 Bag-1和P53蛋白阳性表达率的比较 癌组织Bag-1和P53蛋白的阳性表达率显著高于癌旁正常组织,差异有统计学意义(P<0.05)。见表1。
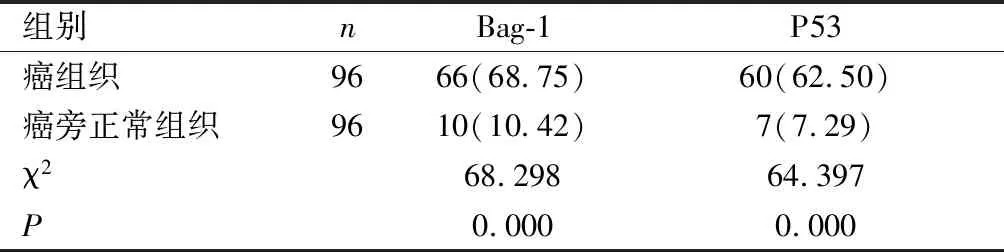
表1 Bag-1和P53蛋白阳性表达率的比较[n(%)]
2.2 Bag-1和P53蛋白定量水平的比较 癌组织Bag-1和P53蛋白相对表达水平也明显高于癌旁正常组织,差异有统计学意义(P<0.05)。见表2。
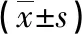
表2 Bag-1和P53蛋白定量水平的比较
2.3 Bag-1和P53蛋白表达与肿瘤临床特征的关系 女性、肿瘤最大径和TNM分期增加以及颈部淋巴结转移者中Bag-1和P53蛋白的阳性表达率增加,差异有统计学意义(P<0.05)。见表3。
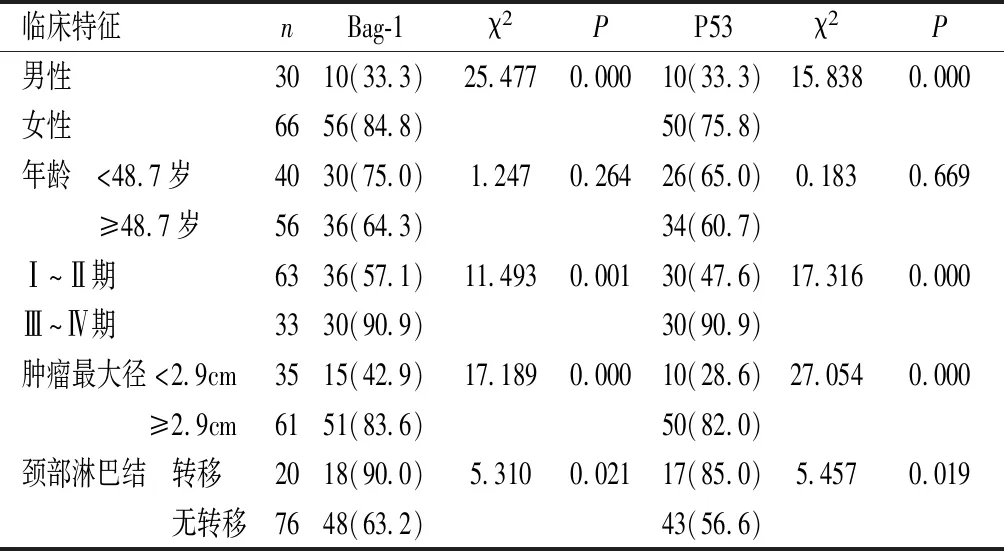
表3 Bag-1和P53蛋白表达与肿瘤临床特征的关系[n(%)]
2.4 Bag-1和P53蛋白阳性表达与生存预后的关系 Bag-1和P53蛋白阳性表达者的PFS明显缩短,复发率增加,差异有统计学意义(P<0.05),总生存率比较差异无统计学意义(P>0.05)。见表4。
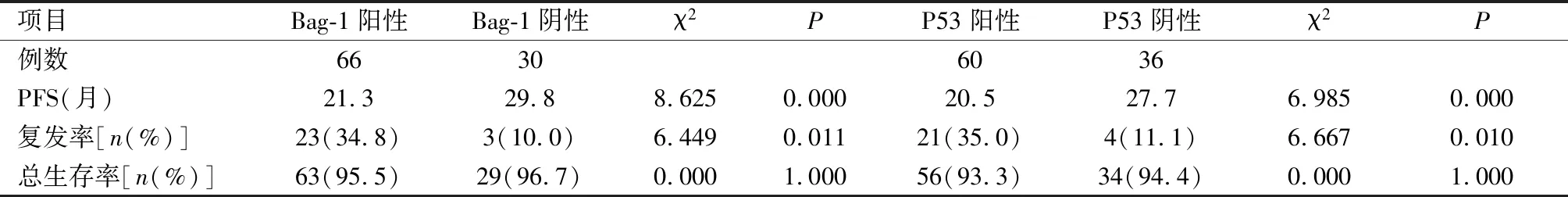
表4 Bag-1和P53蛋白阳性表达与生存预后的关系
3 讨论
李振想等[6]研究指出,Bag-1蛋白在PTC组织中过表达可能与肿瘤发生和发展有关。Bag-1蛋白在正常甲状腺组织中几乎不表达,作为一种多功能结合蛋白,可与酪氨酸激酶生长因子受体、血小板衍生生长因子等结合,发挥抑制凋亡作用;还可与Hsp70、孕激素受体等多种信号因子相结合,调控多条细胞信号转导通路,在肿瘤发生和发展中扮演重要角色[7-8]。Bag-1与Bcl-2形成复合物后抗细胞凋亡能力增强,还可上调 Bcl-2的抗凋亡能力[9]。朱斌[10]研究证实,P53 蛋白阳性表达与PTC的病理分级相关,过度表达可能预示较差的临床预后。Bcl-2和P53均是真核生物体内发挥细胞凋亡的重要分子。
通过该研究得出:癌组织Bag-1和P53蛋白的阳性表达率显著高于癌旁正常组织,差异有统计学意义(P<0.05)。癌组织Bag-1和P53蛋白相对表达水平也明显高于癌旁正常组织,差异有统计学意义(P<0.05)。提示Bag-1和P53蛋白表达与PTC的发生有关。Bag-1基因位于9p12号染色体,主要发挥抑制细胞凋亡的功能,具有4种亚型。通过设计针对Bag-1的阻断性抗体免疫治疗或反义核酸基因,或者是基因转染和特异性小干扰RNA技术构建基因沉默体系,封闭Bag-1基因的表达,可加速肿瘤细胞的凋亡进程,为肿瘤的靶向治疗提供重要思路[11-12]。女性、肿瘤最大径和TNM分期增加,以及颈部淋巴结转移者中Bag-1和P53蛋白的阳性表达率增加,差异有统计学意义(P<0.05)。提示Bag-1和P53蛋白表达参与PTC细胞的增殖和转移等行为。PTC的发生与雌激素的分泌及受体功能密切相关,也可能是Bag-1和P53蛋白表达增加的重要机制[13]。进一步随访发现,Bag-1和P53蛋白阳性表达者的PFS明显缩短,复发率增加,差异有统计学意义(P<0.05),总生存率比较差异无统计学意义(P>0.05)。提示Bag-1和P53蛋白表达可预测肿瘤的临床结局[14]。
综上所述,Bag-1和P53蛋白在PTC中表达上调与肿瘤临床特征和术后生存结局密切相关,Bag-1和P53蛋白可能成为早期诊断、评估治疗和生存预后的重要分子标志物。研究不足是样本量较小,随访时间较短,因此,结果还需要进一步研究验证。
