甜叶菊根多糖提取工艺优化及其体外抗氧化活性的研究
2019-06-132
2
(1. 安徽省多糖药物工程技术研究中心,活性生物大分子研究安徽省重点实验室,皖南医学院药物研发中心,皖南医学院药学院,安徽 芜湖 241002;2. 山东大学苏州研究院,江苏 苏州 215000)
甜叶菊[Stevia rebaudiana (Bertoni).Hemsl],属于双子叶植物纲,菊科多年生草本植物,有生津止渴的功效,用于治疗消渴、糖尿病、高血压等疾病。原产于南美,20世纪80年代初引进国内种植,作为新型糖源植物,其提取得到的糖苷,甜度可达到糖的300倍左右[1-2]。已有外文文献报道甜叶菊根中多糖成分是一种高聚合度的菊糖,且有着优良的益生元效应[3]。菊糖是一类通过β-(2,1)糖苷键连接的天然碳水化合物[4],具有良好的水溶性和益生元特性,相比其他膳食纤维,菊糖较易溶解,易分散于牛奶、酸奶等饮料中,且不会吸收大量水分,故比其他膳食纤维更能提高食品饮料的口感和风味[5-6]。并且它所含热量低,人们饮用它不会导致肥胖,在调节机体平衡、增强胃肠道功能、促进机体代谢等方面有着极其重要的作用,因此广泛应用于食品保健行业中[7]。虽然微生物和真菌中存在一定的菊糖,但是大多数的菊糖还是存在于植物体内,如菊芋、菊苣、大丽花、婆罗门参等植物块茎中,菊糖含量以菊芋为最。但由于菊糖资源的限制,菊糖产业的发展受到了一定的束缚,故找寻新的、可靠有效的菊糖资源以及菊糖植物迫在眉睫。甜叶菊的叶含有大量糖苷,目前大多中外文献研究局限于该部位[1-2,8-9]。而甜叶菊的根却作为废物被丢弃,并且关于甜叶菊根多糖的含量以及提取工艺却未见研究。它的糖苷和提取物具有药理和治疗性质,包括抗氧化、抗菌、抗高血压、抗糖尿病和抗癌,并且市场上目前存在的几款化学治疗药大多含有如乳酸酸中毒、金属味、维生素B12缺乏等不良反应[10],故该糖可能成为潜在的替代产品,具有巨大的开发利用前景。故本文以大量中外文献为科学研究依据,优化甜叶菊根多糖的提取工艺以及其抗氧化活性进行研究。
1 材料与方法
1.1 药材 新鲜甜叶菊根购于安徽宿州,品种为慧昌四号。
1.2 仪器与试剂 小型高速粉碎机WK-2000A(青州市精诚医药装备制造有限公司) ;电热恒温鼓风干燥箱DHG-9070 型(金坛市荣华仪器制造有限公司);离心机SIGMA4K15;SHB-ⅢS循环水式多用真空泵(郑州长城科工贸有限公司);酶标仪(美国 Bio-TeK 公司);电子天平 FA2004N(上海民桥精密科学仪器有限公司)。1,1-二苯基-2-三硝基苯肼(上海源叶生物科技有限公司);羟自由基测试试剂盒(南京建成生物研究所);总抗氧化能力(T-AOC)测试盒:南京建成生物研究所;艾科浦超纯水系统 AFZ-1001-U(颐洋企业发展有限公司);葡聚糖标准品 (色谱纯,美国Sigma-Aldrich公司);Sephadex G-50葡聚糖凝胶:Solarbio公司;数显控温水浴锅 GKC4(上海波洛实验设备有限公司)。所用试剂均为分析纯,水为去离子水;蒽酮、标准果糖、浓H2SO4、三氯甲烷、正丁醇、无水乙醇。
1.3 试验方法
1.3.1 原料预处理 原料(新鲜甜叶菊根)→洗净→60℃烘干→粉碎→甜叶菊根干粉(常温下保存) 。
1.3.2 甜叶菊根多糖的提取 电子天平称取5 g甜叶菊根干粉,倒入烧杯,加入适量纯水,水浴锅中加热一定时间,溶液纱布粗过滤后,经0.45 μm微孔滤膜过滤即得。
1.3.3 甜叶菊根多糖提取条件的优化 使用相同批次的甜叶菊根干粉作为材料,并使用水作为提取溶剂。并研究了不同固液比,提取温度和提取时间对甜叶菊根多糖产量的影响。采用正交设计方法对单因素试验结果的提取过程进行优化,探索影响因素,确定最佳提取条件。
1.4 分析方法
1.4.1 硫酸-蒽酮法测总糖含量以及标准曲线的绘制 采用改良蒽酮硫酸法[11],以果糖为标准品,糖浓度为横坐标,吸光值为纵坐标,绘制标准曲线,得线性回归方程:Y=3.5856X-0.0044,R2=0.9946。
1.4.2 总糖得率及含量的计算 根据供试品吸光度及标准曲线回归方程计算得出供试品浓度:总糖得率(%)=样品中总糖含量/原料质量×100%。
1.5 统计学方法 采用SPSS 18.0统计软件,以F检验分析组间显著性差异,P<0.05表示差异有统计学意义。
1.6 甜叶菊根纯多糖抗氧化活性的测定
1.6.1 对DPPH自由基的清除率 根据DPPH自由基有单电子,在517 nm处有一强吸收,其醇溶液呈紫色的特性。当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用吸光度的变化趋势表现抗氧化活性[12]。参照文献[13]并改进,取适量甜叶菊根纯糖,用双蒸水配制成1 mg/ml、2 mg/ml、3 mg/ml、4 mg/ml、5 mg/ml等一系列浓度,称取适量Vc进行上述操作,作为阳性对照。精密称取4 mg DPPH溶于100 ml无水乙醇中,制备浓度为80 mmol/L,避光保存在棕色瓶中备用。样品管中加入0.25 ml不同浓度的多糖或Vc溶液和1.25 ml DPPH溶液;对照管中用无水乙醇溶液代替DPPH溶液;空白管中用蒸馏水代替多糖溶液。各管置于28℃水浴锅中水浴30 min后,吸取200 μl于酶标板,在517 nm处测定吸光度。平行3组,取平均值,按下式计算多糖对DPPH自由基的清除率[14]:
清除率(%) =[1- (A样品-A空白) /A对照]×100%
1.6.2 清除羟基自由基的能力 Fenton反应是最常见的产生羟自由基的化学反应,H2O2的量和Fenton反应产生羟基的量成正比,当给予电子受体后,用Griess试剂显色,形成红色物质,其呈色与羟基的量成正比关系。因此可通过酶标仪测定显色物质的吸光度来反映甜叶菊根多糖清除羟自由基的能力。通过测定管吸光度低于对照管可判断出甜叶菊根纯糖抑制自由基。故底物应用液的配制为底物贮备液∶双蒸水=1∶99。样品溶液配成与1.6.1相同的系列浓度,Vc作为阳性对照,双蒸水调零,室温放置20 min后,波长550 nm,1 cm光径,测定吸光度,平行3组,取平均值。按下式计算甜叶菊根纯糖对羟基自由基的清除率[15]:
羟基自由基清除率(%)=[1-(A样品-A空白) /A对照]×100%
1.6.3 总抗氧化活性 (FRAP) 测定 采用光脱色荧光恢复技术(FRAP)测定总抗氧化活性。将醋酸缓冲液、TPTZ、FeCl3溶液按照10∶1∶1的比例混合配制成新鲜的FRAP工作液(现用现配),称取27.8 mg FeSO4-7H2O,用双蒸水溶解并配制成不同浓度的标准品溶液,分别取5 μl标准品溶液,迅速加入180 μl FRAP工作液,以5 μl蒸馏水为空白对照,37℃孵育5 min,波长593 nm,酶标仪读取OD值。绘制标准曲线。称取适量甜叶菊根纯多糖,用双蒸水配制成1 mg/ml、2 mg/ml、3 mg/ml、4 mg/ml、5 mg/ml、6 mg/ml一系列浓度,称取适量Vc进行上述操作,作为阳性对照。分别取5 μl对照品溶液,迅速加入180 μl FRAP工作液,37℃孵育5 min,在 593 nm下测定OD值。根据FeSO4曲线公式计算FRAP值。
2 结果与讨论
2.1 单因素试验结果
2.1.1 固液比的影响 称取5 g甜叶菊根粉末,按照固液比1∶10、1∶15、1∶20、1∶25、1∶30提取温度60℃,提取时间60 min,按照分析方法1.4提取测定,计算多糖提取率,结果见图1。结果表明,随着固液比的增大,多糖提取率先增加后降低,固液比为1∶20时达到最大值,即提取甜叶菊根多糖的效果在固液比为1∶20时最好,优于其他不同固液比的提取条件。

图1 固液比对甜叶菊根多糖提取率的影响
2.1.2 提取温度 称取5 g甜叶菊根粉末,按照提取温度40℃、50℃、60℃、70℃、80℃,固液比1∶20,提取时间60 min,按照分析方法1.4提取测定,计算多糖提取率,结果见图2。结果表明,随着提取温度的升高,多糖提取率先增加后降低,在温度高于70℃后,提取率下降了,可能是由于高温使多糖产生了降解。提取温度为70℃时达到最大值,即提取甜叶菊根多糖的效果在提取温度为70℃时最好,优于其他不同提取温度的提取条件。

图2 提取温度对甜叶菊根多糖提取率的影响
2.1.3 提取时间 称取5 g甜叶菊根粉末,按照提取时间30 min、60 min、90 min、120 min、150 min,固液比1∶20,提取温度70℃,按照分析方法1.4提取测定,计算多糖提取率,结果见图3。结果表明,随着提取时间的增加,多糖提取率先增加后降低,提取时间超过90 min后,提取率的降低可能是加热时间过长导致多糖结构的破坏。提取时间为90 min时达到最大值,即提取甜叶菊根多糖的效果在提取时间为90 min时最好,优于其他不同提取时间的提取条件。

图3 提取时间对甜叶菊根多糖提取率的影响
2.2 甜叶菊根多糖提取条件的优化 通过单因素试验研究了甜叶菊根多糖的最佳提取条件,选择固液比、提取温度及提取时间作为研究因素,设计三因素三水平正交实验,见表1、表2。由表3可知,因素A具有极显著性差异(P<0.01),因素B和C都具有显著性差异(P<0.05)。因此,影响甜叶菊根多糖提取率的因素依次是:固液比>提取温度>提取时间,由表1、2可知最佳提取条件为A3B3C3,即在固液比为1∶30 (g/ml)、提取温度为80℃、提取时间为150 min。
2.3 验证实验 由于最优组合没有在正交实验中体现,为了进一步验证正交试验结果的可靠性和重现性,将最优组合A3B3C3和甜叶菊根多糖提取率最高组合A3B3C2进行了对比验证实验,即按所得最优组合作三组平行实验,得到A3B3C3组提取率分别为66.78%、66.23%、67.52%,平均值为66.84%,高于A3B3C2组的65.64%,验证了正交理论组合的可靠性。即甜叶菊根多糖最佳提取工艺条件为固液比为1∶30,提取温度为80℃,提取时间为150 min。

表1 因素与水平设计表

表2 L9(33)正交实验结果

表3 正交实验结果方差分析
2.4 甜叶菊根纯糖的洗脱曲线 将1.3.2所得粗糖醇沉24 h,利用sevege试剂进行脱蛋白,大孔树脂D101脱色,sephadexG50层析纯化,测定各试管吸光度,得到甜叶菊根纯糖的洗脱曲线。结果见图4。

图4 甜叶菊根多糖的洗脱曲线
2.5 甜叶菊根多糖对DPPH自由基的清除率 以Vc作为阳性对照,甜叶菊根多糖对DPPH自由基的清除能力,结果见图5。由图5可知,对比Vc,甜叶菊根多糖对DPPH自由基有较好的清除能力,随着质量浓度的升高而不断增强,并在一定的实验浓度范围内呈现出良好的量效关系。在浓度为5 mg/ml时,清除率能达到71.65%。

图5 甜叶菊根多糖对DPPH自由基清除率
2.6 甜叶菊根多糖对羟基自由基的清除率 以Vc作为阳性对照,测定甜叶菊根多糖对羟基自由基 (羟OH) 的清除能力,结果见图6。由图6可知,对比Vc,甜叶菊根多糖对羟自由基的清除非常明显,随着质量浓度的升高,清除率接近Vc。在浓度为5 mg/ml时,清除率可达到90.51%。
2.7 甜叶菊根多糖的总抗氧化能力的测定(FRAP)
2.7.1 FeSO4-7H2O标准曲线 由图7可得到FeSO4-7H2O标准曲线方程:Y=1.4018X+0.0615,X表示FeSO4浓度,Y表示吸光度。R2=0.9927,证明在0.16~0.56 mmol/L的浓度范围内线性关系良好。
2.7.2 甜叶菊根多糖FRAP值的测定 以Vc作为阳性对照,测定甜叶菊根多糖的FRAP值,结果见表4。由表4可知,甜叶菊根多糖的总抗氧化活性良好,在实验浓度范围内,表现出一定的剂量依赖性,随着质量浓度的增加,FRAP值也随之升高。
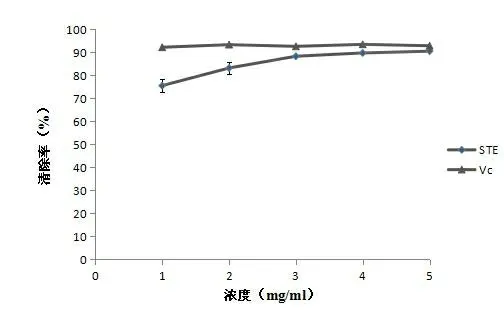
图6 甜叶菊根多糖对羟基自由基清除作用

图7 FeSO4-7H2O标准曲线

表4 甜叶菊根多糖的FRAP值
3 结论
通过单因素试验分析后,选取固液比、提取温度、提取时间为研究因素,进行L9(33) 正交试验设计,结合方差分析得到影响因素为:固液比>提取温度>提取时间,最佳提取条件为,固液比1∶30、提取温度80℃、提取时间150 min。后续用SephadexG-50柱层析纯化也呈现出较好对称性,说明该多糖是较高纯度的单一组分多糖,并且可看出纯化后的多糖纯度较高,含杂质较少。同时,甜叶菊根多糖也具有良好的抗氧化活性,虽然低于阳性对照Vc,但在浓度为5 mg/ml时,对DPPH自由基和羟基自由基的清除率分别达到73.30%和90.51%。在甜叶菊根纯糖浓度为6 mg/ml时,FRAP值达到了(33.172±0.184) mmol/ml,呈现出良好的量效关系。该糖目前在已知文献中研究极少,但其表现出的活性值得研究,存在较高的研究价值。
