TACE联合索拉非尼治疗肝癌合并门静脉癌栓的临床疗效及安全性
2019-06-11陈庆录张冠平
陈庆录 张冠平
每年因肝癌死亡人数超过30万例[1]。在44%原发性肝癌(HCC)死亡患者中均发现门静脉癌栓(PVTT)存在,大约10%~40%患者在被早期便被确诊为肝癌伴PVTT[2]。近年研究发现经导管肝动脉灌注化疗栓塞术(TACE)联合其他方案可延长合并PVTT的HCC患者生存时间及改善远期生存质量[3]。索拉非尼是靶向血管内皮生长因子受体的抗肿瘤靶向药,其有效性和安全性已获得肯定,其与TACE联用治疗肝癌被认为是具有治疗潜力的新兴疗法。本研究观察了TACE联用索拉非尼治疗HCC合并PVTT的临床疗效,现报道如下。
资料与方法
一、临床资料
选择2015年1月至2016年12月我院经临床诊断确诊为HCC,影像学诊断合并PVTT患者60例的病历资料,其中男性46例,女性14例;年龄>50岁28例,≤50岁32例;肝功能Child分级A级患者35例,B级25例;美国东部肿瘤协作组(ECOG)评分0分24例,1~2分36例。患者诊断参照2011年我国HCC诊断标准[4],并参照文献根据PVTT解剖特征、部位及侵犯范围对其进行分型。所有患者入组后接受至少1次TACE治疗,将患者随机分为治疗组及对照组各30例,其中联合组采用TACE+索拉非尼治疗,对照组采用TACE治疗。
二、纳入标准与排除标准
纳入标准:(1)年龄18~75岁;(2)ECOG评分0~2分;(3)Child-Pugh分级A、B级:A级:5~6分(手术危险度小,预后最好,1~2年存活率100%~85%);B级:7~9分(手术危险度中等,1~2年存活率80%~60%);(4)经三期增强CT发现门静脉存在充盈缺损,确认存在PVTT。
排除标准:(1)门静脉严重堵塞,Child-Pugh分级非AB级患者;(2)此前进行过肝癌手术、肝移植、物理消融或接受局部放射治疗患者;(3)此前接受索拉非尼治疗、系统性化疗、肝动脉化疗和TACE患者;(4)合并其他恶性肿瘤。
三、治疗方法
TACE治疗所有患者取仰卧位,手术过程中行心电监测。采用Seldinger穿刺经股动脉穿刺置入5-F导管(广州市宏坤贸易有限公司,670-006-00)至肝动脉,行数字减影血管造影(DSA)后了解肿瘤的大小、血供丰富及门静脉分支等,再使用微导管超选择性的插入肿瘤的靶血管,在X线监视下注入20~60 mg阿霉素与碘化油2~20 mL的混合乳化剂,注入碘化油化疗乳化剂的用量必须根据患者身体状况、肝功能、病灶大小及血供情况确定,用凝胶海绵微球栓塞直到肿瘤主要供血动脉血流停滞。最后用稀释为0.5 mg/mL的洛铂已0.5 mL/min的速度进行灌注化疗,洛铂总用量在20~50 mg。是否重复进行TACE治疗由主治医师根据随访时影像学结果以及患者的疾病进展及肝功能情况决定(其中患者每次行TACE均有同一个医生在相同条件下操作)。
患者于首次TACE术后3至5天后,给予口服索拉非尼,400 mg/次,每天2 次。以后每次接受TACE均不中断索拉非尼治疗。索拉非尼剂量根据患者服药期间出现的毒副反应进行调整。美国国立癌症协会通用毒性标准(CTCAE)3.0版[5]定义的Ⅰ-Ⅳ血液毒性,皮肤毒性,胃肠道毒性,高血压或肝功能衰竭,则将索拉非尼用量减量为400/次,每天1次,直到不良症状减轻或消失,如若减量处理后仍不见症状改善,则需立即停药。
四、 随访
患者要求在首次TACE之后4~6周进行复查,复查时需进行详细病史采集及体格检查,完成各项实验室项目,疗效评价采用胸腹部增强CT或增强MRI检查,实验室检查项目包含血液学及生化检测,包括红细胞计数、凝血酶原时间、甲胎蛋白、天冬氨酸转移酶、丙氨酸转移酶、总胆红素、白蛋白和肌酐值等。据CT或MRI提示肿瘤复发或残留情况,Child-Pugh等级以及是否有肝代偿失调(如腹水或肝性脑病)等症状判断是否继续接受TACE治疗。随访期间根据CTCAE3.0版[5]记录患者出现的毒副反应,主要包括:腹泻,手足综合征,皮疹,乏力,厌食/恶心,高血压。随访截止日期为2018年2月。
五、疗效评估标准及不良反应监测
(1)根据改良实体瘤疗效评价标准(mRECIST)评估疗效[6]:完全缓解(CR):动脉期患者增强区域完全消失,反应肿瘤细胞的完全坏死;部分缓解(PR):动脉期增强区域至少缩小≥30%;疾病稳定(SD):缩小未达PR或增大未达PD;疾病进展(PD):增强区域的最大直径增加≥20%或出现新的病灶。疾病控制率(DCR)=CR+PR+SD/总例数。(2)统计患者总体生存期(OS)及疾病进展时间(TTP),其中OS至首次诊断到患者出现任何原因死亡或失访的时间,TTP指入组到影像学发现患者出现进展的时间。
六、统计学方法

结 果
一、患者基线资料
截至随访日期,治疗组中位随访时间11.3个月(2-24个月),死亡24例(80.0%),中位服用索拉非尼时间为11.0个月,23例患者接受2次以上TACE治疗,中位TACE次数3.6次(1~8次);对照组中位随访时间6.9个月(2~16个月),死亡28例(93.3%),22例患者接受2次以上TACE,中位TACE次数2.5次(1~6次),两组患者在性别比、年龄、ECOG评分、AFP值、Child-Pugh等级、肝硬化、乙肝、癌栓类型无显著性差异(P>0.05),见表1。
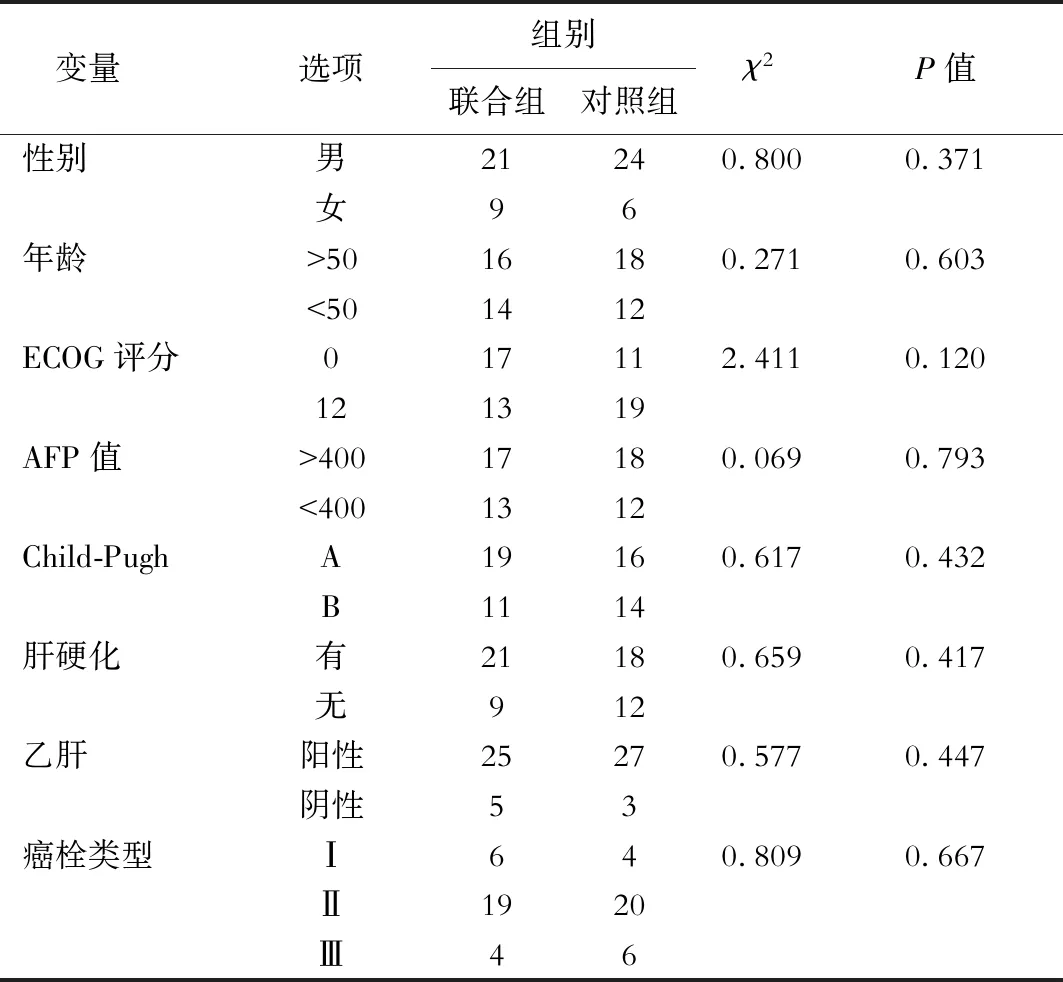
表1 患者基线资料
二、近期疗效
治疗组DCR为60.0%,对照组33.33%,二组DCR率有显著性差异(P<0.05),见表2。

表2 治疗组和对照组治疗效果比较分析
三、 生存分析
治疗组中位OS为10.3个月(95%CI:7.2~13.5),对照组患者OS为5.7个月(95%CI:4.5~6.8),二者比较具有显著性差异(P<0.05);联合组中位TTP为5.5个月(95%CI:4.6~6.7),对照组中位TTP为3.0个月(95%CI:2.1~3.7),二者比较具有显著性差异(P<0.05),见图1,图2。
四、不良反应
两组患者均未出现术后死亡或药物相关死亡病例,治疗组中与索拉非尼相关不良时间中有Ⅲ级腹泻1例,Ⅲ级手足综合征2例和Ⅲ级高血压1例,见表3。两组与TACE有关不良反应发生率比较均无显著性差异(P<0.05),见表4。

图1 两组OS比较
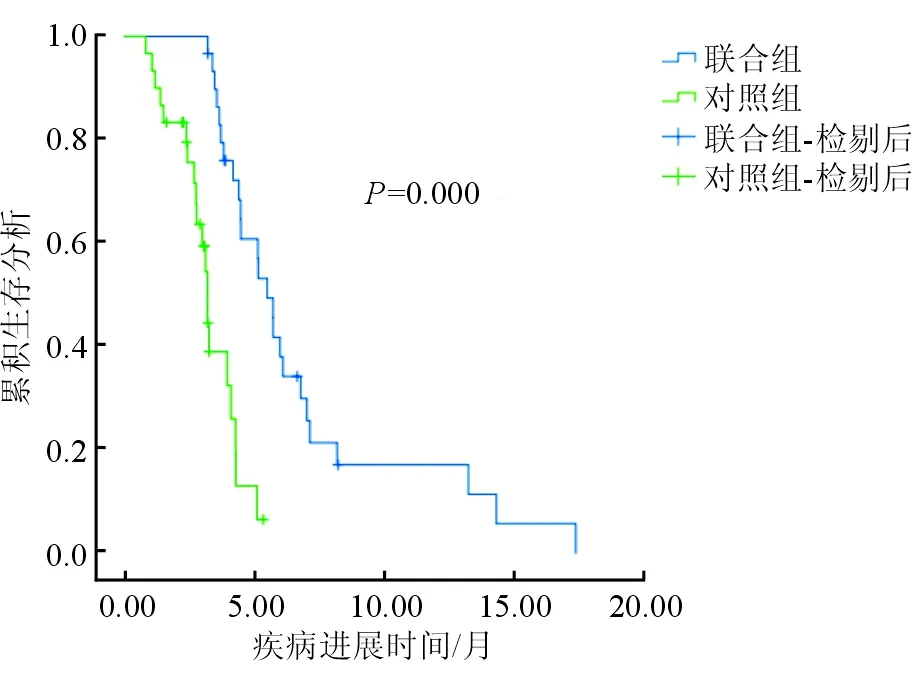
图2 两组TTP比较

毒副反应总例数Ⅰ级Ⅱ级Ⅲ级Ⅳ级腹泻1510410手足综合征2015320皮疹43100乏力33000厌食/恶心21100高血压2110

表4 与TACE相关不良反应比较
注:a表示采用校正卡方检验
讨 论
当肝癌肝内转移后侵犯门静脉便会导致PVTT,其发生率在12.5%~39.7%之间,使肝脏血供受阻,严重影响肝脏功能,加快病情恶化,是影响HCC预后的重要因素[7-9]。
TACE已成为中晚期HCC局部治疗的首位选方案,可有效解除堵塞,缓解门静脉高压、降低腹水、上消化道出血、肝性脑病等并发症的发生概率,近期疗效显著,但对于远期疗效来说并不理想,患者需重复接受TACE治疗,本身对肝功也有一定损害[10-12]。以TACE为基础的针对PVTT的联合治疗,目的在于减少TACE次数,改善患者预后,包括门静脉支架、射频消融、125I粒子、灌注化疗和三维适形放疗放疗等[3]。靶向药物索拉非尼可有效改善HCC患者长期生存,其与TACE联用的有效性与安全性也引起学界的广泛关注[13,14]。
本研究分析了TACE联合索拉非尼与单纯TACE治疗HCC合并PVTT的疗效及安全性。结果显示联合治疗组疾病响应率显著高于对照组(60.0%对36.7%,P<0.05),并且联合治疗组无论是在OS(10.3个月对5.7 个月,P<0.05)或是TTP(5.5个月对3.0 个月,P<0.05)均显著优于对照组,证明TACE联合索拉非尼治疗可让患者受益。研究中发现联合治疗的另一优势是在延长OS的同时可减少患者接受TACE治疗的次数。TACE作为局部治疗手段可控制一定区域内肿瘤的进展,但PVTT本身便容易导致癌细胞血运转移及局部复发转移,索拉非尼作为靶向血管内皮生长因子受体抑制剂,通过全身作用可较好降低肿瘤复发风险;其次研究发现TACE后肿瘤组织缺血缺氧状态会刺激其自身血管再生,引起血管生长因子及血小板衍生生长因子受体表达上调,索拉非尼可通过抑制上述因子的表达增强TACE治疗的效果[15]。索拉非尼本身已被研究证实可改善HCC患者生存期,目前索拉非尼联合各种抗肿瘤治疗的研究已成为研究热点,但限制器广泛应用的其中一个原因便是明显的毒副作用[16]。在本研究中没有出现患者因手术治疗或毒副反应而死亡病例,也未出现3级以上不良反应,其中3级不良反应有4例,患者通过调整药物用量及对症治疗后可缓解,而两组间TACE相关性不良反应发生率没有显著性差异,证明该治疗方案是安全可行的。
综上所述,本研究表明,索拉非尼联合TACE用于治疗合并PVTT的HCC,可显著延长OS和PTT,是治疗晚期肝癌的一种安全、可行的方法。本研究为单中心、回顾性临床研究,样本量小,并且未对不同PVTT分型患者进行对比分析,需进一步深入研究。