肉瘤样肾细胞癌临床、病理学特征及预后分析
2019-06-11邢自宝王福利郑昱袁建林闫飞侯广东
邢自宝 王福利 郑昱 袁建林 闫飞 侯广东
肾细胞癌伴肉瘤样分化(renal cell carcinoma with sarcomatoid differentiation,sRCC)是指在肾细胞癌中出现肉瘤样成分,是肾实质癌中临床发生率很低的特殊类型,发生率约为1.6%~5.1% 。肉瘤样肾细胞癌恶性程度高,容易转移及复发,预后较差,平均总生存期明显低于无肉瘤样变肾细胞癌患者[1]。手术治疗仍是局限性sRCC的一线治疗策略,虽然目前针对转移性肾细胞癌的系统治疗已取得了显著性突破,但对于转移性sRCC的疗效仍较差。本文对2008年1月至2017年12月我院收治的30例术后病理确诊为sRCC患者的临床资料进行了分析探讨,并随访患者预后情况,以提高对此类罕见的特殊类型肾癌的全面认识。现报告如下。
对象与方法
一、研究对象
检索调阅2008年1月至2017年12月我院收治的1 498例肾细胞癌患者的病历资料,将其间术后病理检查明确诊断为sRCC的30例患者纳入研究,排除肾癌复发病例及临床资料不完整和围手术期死亡病例。sRCC患者占所有肾细胞癌患者的2.01%。
以2018年10月20日为随访截止时间,逐一通过电话随访方式获取患者的终点状态、死亡时间和死亡原因等信息,并准确记录。将患者死亡定义为终点事件,因非肾癌相关原因死亡、拒不配合随访或至随访截止时间仍存活的病例作为删失数据。
二、诊断标准
本研究采用2016版WHO肾脏肿瘤分类标准及AJCC第七版TNM分期标准和1982年Fuhrman病理分级标准。本研究中2016年以前病理学分类及2009年以前TNM分期由临床医生与病理科医生共同修正。静脉瘤栓采用Mayo Clinic 分级标准。
三、统计学方法
结 果
一、一般资料
30例sRCC中,男22例(73.7%),女8例(26.7%),男女比例为2.75∶1。患者最小年龄41岁,最大年龄86岁,平均年龄(61.28±11.73)岁,中位年龄63.5岁。≤60岁患者10例(33.3%),>60岁患者20例(66.7%)。有吸烟史5例(16.7%),饮酒史2例(6.7%),有高血压病史7例(23.3%),糖尿病史5例(16.7%)。城镇居民23例(76.7%),农村居民7例(23.3%)。
二、临床特征
30例sRCC中,无明显临床症状患者18例(60.0%);有症状患者12例(40.0%),其中腰痛4例、血尿3例、消瘦3例、发热2例。T1期患者19例(63.3%),T2期及以上患者11例(36.7%)。术前发现转移5例(16.7%),分别为骨转移1例、淋巴转移1例、肺与淋巴转移1例、肝与淋巴转移2例。术前发现有静脉瘤栓4例(11.1%),分别为肾静脉1例、下腔静脉Ⅰ级1例、下腔静脉Ⅲ级1例和肾静脉合并下腔静脉Ⅳ级1例。
三、病理学特征
30例sRCC病例中,透明细胞癌23例(76.7%)、乳头状细胞癌3例、嫌色细胞癌3例、集合管癌1例。根据Furhman分级标准,1级1例、2级1例、3级7例、4级12例,未明确报告病理分级9例。病理检查发现合并坏死9例。
四、治疗方式
行根治性肾切除术26例,行保留肾单位肾部分切除术4例。术后行靶向药物治疗3例,放疗1例。
五、预后
随访截止2018年10月20日,有效随访病例30例,无失访病例。共随访4~60个月,平均随访(21.44±17.79)个月,其中21例患者死亡,占70.0%,死亡患者最长生存时间为47个月,最短生存时间为4个月。整个随访期内,患者中位生存时间为14个月。1、2和3年生存率分别为63.0%、28.5%和14.3%(图1)。死亡原因均为肿瘤进展、复发和转移等相关因素。术后3例患者行靶向药物治疗,其中2例死亡,生存时间分别为11个月、21个月,1例存活至随访终点(共随访14个月),未发生复发。1例患者术后接受放疗,1个月后复发,生存时间为6个月。
使用Kaplan-Meier法比较不同年龄、性别、肿瘤侧别、T分期、病理学类型、病理分级及有无坏死组间的生存曲线差异,发现T1期患者较T2期及以上分期患者生存时间长,差异有统计学意义(χ2=8.198,P=0.004),T1期患者中位生存时间为16个月,T2期及以上患者中位生存时间为8个月(图2),其他临床特征组间比较,未见统计学差异(P均>0.05)(表1)。其他因素如吸烟史、饮酒史、糖尿病史、M1分期、N1分期及有静脉瘤栓等由于病例数过少(≤5例),故未纳入本次分析。
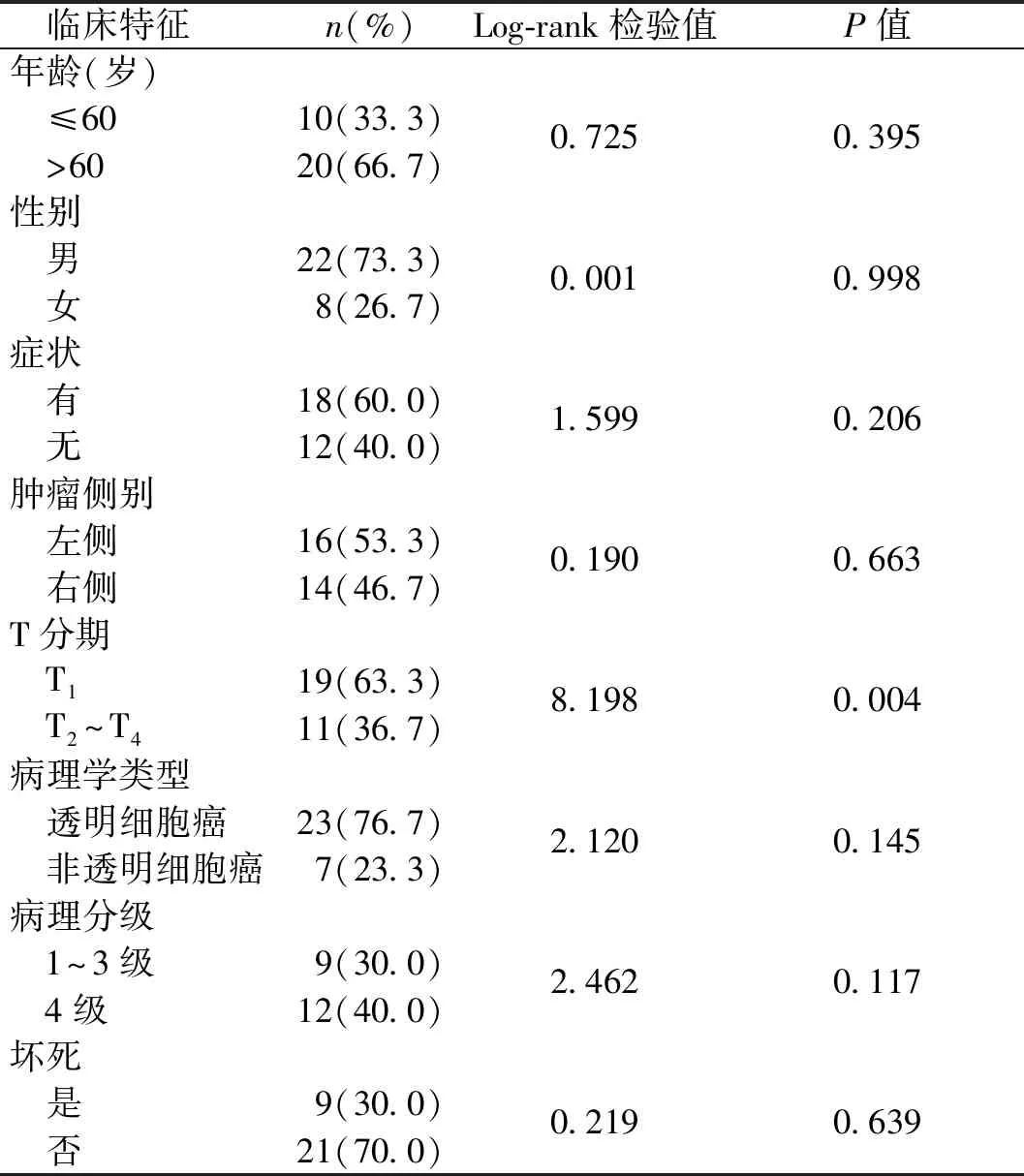
表1 不同临床特征sRCC患者生存分析比较

图1 所有sRCC患者的生存曲线

图2 不同T分期sRCC患者的生存曲线
讨 论
中国人群sRCC的临床、病理学特征及预后情况如何,目前尚缺乏大样本临床研究,现有的文献中最大样本量仅只有20例。国外文献报道肉瘤样肾细胞癌占肾实质肿瘤的2%~3.6%,发病年龄为56~61岁,男女发病比例为1.6∶1~2.2∶1,转移性sRCC占所有sRCC病例的20%[2],患者中位生存时间仅为10个月~2年,较其他高级别肾细胞癌患者预后差[3]。本研究发现肉瘤样肾细胞癌占所有肾细胞癌的2.01%,发病年龄为41~86岁,平均年龄(61.28±11.73)岁,中位年龄为63.5岁,男女比例为2.75∶1,转移性sRCC占所有肾细胞癌病例的16.7%,患者中位生存时间为14个月,与国外报道基本一致。
发生远处转移、淋巴结转移、年龄为60岁以上及高临床分期是sRCC患者的独立预后危险因素[4-5]。本研究通过Kaplan-Meier分析发现,sRCC患者不同年龄、性别、有无症状、肿瘤侧别、病理学类型、病理分级及是否坏死组间生存时间未见差异,而T2及以上分期患者较T1期患者生存时间更短,虽然本研究收集了10年来我院所有sRCC患者的临床数据,但仍限于样本量不足,无法对发生远处转移和淋巴结转移患者的预后情况进行生存分析。此外,多项研究证实有肉瘤样成分是患者转归中最具影响的预后变量之一,肉瘤样成分越高,转归越差[3]。
sRCC的治疗方式主要包括手术治疗和全身治疗。现有的数据显示肾切除术可能为sRCC患者带来生存获益,但仍存在争议。对于局限性sRCC,行肾切除术可能会提高患者的总生存时间,国际转移性肾细胞癌数据库联盟(The International Metastatic Renal Cell Carcinoma Database Consortium,IMDC)对纳入的总共1 378例转移性肾细胞癌患者中具肉瘤样特征的189例患者进行了研究,其中接受肾切除术的sRCC患者的中位生存期为10.2个月,而未接受肾切除术的患者为5.5个月[6]。对于转移性sRCC,Park等[7]通过研究指出,行肾切除术并不会提高患者的生存时间;行肾切除术的局限性sRCC患者,术后发生复发、转移的概率也非常高。Merrill等[8]随访了73例行肾切除术的局限性sRCC患者,有56例(72%)出现复发,中位复发时间为26.2个月。而一旦转移,转移灶切除术被认为是无益的[5]。关于具体手术方式,虽然美国泌尿学协会建议对于小体量的sRCC尽量优先考虑保留肾单位肾切除术,但由于小体量的sRCC比例往往较低,且大部分sRCC在影像学检查中发现有浸润性外观成像,同时保留肾单位肾切除术可能会增加局部复发风险,因此根治性肾切除术或许更值得推荐[9-10]。sRCC患者全身治疗选择有限,主要包括靶向治疗、化疗及免疫治疗。Kyriakopoulos等[11]通过对比接受VEGF 受体靶向药物治疗的230例sRCC患者及2 056例非sRCC患者发现,sRCC患者中位无进展生存期和总生存期分别为4.5和10.4个月,而非sRCC患者分别为7.8和22.5个月。其他的系列研究发现,同样接受靶向药物治疗,sRCC患者的无进展生存期为4.4~5.7个月,总生存期为10~20.9个月,而非sRCC患者的无进展生存期为10.4个月,总生存期为22.5个月,sRCC患者接受不同的靶向药物治疗均未取得满意的临床疗效,但有证据显示VEGF受体靶向疗法可能更有效[12-13]。现有的临床试验结果显示,接受化疗的sRCC患者无进展生存期为2.2~5.5个月,总生存期为3.9~12个月,与未接受化疗的sRCC患者相比,并无明显差异,而舒尼替尼靶向治疗联合吉西他滨治疗显示有较好的客观反应率,但需进一步的临床验证[14]。免疫治疗方面,尽管有报道白介素-2为基础的免疫疗法具有一定疗效,但远期效果并不理想。目前PD-1/PD-L1轴免疫疗法已在黑色素瘤等恶性肿瘤领域开展临床试验,取得了较好的临床疗效,相较于非sRCC,sRCC已被证明可以更高地表达PD-1/PD-L1,提示PD-1/PD-L1轴或许可以作为sRCC新的治疗靶点,目前也已有相关的临床试验正在进行[15]。
综上,sRCC是一种罕见的肾细胞癌病理类型,患者预后差,复发及转移风险高,生存时间较短,本研究发现T2期及以上患者生存时间短于T1期患者,因此强调sRCC早期诊断,在疾病早期、未转移阶段及时实施手术治疗能改善患者预后,提高患者生存率。虽然现有的全身治疗方案仍未取得确切、满意的临床疗效,但手术联合全身治疗方案可能为患者带来临床获益,尤其是目前正在进行研究的PD-1/PD-L1轴靶点免疫疗法,或许将为sRCC患者带来新的治疗希望。
