番鸭细小病毒LAMP检测方法的建立
2019-06-11朱善元夏文龙左伟勇王永娟
孟 婷,朱善元,夏文龙,左伟勇,王永娟
(江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,泰州 225300)
番鸭细小病毒病是由番鸭细小病毒(Muscovy duck parvovirus,MDPV)感染引起的以腹泻和喘气为主要症状的急性或亚急性传染病[1-3]。该病主要危害30 日龄以内的雏番鸭,特别是1~3 周龄的雏番鸭,因此俗称“三周病”。MDPV传播迅速,常引起鸭群发病和成群死亡,发病率和死亡率都很高。日龄较大的雏鸭感染MDPV后一般症状较轻,病死率较低,但病愈后大部分生长发育受阻,成为僵鸭。目前番鸭细小病毒病已经成为危害我国养鸭业发展最为严重的传染病之一[4-6]。MDPV检测方法中血清中和试验、琼脂扩散试验、ELISA等[7]方法灵敏性低,周期长,重复性差,不易标准化,难以大范围推广使用;常规PCR和荧光定量PCR技术具有灵敏度高,特异性强等特点,但所需实验设备和试剂往往比较昂贵,对操作员要求较高,不能满足基层兽医站或养殖场临床一线简便、快速检测的需要[8]。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)是一种新型的恒温核酸扩增技术,它依赖于能够识别靶序列6 个特异区域的4 条引物和一种具有解旋功能的BstDNA聚合酶,能够在恒定温度下,短时间内实现核酸的指数级扩增。LAMP以其简便、快速、高效、灵敏、特异等诸多优点受到越来越多兽医工作者的关注,并在一些病原微生物的检测中得到应用推广[9-11]。本研究通过对MDPV的VP3基因保守序列的分析,设计了一组特异性引物,建立了MDPV的LAMP快速检测方法,为将来MDPV的快速检测试剂盒研制提供了科学依据。
1 材料和方法
1.1 病毒株 鸭肝炎病毒(Duck hepatitis virus,DHV)、鸭瘟病毒(Duck plague virus, DPV)和番鸭细小病毒(Muscovy duck parvovirus, MDPV)由中国农业科学院上海兽医研究所惠赠;小鹅瘟病毒(Goose parvovirus, GPV)和新城疫病毒(Newcastle disease virus,NDV)购自中国兽医药品监察所,保存于-80℃。
1.2 试剂及器材BstDNA聚合酶(大片段)、SYBR Green I 染料购自New England Biolabs公司;MgSO4、甜菜碱购自天根生化科技(北京)有限公司;病毒基因组提取试剂盒购自生工生物工程(上海)股份有限公司;dNTP、DNA Marker购自TaKaRa公司; DEPC水购自Sigma公司;2×LAMP Master Mix(含染料)购自康为世纪生物科技有限公司;其他试剂均为分析纯。
1.3 引物设计与合成 根据MDPV的VP3基因序列(GenBank登录号:AY496895.1),选取一段高度保守的区域,使用Primer Premier 5.0软件设计上游引物F和下游引物R(表1);使用在线引物设计软件Primer Explorer V4(http://primerexplorer.jp/elamp4.0.0/index.html)设计LAMP引物,其中包括2条外引物F3/R3以及2 条内引物FIP/RIP。引物由英潍捷基(上海)贸易有限公司合成(表1)。
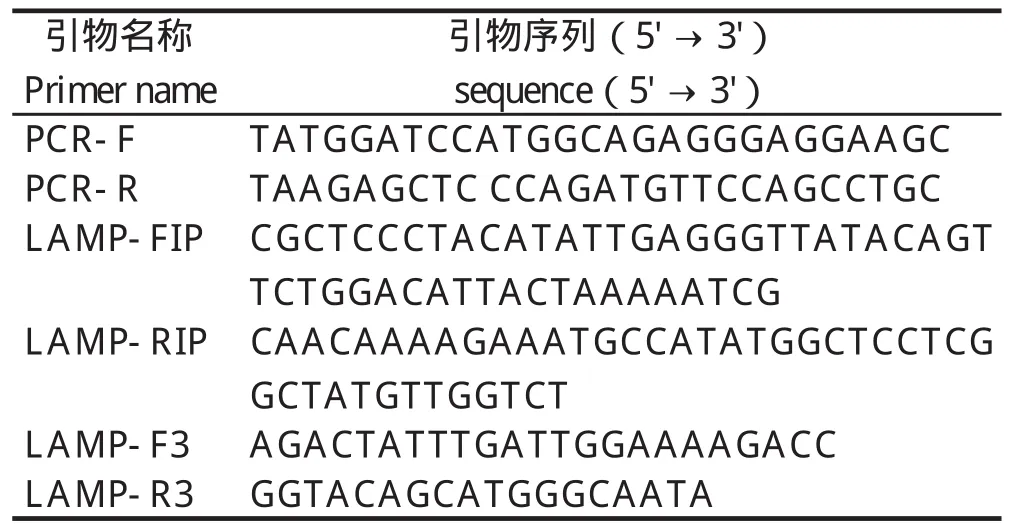
表1 引物序列Table 1 Primer Sequences
1.4 病毒核酸的提取 参照上海生工柱式病毒抽提纯化试剂盒说明书,分别提取番鸭细小病毒(MDPV)、鸭肝炎病毒(DHV)、新城疫病毒(NDV)、小鹅瘟病毒(GPV)和鸭瘟病毒(DPV)的基因组,将DHV和NDV的RNA反转录为cDNA,所有DNA/cDNA置于-80℃保存备用。
1.5 LAMP反应体系的建立及优化
1.5.1 反应体系的优化 在总反应体系25 μL,模板1 μL的条件下,依次对LAMP反应体系中的镁离子浓度、引物浓度、dNTPs浓度、甜菜碱浓度进行优化,具体浓度比例如下:镁离子浓度为3.5、4.0、4.5、5.0、5.5、6.0 mmol/L;内引物浓度为0.8、1.2、1.6、2.0、2.4、2.8 μmol/L;dNTPs浓度为0.8、1.0、1.2、1.4、1.6、1.8 mmol/L;甜菜碱浓度为0.2、0.3、0.4、0.5、0.6、0.7 mmol/L。反应液均在冰盒上配制,轻轻混匀后瞬时离心,于65℃恒温水浴锅中反应90 min,反应结束后取10 μL反应液进行1.5% 琼脂糖凝胶电泳,观察结果。
1.5.2 最佳反应温度的确定 优化后的反应体系分别在60℃、61℃、62℃、63℃、64℃、65℃温度下进行反应,结束后吸取10 μL反应液进行1.5%琼脂糖凝胶电泳,观察结果。
1.5.3 最佳反应时间的确定 优化后的反应体系分别反应15、30、54、60、75、90 min,结束后吸取10 μL反应液进行1.5% 琼脂糖凝胶电泳,观察结果。
1.6 PCR方法的建立 以提取的MDPV核酸为模板,采用引物PCR-F / PCR-R(见表1)进行VP3基因扩增。PCR反应体系为25 μL:2×LAMP Master Mix(含染料)12.5 μL、核酸模板1 μL、上下游引物各1 μL、ddH2O 9.5 μL。PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,50℃退火30 s,72 ℃延伸35 s,共30个循环;72℃终延伸5 min。
1.7 LAMP的灵敏性检验 将抽提的MDPV核酸模板进行10 倍梯度稀释,最终为1×103、1×102、1×101、1×100、1×10-1、1×10-2、1×10-3、1×10-4ng/μL,分别以各稀释度核酸DNA作为模板,按照前期优化好的LAMP检测方法进行灵敏性试验。同时取各稀释度的核酸模板进行PCR检测,比较两者的灵敏性。
1.8 LAMP的特异性试验 分别以MDPV、DHV、NDV、GPV和DPV的DNA/cDNA为模板,利用本研究建立的LAMP进行检测,扩增产物经1.5% 琼脂糖凝胶电泳分析。
2 结果
2.1 LAMP反应条件的优化结果 通过对反应体系的调整优化,最终确定LAMP反应体系为25 μL:8 U/μLBstDNA聚合酶、2.5 μL 10×Bst buffer、4 μL 25 mmol/L MgSO4、2 μL 20 μmol/L FIP/RIP、0.5 μL 20 μmol/L F3/R3、2 μL 25 mmol/L dNTPs、2 μL 5 mol/L 甜菜碱、1 μL 模板DNA,加ddH2O补足至25 μL;63℃反应60 min为最优反应条件(图1)。
2.2 LAMP方法灵敏性检测 以提取的MDPV核酸为模板,PCR扩增部分VP3 基因序列,电泳结果显示在900 bp左右可见一清晰条带,与预期相符(图略)。所建立的LAMP方法对MDPV DNA的最低检测限为1×10-2ng/μL(图2A),与建立的PCR方法相同(图2B)。

图1 LAMP反应体系的优化Fig.1 Optimization of LAMP reaction system
2.3 LAMP方法特异性试验结果 利用建立的LAMP方法分别对MDPV、DHV、NDV、GPV和DPV的DNA/cDNA模板进行检测,扩增结果如图3。结果显示,建立的LAMP仅对MDPV扩散出特异性条带,其他均为阴性。

图2 PCR(A)和LAMP(B)方法检测MDPV的灵敏性比较Fig.2 Sensitivity analysis of LAMP assay(A) and PCR assay(B) for MDPV

图3 LAMP方法检测MDPV的特异性Fig.3 Specifi city of LAMP assay for MDPV
3 讨论
近年来,番鸭细小病毒病的发病率呈逐年上升趋势,对养鸭业的危害日益严重。但是,目前尚无针对本病的特异性治疗方法,尽快发现并隔离病鸭或带毒鸭,提早预防是控制疫情的有效方法。因此,建立一种快速简便的诊断方法显得尤为重要。
本研究通过对MDPV的VP3基因保守序列的分析,利用LAMP引物设计软件设计了一组特异性的引物,对反应体系及反应条件进行逐一优化调整,建立了MDPV的LAMP快速检测方法。从病料处理、核酸提取、等温扩增到最终结果判定可在1.5 h内完成,与PCR和荧光定量PCR相比,用时缩短了一半以上,更加适应临床一线对快速检测的需要。LAMP所用BstDNA聚合酶在恒温条件下具有核酸扩增作用,有效避免了Taq酶在反应过程中必须精确升降温的弊端。
综上所述,本研究建立的LAMP检测方法具有灵敏、特异、简便、快捷等特点,适用于野外或临床一线的快速检测。同时,也为其他相关病原的检测提供了新的思路和方法。
