鸭疫里默氏杆菌对鸭胚肝细胞粘附入侵能力的研究.
2019-06-11薛亚飞宫艳杉祁晶晶卜慧敏杨永胜陈妍高萌萌胡青海
薛亚飞,宫艳杉,祁晶晶,卜慧敏,杨永胜,陈妍,高萌萌,胡青海
(中国农业科学院上海兽医研究所,上海 200241)
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)主要侵害鸭,也可感染鹅、火鸡等禽类,有研究报道从呈渗出性肺炎的病猪肺脏中也分离到RA[1]。RA引起的鸭传染性浆膜炎,是一种高致病性、接触性的传染病,感染鸭呈急性或慢性败血症,特征性的病理变化有纤维素性肝周炎、气囊炎、心包炎、脑膜炎等。RA感染发病率可达10%~60%,死亡率为30%~90%,是严重危害养鸭业的传染病之一[2]。
目前对RA哪些蛋白参与其对宿主细胞的粘附和入侵等致病机制还知之甚少。本实验室前期以细菌感染Vero细胞作为感染模型来分析RA对宿主细胞的粘附和入侵能力[3],但Vero细胞不是RA感染的自然宿主细胞,用其分析RA的粘附和入侵能力可能与细菌感染自然宿主的细胞有所差异。因此,本研究制备了RA感染鸭的靶器官细胞-肝细胞(鸭胚肝原代细胞),比较了RA野生株Th4株与ompA基因缺失株和回复株对鸭胚肝细胞和Vero细胞的粘附和入侵能力。
1 材料和方法
1.1 菌株与质粒RATh4株由本实验分离、鉴定并保存;RAompA基因缺失株Th4ΔompA由本实验室构建[3];E. coliDH5α感受态细胞购自天根生化科技(北京)有限公司;大肠杆菌-鸭疫里默氏杆菌穿梭表达质粒pRES1由本实验室构建并保存。
1.2 缺失株Th4ΔompA回复株的构建 以提取的RATh4株基因组DNA为模板,用PCR扩增Th4株ompA基因的ORF(compA-F:GCTAGACTCGAG ATGAAAAATCTAAAATTAGGAATTTCAGCA;compA-R: GCTAGGCATGCAGGACGCTTTTCTA TTTAAGATTA),PCR产物连入pGEM-T easy载体后测序,得到T-ompA。用XhoI和SphI双酶切T-ompA,回收目的片段,再与经同样双酶切的穿梭表达载体pRES1连接,构建得到互补质粒pRES1-ompA。以大肠杆菌S17-1(pRES1-ompA)为供体菌,RA基因缺失株Th4ΔompA为受体菌,采用双亲本接合转导的方法将回复质粒导入缺失株中,用含卡那霉素50 μg/mL、红霉素2 μg/mL的TSA平板进行筛选。用PCR分别扩增ermF基因、RA的16S rRNA基因和ompA基因,利用Western blot检测OmpA的表达进行鉴定。基因型为16S rRNA+ermF+ompA+的接合子克隆为ompA基因缺失株的回复株,命名为cTh4ΔompA。
1.3 鸭胚肝原代细胞的制备 取15~18日龄鸭胚,无菌取出肝脏组织于培养皿中,PBS清洗3次后剪至糜状,然后用胶原酶IV置于37℃消化10 min,1000×g离心,弃上清,沉淀用DMEM重悬,重复3次,最后1次离心完毕以后,用William’s培养基重悬沉淀,用Cell Strainer过滤以后平铺于24孔板,置于37℃、5% CO2培养箱中培养。
1.4 鸭疫里默氏杆菌Th4、Th4ΔompA、cTh4ΔompA对鸭胚肝细胞的粘附与入侵
1.4.1 细菌粘附能力测定 待细胞在孔内长至90%单层,用DMEM培养基洗3次;每孔加200 μL新鲜菌液(2×107CFU/mL),200×g离心5 min,置于37℃、5% CO2培养箱中培养1.5 h;用DMEM培养基洗3次,每孔加200 μL 0.25%胰蛋白酶,37℃消化10 min,再加入800 μL DMEM培养基,用移液器反复吹至鸭肝细胞悬浮,10倍系列稀释后,每个稀释度各取100 μL涂布TSA 琼脂平板,置于37℃、5%CO2培养箱中培养24~36 h后,进行菌落计数。
1.4.2 细菌入侵能力测定 24 孔板中每孔加入200 μL 细菌孵育1.5 h,洗涤后再加入含有庆大霉素(100 μg/mL)的DMEM培养基1 mL,继续在37℃、5%CO2培养箱中培养1 h。用DMEM培养基洗3次,同上加胰酶消化,稀释后涂TSA琼脂平板进行菌落计数。粘附和入侵试验均重复3次。
1.5 鸭疫里默氏杆菌Th4、Th4ΔompA、cTh4ΔompA对Vero细胞的粘附与入侵 待24孔板中新鲜培养的Vero细胞长至90%单层时,用DMEM培养基洗3次,每孔加200 μL稀释好的新鲜菌液(1×107CFU/孔),200×g离心5 min,然后置于37℃、5% CO2培养箱中培养1.5 h,用DMEM培养基洗3次。细菌的粘附与入侵试验同上述1.4步骤,同样也各重复3次。
2 结果
2.1 缺失株Th4ΔompA回复株的构建及鉴定 采用PCR从鸭疫里默氏杆菌Th4野生株中扩增ompAORF,克隆至T载体并测序,再连入大肠杆菌-鸭疫里默氏杆菌穿梭表达载体pRES1,构建得到互补质粒pRES1-ompA。然后用接合转导的方法将质粒pRES1-ompA转入缺失株Th4ΔompA中,得到缺失株的互补菌株cTh4ΔompA。ermF和ompA基因扩增结果为阳性,说明互补质粒pRES1-ompA已成功导入Th4ΔompA缺失株内,16s rRNA基因扩增结果为阳性说明该菌株为RA,互补株cTh4ΔompA已构建成功(图1和图2)。
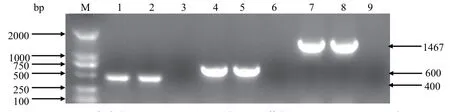
图1 缺失株Th4ΔompA的互补菌株cTh4ΔompA的PCR鉴定Fig. 1 Identifi cation of the complemented strain cTh4ΔompA by PCR
2.2 鸭疫里默氏杆菌Th4、Th4ΔompA、cTh4ΔompA对鸭胚肝细胞的粘附与入侵能力 比较鸭疫里默氏杆菌Th4株、基因缺失株Th4ΔompA以及互补株cTh4ΔompA在接菌比为100∶1的情况下对鸭肝细胞的粘附入侵能力。应用GraphPad Prism软件进行分析,P<0.05作为差异具有统计学意义的标准。结果表明,与野生株Th4株相比,缺失株Th4ΔompA对鸭胚肝细胞的粘附和入侵能力分别降低了3.32倍和2.25倍,差异具有显著统计学意义(P<0.05);互补株cTh4ΔompA相对于Th4ΔompA粘附和入侵能力均明显回复(图3A和3B)。

图2 互补株cTh4ΔompA中OmpA蛋白的表达Western blot检测Fig. 2 Detection of the expression of OmpA in the complemented strain cTh4ΔompA by Western blot
2.3 鸭疫里默氏杆菌Th4、Th4ΔompA、cTh4ΔompA对Vero细胞的粘附与入侵能力 比较鸭疫里默氏杆菌Th4株、基因缺失株Th4ΔompA以及互补株cTh4ΔompA在接菌比为100:1的情况下对Vero细胞的粘附入侵能力,应用GraphPad Prism软件进行分析,P<0.05作为差异具有统计学意义确立的标准。结果表明,与野生株Th4株相比,Th4ΔompA对Vero细胞的粘附和入侵能力都显著下降,差异具有显著统计学意义(P<0.05);回复株cTh4ΔompA相对于Th4ΔompA粘附和入侵能力均显著地回复(图4A和4B)。另外,从图3和图4可看出,在相同的接种量和感染比时,野生株Th4、缺失株Th4ΔompA和互补株cTh4ΔompA对鸭胚肝细胞的粘附和入侵能力(细胞数)均高于Vero细胞。
3 讨论
粘附是病原微生物感染宿主细胞的第一步。病原微生物首先粘附到宿主细胞,随后定植,从而发挥一系列的致病作用。对于病原微生物感染早期,粘附更是非常关键的一步。粘附的过程一般可以分为两步[4-6],第一步是非特异性的,病原微生物借趋化作用接近宿主细胞表面,然后两者借助静电荷及疏水力结合;第二步是特异性的,病原微生物表面粘附素进一步与相应特异性受体结合。细菌的粘附作用被认为是通过粘附素来实现的[7]。细菌粘附宿主细胞的过程比较复杂,并不只是一种粘附素或少数几个分子发挥作用,常常是不同的粘附素与不同的宿主细胞表面受体相结合,所以一种细菌通常具有多种粘附素。Hu 等[3]通过同源重组的方法构建得到了RA血清2型Th4株的ompA基因缺失株Th4ΔompA,并且通过研究发现Th4ΔompA对Vero细胞的粘附入侵能力较亲本株显著下降,推测得出OmpA是RA的一种粘附因子。本研究中RA对鸭胚肝细胞和Vero细胞的粘附入侵试验结果也进一步佐证了这一推测。

图3 Th4、Th4ΔompA、cTh4ΔompA对鸭胚肝细胞的粘附(A)和入侵(B)能力比较Fig.3 The adherence and invasion capacity of R. anatipestifer strains Th4, Th4ΔompA and cTh4ΔompA to duck embryo liver cells
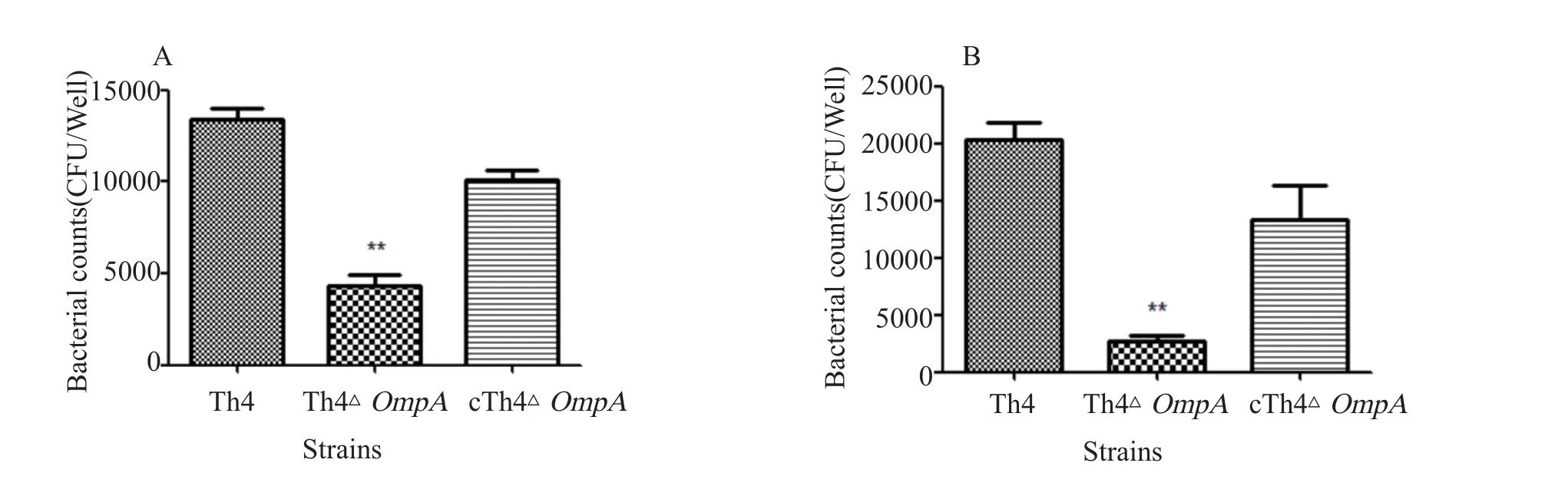
图4 Th4、Th4ΔompA、cTh4ΔompA对Vero细胞的粘附(A)和入侵(B)能力比较Fig.4 The adherence and invasion capacity of R. anatipestifer strains Th4, Th4ΔompA and cTh4ΔompA to vero cells
与Vero细胞相比,RA对鸭胚肝细胞粘附入侵的数量都有所增加,这可能是由于鸭是RA的自然感染宿主,且肝脏是其感染的靶器官之一。这也是本研究选取鸭肝细胞作为细胞模型来研究RA粘附入侵宿主的主要原因。以往的研究多选用重复性好,易培养的传代细胞系(如Vero细胞和Hela细胞等)作为细菌体外模拟粘附入侵的细胞模型,这些细胞系多为来自肿瘤细胞的无限繁殖细胞系。近年来,各实验室也在不断探索使用靶细胞作为粘附入侵的感染模型。王栋等[8]应用鸡胚成纤维细胞作为禽致病性大肠杆菌的细胞感染模型,通过构建evfC的基因缺失株和互补株,证明VI型分泌系统2的核心组分evfC基因对禽致病性大肠杆菌的粘附和侵袭没有影响。李玲[9]以鸭胚成纤维细胞作为细胞模型,证明RA能够粘附入侵鸭胚成纤维细胞(duck embryo fibroblast,DEF),并且诱导DEF细胞死亡。用细胞松弛素B、秋水仙素处理细胞后,可显著抑制RA对DEF细胞的侵袭,证明RA对DEF的侵袭过程有赖于细胞骨架的重排。采用不同浓度蛋白酶K对细菌进行处理,可显著抑制RA的黏附力,表明RA的黏附需要细菌蛋白的参与。由于RA主要感染肝脏组织,因此本研究用鸭胚肝原代细胞取代Vero细胞来分析RA对宿主细胞的粘附和入侵能力,结果表明与鸭成纤维细胞相比,采用靶器官肝脏细胞能更好地模拟RA感染鸭体内(肝脏)的情况,为进一步研究RA的致病机制提供了一种有效的手段。
