反相高效液相色谱法测定 人血浆中卡马西平浓度及其临床应用
2019-06-06谢燕如杨红梅莫小兰陈怡禄
谢燕如 黄 璞 和 凡 杨红梅 莫小兰 陈怡禄*
卡马西平(CBZ)是临床上常用的情感稳定剂之一[1],结构式见图1。CBZ 对精神运动性发作最佳,应用于局限性大发作和混合型发作治疗效果显著[2],是临床治疗儿童神经运动性发作时首选用药[3]。此外CBZ 也可用于脊髓痨和多发性硬化、糖尿病性周围性神经痛、患肢痛和外伤后神经痛以及疱疹发作神经痛。口服CBZ 在人体内吸收缓慢并且不规则,个体差异较大,1~2 周内基本达到稳态血药浓度[4]。CBZ 的疗效和不良反应与血药浓度成正相关,单纯依靠临床观察,很难判定疗效或毒性[5-6]。患者个体 生理特性、病理状况和CBZ 代谢酶活性等方面的差异也会导致药动学参数如表观分布容积(Vd)、峰浓度(Cmax)及达峰时间(Tmax)、清除速率(CL)和药-时曲线下面积(AUC)等不同[7-8]。同时CBZ 为肝药酶诱导剂,能发生自身诱导作用,长期使用其半衰期(t1/2)下降,导致药效减弱和耐药性增加;并且CBZ 治疗窗较窄,有效血药浓度为4~12 µg/ml[4]。因此为了方便评价CBZ 疗效和制订个体化给药方案,对CBZ 进行治疗药物监测(therapeutic drug monitoring,TDM),保障患者用药安全和有效具有积极的临床参考价值[2]。本研究参照已发表的文献[2-10],建立了一种可靠、稳定、快速和准确的方法测定人血浆中CBZ 浓度,以应用于临床血药浓度监测。CBZ 在286 nm 处有较佳紫外吸光度。见图2。
图1 CBZ 结构式
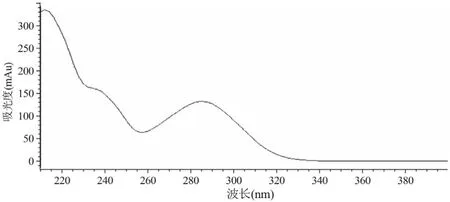
图2 CBZ 在190~400 nm 范围内DAD(UV)扫描图谱
1 仪器与试剂
1.1 仪器
高效液相色谱仪(Agilent 1260),包括四通道脱气机G1366A、四通道自动调配器G1366C、定量环为1~100 µl 自动进样器G1339B、温度控制模块G1336B、二极管阵列紫外检测器(DAD)G4216C、可调柱温恒温箱G1316B 和Agilent 色谱化学分析工作站。其他相关配置仪器:普通离心机(上海医科大学仪器厂);高速离心机(15000 r/min 美国EPPENDORF);旋涡混合振荡器(河北安新仪器厂);真空干燥箱(中德合资MMM-GROUP);电子天平(精确度为十万分之一,德国SARTORIUS);小型超纯水仪(法国MILLIPORE);超声清洗仪(河北安新仪器厂)。
1.2 实验用对照品
CBZ 对照品(Sigma 生物制品公司,批号:SL136523803,规格:99%);内标对照品多潘立酮(Sigma 生物制品公司,批号:CF132726915,规格:>99%)。
1.3 试剂与试药
色谱级甲醇(德国默克股份两合公司,批号:10947807815);色谱级乙腈(德国默克股份两合公司,批号:10965807832);色谱级提取剂乙酸乙酯(德国默克股份两合公司,批号:10953267213);水为超纯水仪处理后的去离子水,2 ml 和1.5 ml 的EP 离心管(浙江拱东医疗科技有限公司),其他试剂均为色谱级。
2 方法与结果
2.1 对照品和内标物的称量及工作液的配制
用电子分析天平精密称取CBZ 10.0 mg,置于10 ml 棕色容量瓶中,加3 ml 甲醇振荡溶解后再加甲醇定容至10.0 ml 刻度线,得到1.0 mg/ml 对照品工作母液,放置-20℃冰箱保存。用电子分析天平精密称取内标物多潘立酮10.0 mg,置于10 ml 棕色容量瓶中,加3 ml 甲醇振荡溶解后再加甲醇定容至10.0 ml 刻度线,得到1.0 mg/ml 内标物工作母液,放置-20℃冰箱保存,使用时用甲醇稀释成浓度为200.0 µg/ml 的内标液。
2.2 色谱条件
色谱柱:ZORBAX Eclipse Plus-C18 反相色谱柱(150 mm×4.6 mm,5 µm);流动相:去离子水∶乙腈∶甲醇(30∶10∶60);流速:1.0 ml/min;柱温:35 ℃;检测波长:288 nm;步进值2 nm,带宽4 nm;仪器灵敏度:0.01 AUFS;色谱柱柱效参数:理论塔板数12600。
2.3 血浆样品前处理
吸取0.4 ml 含CBZ 血浆加至2 ml EP 离心管中,精确加入200.0 µg/ml 内标液20 µl,置振荡器上涡旋数十秒。再加提取剂乙酸乙酯1.5 ml 左右,密塞,涡旋振荡3 min,置于高速离心机(15000 r/min)内离心5 min。将上清液移取至1.5 ml EP 离心管内,最后放进干燥箱,35 ℃真空抽干。检测时吸取100 µl流动相复溶提取物,置于高速离心机内离心2 min,吸上清复溶物进样,设置进样体积为10 µl。
2.4 色谱分离效果
在“2.2 和2.3”实验条件下,空白血浆样品、空白血浆加CBZ 对照品和内标物以及患者服用CBZ达稳态时血浆样品,经HPLC 测定,得到一系列色谱图(图3)。图A 是空白血浆按“2.3”项下操作后所得到的色谱图;图B 是空白血浆加内标和CBZ 对照品按“2.3”项下(浓度均为10.0 µg/ml)处理后所获得的色谱图;最后图C 是1 例患者服用CBZ(300 mg/d)达稳态时血清样品处理后的色谱图。从图3可看到,内标物和CBZ 的色谱峰可以完全分离(分离度R>1.5),没有其他杂质峰干扰,由此可见本方法具有较好的专属性。内标和CBZ 保留时间分别为3.758、5.836 min。
2.5 干扰性试验
临床上CBZ 通常与其他情感稳定剂合用治疗癫痫或情感障碍患者,本实验取与CBZ 常联合使用的药物拉莫三嗪、丙戊酸钠、乙酰唑胺、氯氮平、奥氮平、地西泮、氯硝西泮等适量,依照上述色谱条件下进行色谱分析,结果显示上述药物的色谱峰均不干扰CBZ 与内标物的分离。
2.6 校正曲线的设计和线性关系
在7 个2 ml EP 离心管中分别加入不同浓度、体积相同的CBZ 对照品工作液20.0 µl,置于干燥箱内,35 ℃真空抽干后加空白血浆0.4 ml,旋涡振荡数十秒,配置成分别相当于1.0、2.0、4.0,8.0、16.0、32.0、48.0 µg/ml 的血浆CBZ 浓度,然后按“2.3”方法处理。经HPLC 分析后,将检测得到CBZ 峰面积与内标物峰面积的比值(F)为纵坐标,以血浆样品相对应各点CBZ 浓度(C)为横坐标拟合校正曲线。应用加权最小二乘法对数据进行线性回归,权重W =1/χ2,使用权重可以减小低浓度的误差[11]。处 理数据后得到CBZ 1.0~48.0 µg/ml 的校正曲线;线性方程为:C =40.538F-0.018,相关系数(r)=0.9998,可见CBZ 在此浓度范围线性关系优良(见图4)。当 信号与躁音比值(信躁比)等于3 时,CBZ 的检测限可达到0.5 µg/ml。
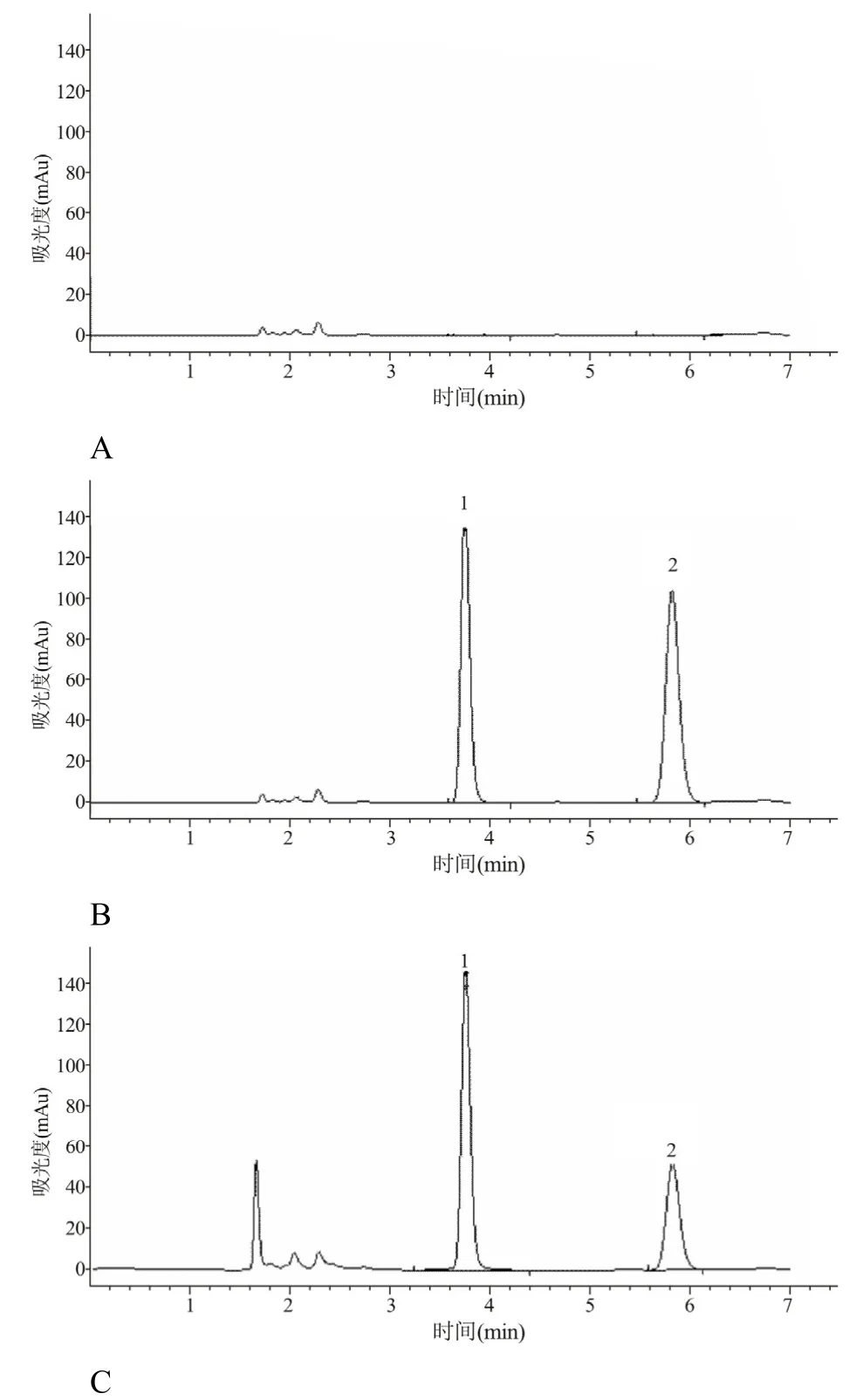
图3 CBZ 的高效液相色谱图
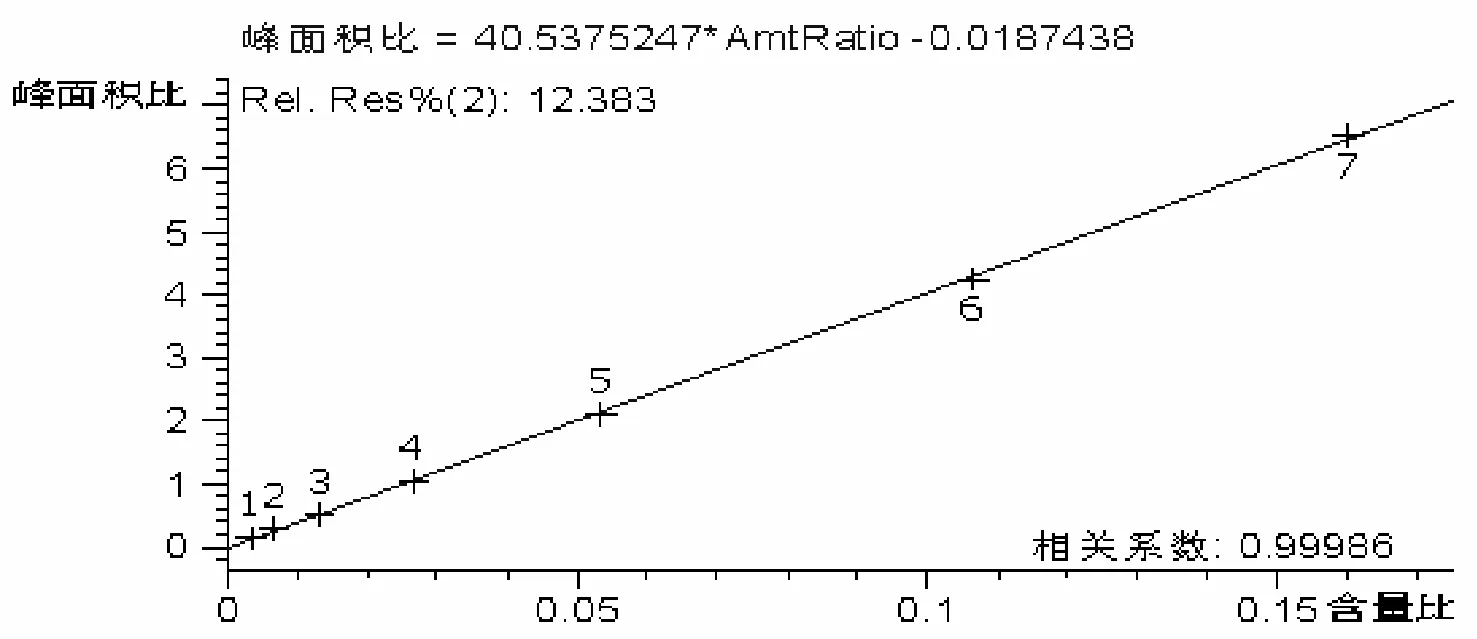
图4 CBZ 的校正曲线
2.7 回收率和精密度实验
按“校正曲线设计”方法配制CBZ 低、中、高不同质量浓度(2.0、8.0、32.0 µg/ml)的血浆样品,按“2.3”方法处理后,经色谱检测后进行分析。以经过血浆基质提取后的峰面积与同浓度对照品直接进样的峰面积比较,计算提取回收率[12];而CBZ 低、中、高不同质量浓度(2.0、8.0、32.0 µg/ml)的峰面积与其在校正曲线上所得峰面积比较计算相对回收率[12]。计算结果显示相对回收率接近100%;提取回收率在75%以上。而精密度则是在1 天之内反复5 次和1 周内反复5 次测定其质量浓度,计算批内、批间精密度和方法回收率[12]。结果显示,本实验方法符合中国药典关于人体内“生物样品定量分析方法验证指导原则”的要求[12](表1)。
2.8 CBZ 血样稳定性考察
按“校正曲线设计”方法分别配制低、中、高3 个不同质量浓度(2.0、8.0、32.0 µg/ml)的血浆样品36 个,每个浓度各12 个。首先室温放置0、12 h 后检测,然后在-20℃冰箱冻存24 h、72 h 后进行测定,最后在-20℃冰箱冻存1 周和3 周后再进行色谱分析,统计结果发现RSD 均小于10%(表2),CBZ室温和冻存样品的药物降解符合中国药典关于人体内药物分析的要求[11]。
2.9 CBZ 血浆样品质量控制(quality control,QC)
按“校正曲线设计”方法分别配制低、中、高3 个不同质量浓度(2.0、8.0、32.0 µg/ml)36 个含药血浆样品,每个浓度各12 个,置于-20℃的低温冰箱 冻存,定为质控(QC)样品。每次进行血样标本检测时,标本和QC 样品的处理都采用平行操作原则,检测时将QC 样品均匀分散在待测样品中间,测定结束后先对6 个QC 样品进行分析,6 个QC 样品中只允许2 个不符合要求,且同一浓度的2 个QC 不能同时失控,计算结果的偏差符合中国药典关于体内药物分析的要求,则可认定本次检测结果正常有效[11];相反如果QC 结果偏差超出中国药典要求,则此次检测为失控,所得数据不准使用[11]。在实验操作步骤和仪器性能都正常的情况下,待测标本和QC 样品需重新处理进行检测,直到QC 结果符合要求所测数据才可正常使用。
2.10 临床应用
临床实例检测13 例使用CBZ 患者,患者来自本院门诊或住院部,口服CBZ 普通片剂(北京诺华制药集团有限公司,批号:X13282,规格:200 mg/片)。患者服用剂量从每天100 mg 起,临床根据病情需要调整使用量,待患者病情控制稳定且用药时间超过一周时,早上用药前采血检测其CBZ 稳态血药谷浓度,所得结果见表3。
3 讨论
3.1 建立检测方法的意义
随着国家经济快速发展和人们生活水平不断提高,以及互联网的高速发展,患者/或家属对药品的认知越来越专业。而医院方面对患者用药安全也日益重视,以TDM 方向的药学保障服务成为临床药学重点之一,实验室开展TDM,改变了医师单凭感觉或经验用药的方法及药物治疗理念[13]。另外由于抗癫痫药物使用时间较长、毒副反应较强、安全治疗窗小、个体间差异大,临床上单凭过往经验用药很难达到理想的治疗效果[13],有时甚至会出现药物过量或中毒情况。因此患者在服用CBZ 等抗癫痫药时进行定期的TDM 很有必要,根据监测结果来调整给药方案,既保障患者用药安全又大大减少临床用药的盲目性,因此开展TDM 来制定个体化用药方案,提高合理用药水平具有很好的现实意义和临床意义。
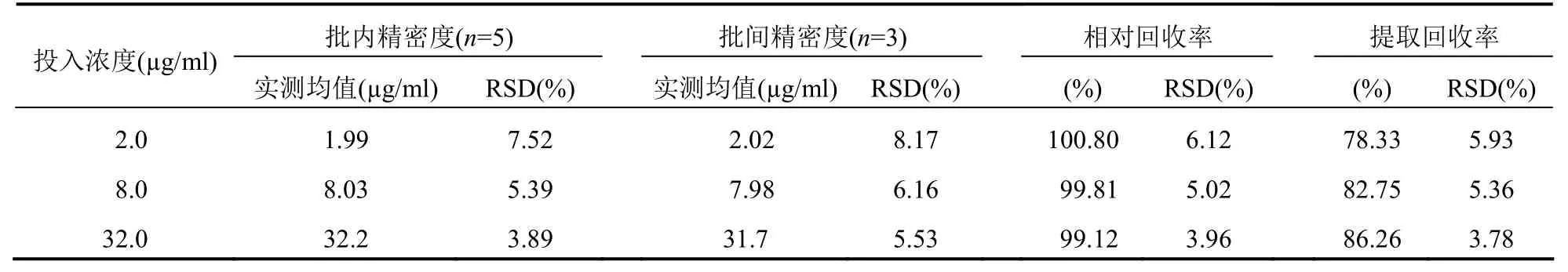
表1 不同质量浓度CBZ 的精密度与回收率
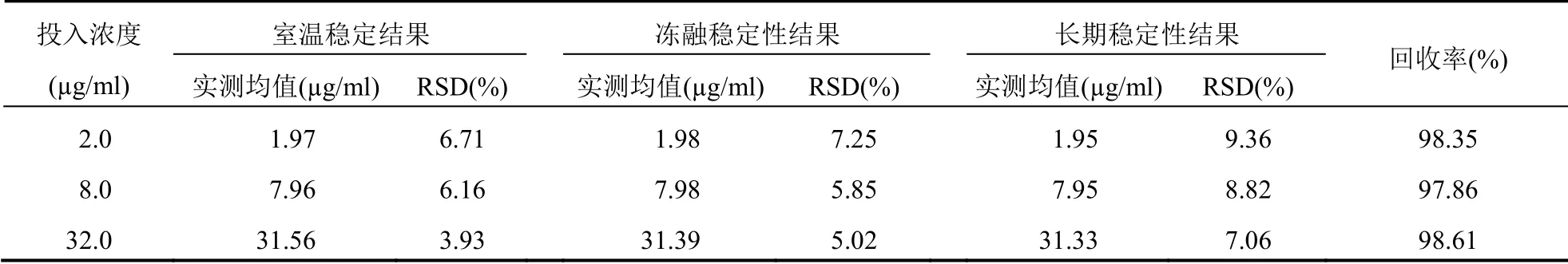
表2 不同质量浓度CBZ 在人血浆中的稳定性(n=5)
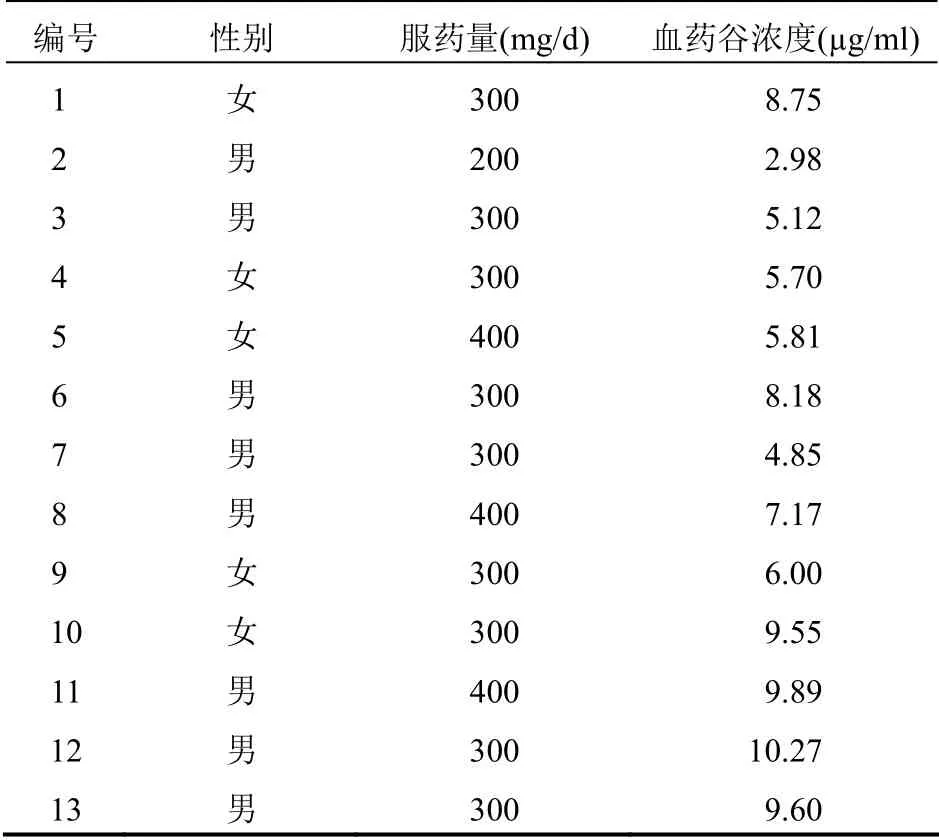
表3 13 例患者服用CBZ 后稳态血药谷浓度
3.2 本实验方法的优点
CBZ 结构式中有二个苯环,有很强紫外吸收。CBZ 在286 nm 处有较佳紫外吸收,因此本实验检测波长定为286 nm,目的是提高定量下限(Lower limit of quantitation LLOQ)的响应值和减小LLOQ 的偏差,对校正曲线的拟合(线性关系)有积极影响。其次关于CBZ 的测定,相关报道有酶联免疫法(EMIT)、荧光偏振免疫法(FPIA)[6],这些方法需要使用试剂盒,检测成本高,不便普及;也有蛋白沉淀方法[6],而此虽然操作简单,但血浆组份内源性杂质多,检测干扰大。有报道采用外标法,由于基质效应影响,准确度不稳定,偏差较大,难于达到实验要求[6]。本实验选择液-液提取法,具有操作简单、方法可靠、快速检测(7 min 内完成色谱分离)以及成本低廉、结果准确、精密度和回收率高等亮点;平均相对回收率接近100%,提取回收率在75%以上,而且校正曲线线性关系优良,专属性高,批内、批间精密度和稳定性考察结果的RSD 均<10%,符合临床生物样品检测分析方法的基本要求[11]。
3.3 校正曲线的范围的确定和提取剂的选择
CBZ 治疗窗仅为4~12 µg/ml[3],因此本实验方法设计的校正曲线符合CBZ 的常规监测。另外本实验过程中曾分别使用乙醚、正已烷、乙酸乙酯和氯仿为提取剂,发现乙酸乙酯的提取率最理想,且对人体毒性小。采用此提取剂只需一次提取便可达到检测要求,用流动相复溶后再进行离心,目的是为了减少提取物中的杂质对色谱柱的影响,对延长色谱柱的使用寿命有积极影响,同时所取血浆只需0.4 ml,进样量10 µl 便可达到检测要求,大幅度减少了样品杂质峰的干扰。
