金钗石斛原球茎及幼苗快速繁殖体系的构建
2019-06-05叶庆生
黄 晶, 叶庆生
(1.广东生态工程职业学院, 广东 广州 510520; 2.华南师范大学 生命科学学院, 广东 广州 510631)
金钗石斛(DendrobiumnobileLindl)是我国重要的传统名贵中药材,具益胃生津、滋阴清热等功效,对心血管、消化系统、呼吸系统及眼科疾病有明显的辅助治疗作用[1-2]。因其花色鲜艳、花姿优美而成为世界著名的观赏花卉。金钗石斛不仅具有重要的经济价值和较高的观赏价值,同时因其是软茎类石斛重要的育种亲本[3],因此还具有较高的科研价值。金钗石斛主要分布于我国台湾、海南、贵州、福建、湖南、湖北、广西、云南及四川等长江以南的亚热带地区[4],对生长环境要求较高,生长缓慢,自然繁殖率低,加上生态环境的恶化及长期过度采集,其野生资源日趋稀少[5]。作为国家重点保护野生药材珍贵品种,研究金钗石斛的种质保存、品种改良和快速繁殖技术在生产应用上具有重要作用,采用无性繁殖技术加快人工种苗的供给已成为当务之急。近年来,国内外对石斛的一些珍贵种类进行组织培养及商品化生产研究[6-8],但不同种或品种对萌发营养的需求存在较大差异。若想达到石斛兰的规模化、产业化发展目标,需要根据种类和预期达到的观赏目的有针对性地制定不同的组织培养方案。鉴于此,笔者采用组织培养方法研究金钗石斛原球茎及幼苗的快速繁殖体系。
1 材料与方法
1.1 供试材料
1.1.1 金钗石斛保存于华南师范大学生命科学院兰花中心。
1.1.2 试剂酒精、琼脂、蔗糖、1/2MS培养基、6-BA、NAA、IBA和活性炭(北京鼎国)。
1.2 试验方法
1.2.1 材料预处理取当年成熟且未开裂的蒴果,小刀切去果荚上有伤痕容易藏菌的部分后,用70%酒精浸泡5~8 min,灼烧后用解剖刀切开蒴果,得到无菌种子。将无菌种子均匀播散于1/2MS基本培养基上,添加琼脂0.7%,蔗糖2%,pH 5.6。种子转绿萌发但还未分化出顶芽时即得原球茎,原球茎分散在经高温灭菌的1%的琼脂溶液中,制成一定浓度的原球茎悬浮液备用。取33 mL培养基置玻璃瓶中,采用121℃灭菌20 min备用。
1.2.2 不同培养条件对原球茎增殖的影响采用3因素试验(表1),其中:A,培养基,固体(A1)和液体(A2)的1/2MS培养基,固体培养基再加琼脂0.7%;B,6-BA,浓度分别为0.5 mg/L、1 mg/L和2.0 mg/L;C,NAA,浓度分别为0.5 mg/L、1 mg/L和2.0 mg/L。每瓶培养基中按试验设计分别加入6-BA和NAA,然后再加入蔗糖2%,pH 5.6。每瓶培养基加入5 mL悬浮液(含原球茎约400粒),每个处理8瓶,3次重复。培养条件:光照强度50~60 μmol/(m2·s),光照时间 12 h/d,温度(25±2)℃(下同)。液体培养基需放在震荡培养箱上进行悬浮培养,转速120 r/min。增殖培养20 d后进行称重,观察培养基物理状态、不同激素浓度及配比对原球茎增殖和生长的影响。
表1金钗石斛原球茎增殖培养的试验方案
Table 1 Experimental scheme for proliferation culture ofD.nobile
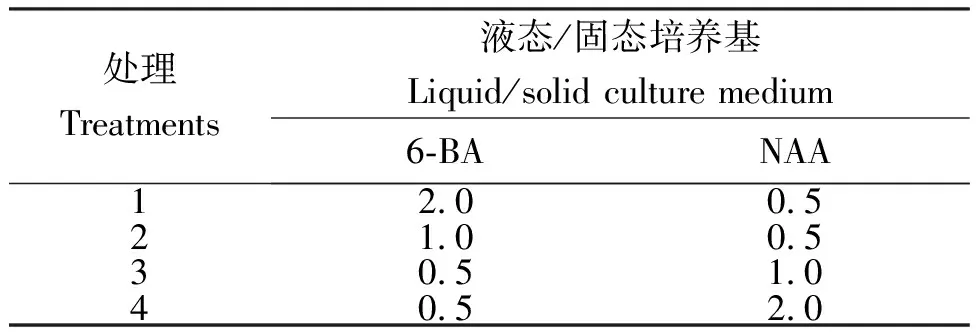
处理Treatments液态/固态培养基Liquid/solid culture medium6-BANAA12.00.521.00.530.51.040.52.0
1.2.3 不同培养条件对幼苗生长的影响种子在1/2MS固体培养基上萌发长出绿色的原球茎,将原球茎分瓶培养一段时间后,取刚刚长出顶芽且生长一致的原球茎进行幼苗生长培养条件的优化筛选。
1) 琼脂。试验设4个处理,即在1/2MS基本培养基中,蔗糖浓度为2%,琼脂浓度分别为0.5%、0.6%、0.7%和0.8%。
2) 蔗糖。试验设4个处理,即在1/2MS基本培养基中,琼脂浓度为0.7%,蔗糖浓度分别为1%、2%、3%和4%。
3) 椰汁。在1/2MS基本培养基中,琼脂浓度为0.7%,蔗糖浓度为2%,椰汁浓度分别为0、10%和20%,以未添加椰汁为对照(CK)。配好后的培养基pH 5.6。
取33 mL上述培养基于玻璃瓶中,将原球茎长成的幼苗每瓶接种5株,每个处理8瓶,3次重复。每月更换培养基,记录幼苗生长情况。3个月后统计小苗茎高、茎粗、叶片数、叶长、生根数、根长及根粗等指标,通过对试验结果进行统计分析筛选幼苗生长的最佳培养方案。
1.2.4 激素和活性炭对幼苗生根的影响原球茎在未添加椰汁和植物激素的1/2MS固体培养基中培养2个月,当苗生长达1 cm左右时,取生长一致、健壮的小苗进行生根培养条件的优化筛选。以1/2MS固体培养基为基本培养基,琼脂浓度0.7%,蔗糖浓度2%,pH 5.6。
1) NAA。设3个处理N1~N3,在培养基中加入NAA浓度分别为0.2 mg/L、0.5 mg/L和1.0 mg/L。以未添加NAA、IBA以及活性炭处理作对照(CK1)。
2) IBA。设3个处理T1~T3,在培养基中加入IBA浓度分别为0.2 mg/L、0.5 mg/L和1.0 mg/L。以未添加NAA、IBA以及活性炭处理作对照(CK2)。
3) 活性炭(AC)。设4个处理A1~A4,在培养基中加入活性炭浓度分别为0.2 g/L、0.5 g/L、1.0 g/L和2.0 g/L。以未添加NAA、IBA以及活性炭处理作对照(CK3)。
采用盛有33 mL培养基的玻璃瓶培养,每瓶5株,每个处理8瓶,3次重复。每45 d更换培养基,记录幼苗生长情况。3个月后,统计小苗生根数、根长和根粗,通过统计分析筛选幼苗生根的最佳培养方案。
1.3 数据分析
用EXCEL和SPSS数据处理软件对所有数据进行方差分析,并采用Duncan最小显著差数测验法进行多重比较。
2 结果与分析
2.1 不同培养条件原球茎的增殖培养
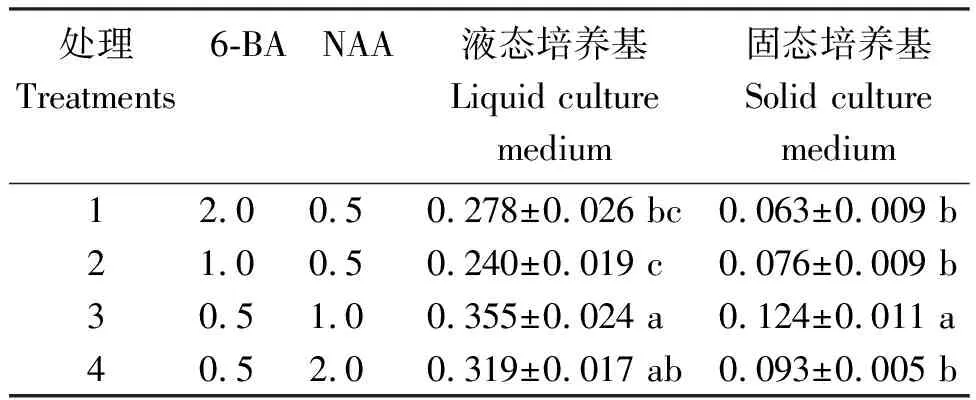
从图1可见,金钗石斛的种子呈淡黄绿色,播种4周后,胚膨大胀破种皮,长成绿色圆球茎。液体和固体培养基对原球茎生长有很大的影响,二者间差异极显著。液体培养基明显地促进原球茎的生长,在液体培养基中长成的原球茎体积约为固体培养基中的5~10倍,颜色嫩绿,虽然在摇床上培养,但仍能呈现形态极性,培养20 d后球茎顶端分化出芽,侧部突起产生第一叶原基;相比之下,固体培养基中的原球茎生长很慢,个体较小。从表2看出,不同激素浓度和配比对原球茎的生长也有影响。其中,固体培养基不同激素配比对原球茎生长的影响处理间差异较小,除处理3(即6-BA、NAA浓度分别为0.5 mg/L和1.0 mg/L)原球茎的生长显著优于其余3个处理外,其余3个处理间差异不显著;液体培养基不同激素配比对原球茎生长的影响处理间差异相对较大,各处理原球茎的生长量依次为处理3(即6-BA、NAA浓度分别为0.5 mg/L和1.0 mg/L)>处理4(6-BA、NAA分别为0.5 mg/L和2.0 mg/L)>处理1(6-BA、NAA分别为2.0 mg/L和0.5 mg/L)>处理2(6-BA、NAA分别为1.0 mg/L和0.5 mg/L),处理3原球茎的生长量最大,为0.355 g,显著高于处理1和处理2,处理4显著高于处理2。
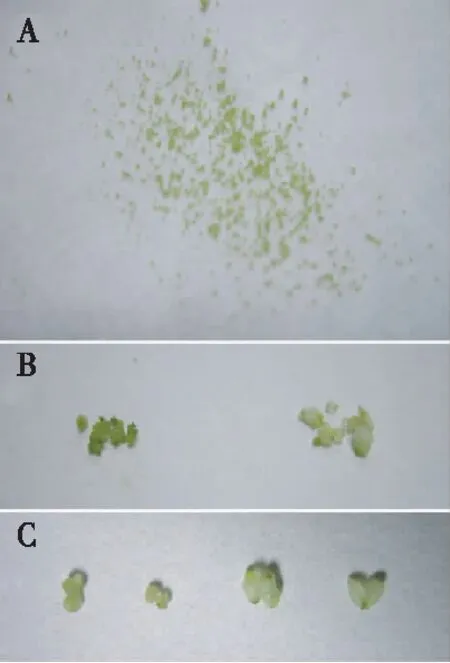
注:A,未进行增殖培养的原球茎;B,液体和固体培养基中进行增殖培养20 d后的原球茎(左边为固体培养基,右边为液体培养基);C,不同6-BA和NAA浓度的液体培养基中进行增殖培养20 d后的原球茎,从左到右6-BA、NAA浓度依次为2 mg/L和0.5 mg/L,1 mg/L和0.5 mg/L,0.5 mg/L和1 mg/L,0.5 mg/L和2 mg/L。
Note: A,protocorms before proliferation culture; B,protocorm after 20 days proliferation on liquid or solid culture medium (left,solid culture medium; right,liquid culture medium); C,protocorm after 20 days proliferation on liquid culture medium with different concentration of 6-BA/NAA,concentrations of 6-BA/NAA are 2/0.5,1/0.5,0.5/1 and 0.5/2 mg/L from left to right,respectively.
图 1不同培养条件金钗石斛原球茎的增殖状况
Fig.1 Proliferation ofD.nobileprotocorm in different culture conditions
表26-BA、NAA各浓度配比及不同培养基物理状态处理金钗石斛原球茎的生长
Table 2 Growth status ofD.nobileprotocorm with various 6-BA, NAA concentration ratio and physical condition of different medium
g
注:表中数据为平均值±标准误;同列不同小写字母表示P<0.05水平上的差异显著性。下同。
Note: Data in the table are average ± standard error; Values with different small letter in the same column have significant difference (P<0.05). The same below.
2.2 不同培养条件幼苗的生长
从表3看出,不同培养条件下金钗石斛幼苗生长存在一定差异。
2.2.1 琼脂培养基中添加不同含量的琼脂金钗石斛幼苗的生长存在差异。随着琼脂含量增加,金钗石斛幼苗的茎高、茎粗、叶数、叶长、生根数、根长及根粗均呈减少趋势。其中,当琼脂含量为0.5%时,培养基水分含量高,此时幼苗生长最快,培养3个月后其茎高、茎粗、叶长、生根数及根长分别为2.34 cm、0.288 cm、1.67 cm、5.25根和3.56 cm,均显著高于其余3个处理,且叶片生长快,颜色鲜绿,光泽度好。说明,琼脂浓度越低,培养基越软,越有利于金钗石斛幼苗茎叶和根的生长。
2.2.2 蔗糖培养基中添加蔗糖的浓度不同对金钗石斛幼苗茎和叶的生长影响不显著,但对根的生长有影响明显。当蔗糖浓度低至1%时,叶片生长较快,但水分含量高,植株较脆弱且有玻璃化的现象;当蔗糖浓度为2%时,其叶长为1.28 cm,显著高于其余3个处理;当蔗糖浓度升至4%时,叶的生长受阻,叶片短小,呈现一定的黄化状态。蔗糖浓度为2%或3%时,幼苗茎叶生长较好。随着蔗糖浓度增加,金钗石斛幼苗的生根数、根长及根粗均呈增加趋势,高浓度的蔗糖虽然抑制地上部分生长但却有利于根生长。蔗糖浓度为4%时金钗石斛幼苗的生根数、根长及根粗均最大,分别为6.38条、3.47 cm和0.100 cm,其生根数显著高于其余3个处理,根长及根粗显著高于浓度1%和浓度2%处理。综合茎、叶和根的生长考虑,金钗石斛幼苗培养最佳蔗糖浓度为3%。
2.2.3 椰汁培养基中添加椰汁对金钗石斛幼苗生长有很大的促进作用,即随着椰汁浓度升高,金钗石斛幼苗的茎高、茎粗、叶数、叶长、生根数、根长及根粗均呈增加趋势。相比对照而言,添加椰汁的培养基,金钗石斛幼苗生长更快。培养3个月后,20%椰汁培养基中幼苗的茎高、叶长、生根数和根长明显高于其余2个处理;其茎粗和叶数与10%椰汁处理差异不显著,但明显高于对照。

注:A,从左到右分别为培养3个月后琼脂浓度0.5%、0.6%、0.7%和0.8%培养基中的幼苗;B,从左到右分别为培养3个月后蔗糖浓度1%、2%、3%、4%培养基中的幼苗;C,从左到右分别为培养3个月后椰汁浓度20%、10%和0培养基中的幼苗。
Note: A,Seedling after 3-month culture on 0.5%,0.6%,0.7% and 0.8% agar culture medium from left to right; B,Seedling after 3-month culture on solid culture medium with sucrose concentration of 1%,2%,3% and 4% from left to right; C,Seedling after 3-month culture on solid culture medium with coconut juice concentration of 20%,10% and 0 from left to right.
图2不同培养条件金钗石斛幼苗的生长状况
Fig.2 Growth status ofD.nobileseedlings with different culture conditions
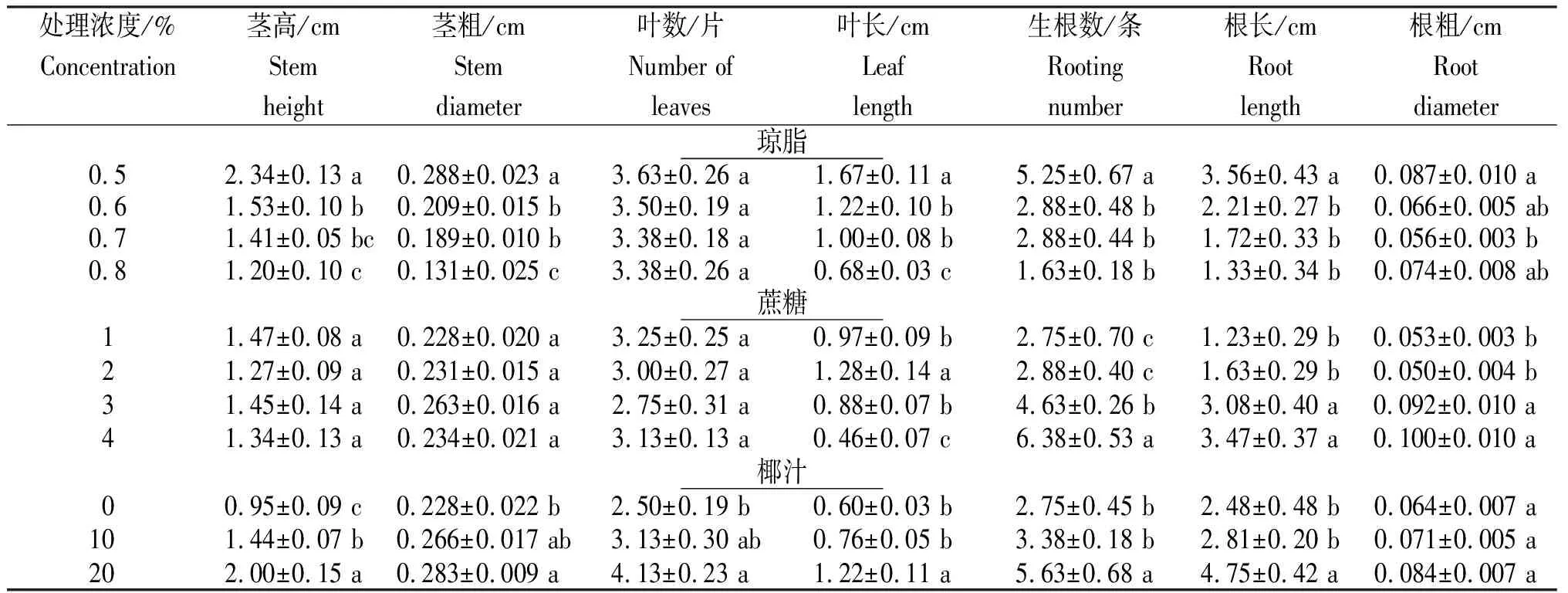
表3 不同培养条件金钗石斛幼苗的生长
2.3 激素和活性炭对幼苗生根的影响
由表4看出,培养基是添加NAA、IBA和活性炭均能够显著促进金钗石斛幼苗根的生长。
2.3.1 激素随着NAA和IBA浓度升高,根的生长更加旺盛,生根数和根长均呈增加趋势。NAA浓度为1 mg/L时,生根数和根长、根粗均达最大值,分别为5.25条、7.19 cm和0.084 cm,其中,生根数和根长显著高于无添加和0.2 mg/L处理。IBA浓度为1 mg/L时,生根数和根长、根粗均达最大值,分别为6.13条、5.41 cm和0.086 cm,但与0、0.2 mg/L和0.5 mg/L处理差异不显著,仅与无添加处理差异显著。NAA与IBA相比较而言,NAA更有利于根长的生长,而IBA更有利于生根数的增加。
表4不同激素和活性炭处理金钗石斛幼苗根的生长
Table 4 Growth ofD.nobileseedling root protocorm treated with different hormone and active carbon
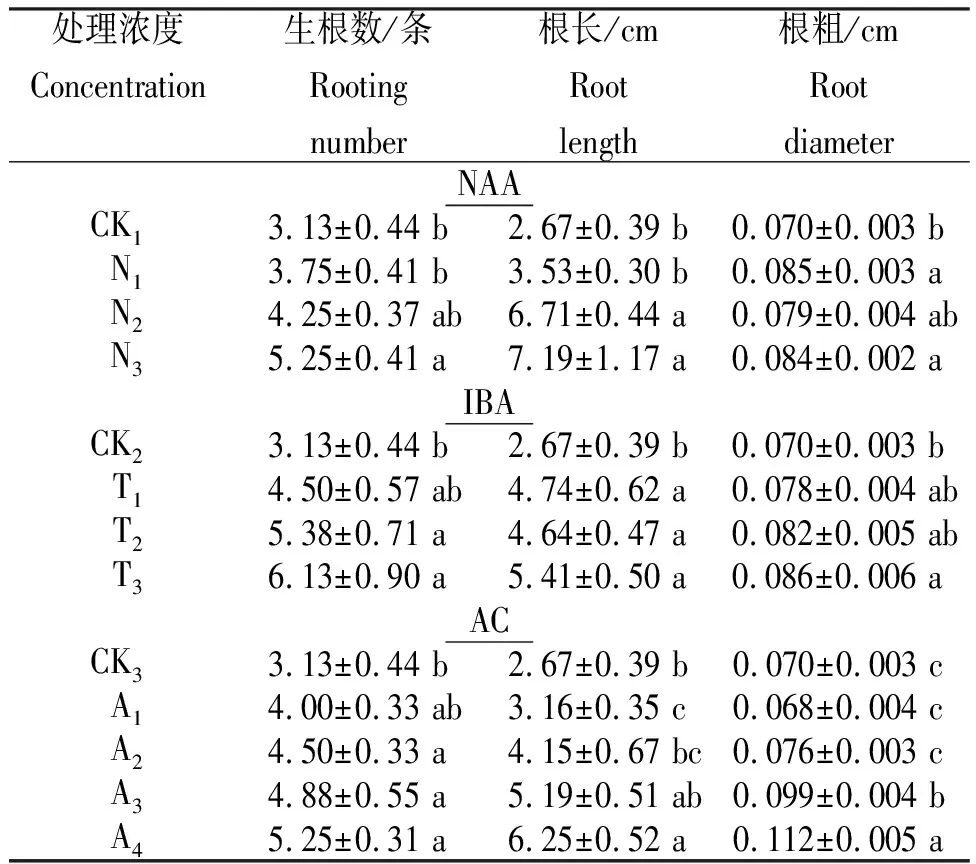
处理浓度Concentration生根数/条Rooting number根长/cmRoot length根粗/cmRoot diameterNAA CK13.13±0.44 b2.67±0.39 b0.070±0.003 bN13.75±0.41 b3.53±0.30 b0.085±0.003 aN24.25±0.37 ab6.71±0.44 a0.079±0.004 abN35.25±0.41 a7.19±1.17 a0.084±0.002 aIBA CK23.13±0.44 b2.67±0.39 b0.070±0.003 bT14.50±0.57 ab4.74±0.62 a0.078±0.004 abT25.38±0.71 a4.64±0.47 a0.082±0.005 abT36.13±0.90 a5.41±0.50 a0.086±0.006 aACCK33.13±0.44 b2.67±0.39 b0.070±0.003 cA14.00±0.33 ab3.16±0.35 c0.068±0.004 cA24.50±0.33 a4.15±0.67 bc0.076±0.003 cA34.88±0.55 a5.19±0.51 ab0.099±0.004 bA45.25±0.31 a6.25±0.52 a0.112±0.005 a
2.3.2 活性炭随着活性炭浓度升高,根的生长更加旺盛,生根数、根长和根粗均呈增加趋势。当活性炭浓度为2 g/L时,培养基透明度最低,生根数、根长和根粗达最大,分别为5.25条、6.25 cm和0.112 cm,生根数显著高于无添加处理,根长显著高于除1 g/L处理的其余处理,根粗显著高于其余处理。说明,活性炭浓度越高,越有利于生根。
3 结论与讨论
琼脂的凝固能力与原料、生产厂家的加工方式、高压灭菌的温度、时间及pH等因素有关。琼脂本身不提供任何营养而只起支持作用[9]。琼脂浓度太低,不能很好地起支持作用,但如果浓度太高则硬化,植株不能与培养基很好地接触,营养物质难以扩散被植株吸收。一般来说,琼脂含量为0.3%~0.5%时形成半固体,即较软的固体,含量在0.7%以上形成较硬的固体。该试验发现,在较软的培养基上培养石斛兰生长旺盛。
糖作为碳源,为细胞提供合成新化合物的骨架,并为其呼吸代谢提供底物和能源,还可以维持渗透压。兰花的组织培养普遍使用蔗糖作为碳源。该研究表明,低浓度蔗糖作为碳源,可致石斛幼苗发生玻璃化现象,而高浓度虽然有利于根的生长,但叶片生长受到一定抑制。可能是因为过低的糖不能满足细胞营养、代谢和生长的需要,过高的糖又可能会干扰正常糖代谢,使培养系统渗透压增加,阻碍了细胞对水分的吸收,明显抑制地上部分的生长。综合考虑茎、叶和根的生长认为,金钗石斛幼苗培养最佳蔗糖浓度为3%。
天然提取物是除基础培养基中已加入的有机质外额外添加的一些有机物,在石斛繁殖研究中常用椰汁、香蕉汁和马铃薯匀浆等作为天然提取物来源[10-11]。椰汁养分丰富且复杂,含有玉米素等植物激素,还具有缓冲培养基pH的功能。该试验采用椰汁为添加物显著促进了金钗石斛幼苗的生长,说明,椰汁对石斛的生长十分有利。
赵天榜等[12-13]研究发现,激素NAA和IBA对植物根再生诱导效果显著。该研究表明,NAA和IBA对石斛幼苗生根有促进作用,且浓度越高促进效果越明显,二者均以浓度为1 mg/L时生根数和根长最大。
活性炭常用于植物组织培养中促进细胞生长和发育。活性炭(AC)的作用可能在于可以不可逆的吸附培养基中一些抑制性化合物,降解一些有毒代谢物,如酚类化合物和褐化物质[14]。单独的AC或联合生长素可以促进很多组培植物生根[15]。该研究表明,添加AC有助于石斛幼苗生根。关于AC促进根生长的机理并不十分清楚,一般认为与AC减弱光照有关。由此推测,可能是由于根顶端能产生IAA,促进了根的生长,但IAA易受可见光的光氧化而被破坏,因此,AC的主要作用可能在于通过减弱光照保护IAA,从而间接促进根的生长。
