牛支原体病PCR检测方法的建立及初步应用
2019-06-05吴位珩徐景峨余国富冯明祥孙启跃杨茂生姜玲玲
吴位珩, 徐景峨, 余 波*, 张 涛, 余国富, 杨 莉, 冯明祥,孙启跃, 刘 镜, 黄 波, 杨茂生, 姜玲玲
(1.贵州省农业科学院 畜牧兽医研究所,贵州 贵阳 550005;2.清镇市动物疫病预防控制中心,贵州 清镇 551400;3.贵州省关岭自治县畜牧服务中心,贵州 关岭 561300)
牛支原体是危害养牛业的一种主要致病性支原体,除能导致牛肺炎、乳腺炎、关节炎外,还导致眼结膜炎、耳炎、生殖道炎症、流产与不孕等多种疾病[1]。1961年,美国人HALE[2]首次从患乳腺炎的牛乳中分离得到牛支原体,1976年报道其与牛呼吸系统疾病有关。目前,该病原在世界范围内普遍存在。欧洲每年有25%~33%的犊牛肺炎是由牛支原体引起,相当于每年损失1.44~1.92亿欧元,其中英国每年有190万头牛患牛支原体肺炎,死亡达15.7万头。美国每年由牛支原体导致的牛呼吸系统疾病和乳腺疾病所造成损失达1.40亿美元,牛场感染率达70%。自2008年以来,我国大部分省(地区)从外地引入肉牛,爆发了以坏死性肺炎为主要特征的传染性牛支原体肺炎疫情,多数牛在运输到目的地后1~2周发病,发病率为50%~100%,病死率高达10%~50%,给我国肉牛养殖业造成了巨大的经济损失[2]。随着我国肉牛养殖规模的不断壮大,北牛南运、北繁南育,引进国外种牛日益普遍,肉牛的各种疾病也随之而来,肉牛支原体病的发生也呈逐年上升趋势。随着贵州扶贫攻坚的开展,肉牛引进量不断增大的同时也带来了一系列流行病感染问题,而肉牛运输综合症最为突出,项目组2017年1月至2018年6月,对贵州引进肉牛较多的黔西县、大方县、水城县、思南县等养牛场进行了流行病学调查,发现造成贵州省肉牛运输综合症主要病因是肉牛支原体感染,严重的继发巴氏杆菌感染,从而造成死亡。对此,根据牛支原体OPPD/F基因序列保守区间设计引物,建立了牛支原体PCR诊断方法,结合流行病学调查、临床症状及病原菌分离鉴定,对引进和饲养肉牛发生疾病进行确诊,同时制定出有效的预防和治疗措施,为饲养肉牛的支原体感染快速确诊和治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 参考菌株 牛支原体菌株由华中农业大学动物医学院惠赠;嗜血杆菌、魏氏梭菌、大肠杆菌、多杀性巴氏杆菌、沙门氏菌、结核分枝杆菌均由贵州省畜牧兽医研究所畜禽疫病研究室提供。
1.1.2 引物 根据牛支原体OPPD/F基因序列,应用Primer 5.0基因分析软件设计引物,扩增片段为226 bp,Genbank上的登录号为AF130119.1。上引物序列,5′-ACGTGACTACTTCACCCTGAT- 3′;下引物序列,5′-TAGACCGACTATTTCACCTTC-3′。由宝生物工程(大连)有限公司合成。
1.1.3 生化试剂 Lab-Aid 820核酸提取Mini试剂盒(试剂条、磁棒套、缓冲液ATL、洗脱液等)、DTT试剂均购自厦门致善生物科技股份有限公司;Goldview核酸染料、蛋白酶K、十二烷基硫酸钠、EDTA、Tris-HcL、琼脂糖、DL2000 Marker、2×Taq PCR MasterMix(10 mmol/L Tris-HcL、50 mmol/L KCL、1.5 mmol/L MgCl2、0.05 U Poymerase/μL)、去离子水均购自天根生化科技(北京)有限公司;PPLO肉汤培养基、PPLO固体培养基购自青岛高科技工业园海博生物技术有限公司;特级马血清、酵母粉、精氨酸购自北京索莱宝科技有限公司;葡萄糖、酚红、琼脂粉等(国产试剂)。
1.1.4 主要仪器 核酸提取仪购自厦门百维信生物科技有限公司(Lab-Aid 820),电子天平购自美国奥豪斯(AR2140),高速冷冻离心机购自美国赛麦飞(SORVALL:LEGEND MICRO 21R),pH测量仪购自梅特勒-托利多(Delta 320A/c),梯度PCR扩增仪、电泳仪、紫外透射仪、凝胶成像仪购自德国BIOMETRA,超纯水器购自台湾艾科蒲(ATZ-10-T),紫外分光光度计购自北京普析(TU-1810SPC),移液器产自芬兰,移液头、PCR离心管产自美国。
1.2 支原体培养基及精氨酸溶液的配制
1.2.1 PPLO液体培养基 称取葡萄糖2.5 g,PPLO肉汤粉10.5 g,酵母粉2.5 g,溶于445 mL超纯水中116℃灭菌20 min后,添加马血清50 mL,10%精氨酸5 mL,8 万IU/mL青霉素溶液5 mL,1%酚红溶液500 μL,置4℃保存备用。
1.2.2 PPLO固体培养基 称取葡萄糖2.5 g,PPLO肉汤粉10.5 g,酵母粉2.5 g,琼脂粉7.5 g,溶于440 mL超纯水中116℃灭菌20 min后,马血清50 mL,10%精氨酸10 mL,8 万IU/mL青霉素溶液5 mL,铺置平板,凝固后,置4℃保存备用。
1.2.3 10%精氨酸溶液 称取精氨酸10 g溶于80 mL双蒸水,搅拌至完全溶解后加水定容至100 mL,0.22 μm滤膜过滤后置4℃保存备用。
1.3 样本的采集
无菌采集疑似牛支原体肺炎病、死牛肺,或采用棉签采集疑似牛支原体肺炎鼻涕(鼻拭子),用冷藏箱带到实验室,待培养及提取DNA模板用。
1.4 病原菌的分离培养
将采集的牛肺置于平面皿中,用无菌生理盐水冲洗,用无菌手术剪刀取中间未污染部分,研磨,致细碎;鼻拭子用1 mL生理盐水浸润,尽量将药棉棒上的鼻涕清洗在试管里,弃去药棉棒,将处理液0.45 μm滤膜过滤后接种于PPLO肉汤培养基中,5%CO2、37℃恒温培养48 h以上,培养基由红变黄,转接于PPLO固体培养基,5%CO2、37℃恒温培养72 h,在固体培养基上有针尖大小的菌落,普通光学显微镜下可见圆形,边缘整齐,中央凸起的菌落。
1.5 样本DNA的提取
1.5.1 组织样本 DNA 取牛肺少许,采用灭菌手术剪剪碎,加入900 μL生理盐水,反复冻融3次,然后5 000 r/min离心5 min,取700~900 μL上清液,加入蛋白酶K 20 μL,100 μL 10%SDS液,55℃水浴加热30 min至组织消化完全,取出冷却。取1 mL ddH2O将鼻拭子完全浸润,尽量将鼻涕清洗在试管里,弃去棉棒,将溶液移入1.5 mL离心管中,10 000 r/min离心2 min,弃上清,收集沉淀。将上述处理的组织液200 μL或沉淀放入核酸提取Mini试剂条中,提取的DNA,-20℃保存备用。
1.5.2 分离培养菌株 DNA 取培养菌液1 500 μL于1.5 mL离心管中,10 000 r/min离心2 min,弃上清,收集沉淀。按核酸提取Mini试剂盒使用说明书操作进行,提取的DNA,-20℃保存备用。
1.5.3 参考菌株DNA 标准牛支原体菌株、嗜血杆菌、魏氏梭菌、大肠杆菌、多杀性巴氏杆菌、沙门氏菌、结核分枝杆菌DNA模板的提取,方法同1.5.2。
1.6 牛支原体特异性片段的PCR扩增
1.6.1 反应体系 2×Taq PCR MasterMix为10 μL,支原体标准菌株DNA或样本DNA 2 μL,上、下引物各1 μL,加ddH2O至25 μL。
1.6.2 反应条件 94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸90 s,30个循环;最后72℃延伸5 min。取扩增产物5 μL进行2%琼脂糖凝胶电泳检测,胶回收后送宝生物工程大连有限公司测序。
1.7 PCR反应条件的优化
对PCR反应条件,包括退火温度(47℃、52℃、67℃),引物浓度(5 μmol/L、10 μmol/L、20 μmol/L),Taq DNA聚合酶浓度(0.5 U、1 U、2 U)进行优化,以确定最佳反应条件,同时以超纯水作为空白对照。PCR反应体系(25 μL),10×Taq Buffer 5 μL,dNTP mixture 4 μL;Taq DNA 聚合酶1 μL,用超纯水补足至25 μL。反应条件:94℃预变性5 min;94℃变性30 s,退火温度(47℃、52℃、67℃)1 min,72℃延伸90 s,30个循环;最后72℃延伸5 min。72℃延伸1 min,30个循环;最后72℃延伸10 min。取7 μL PCR扩增产物于10 g/L琼脂糖凝胶中进行电泳鉴定。
1.8 PCR法扩增的特异性及敏感性测定
1.8.1 特异性 分别用标准牛支原体菌株、嗜血杆菌、魏氏梭菌、大肠杆菌、多杀性巴氏杆菌、沙门氏菌、结核分枝杆菌DNA为模板,进行PCR扩增。
1.8.2 敏感性 采用TU-1800spc紫外可见分光光度计,OD值为260 nm,将牛支原体DNA模板稀释100倍,进行浓度的测量。根据模板浓度(μg/μL)=A260×稀释倍数×50/1000的方法进行计算。在进行敏感性试验时,按10倍稀释法对DNA模板进行稀释后,取2 μL模板进行扩增,牛支原体标准DNA浓度依次为1 μg/μL、1×10-1μg/μL、1×10-2μg/μL、1×10-3μg/μL、1×10-4μg/μL、1×10-5μg/μL、1×10-6μg/μL、1×10-7μg/μL。
1.9 临床样品的检测
对2017-2018年黔西县、大方县、水城县、思南县等养牛场采集121份样品进行检测,分离培养病原菌。
2 结果与分析
2.1 PCR产物的鉴定
牛肺炎支原体PCR扩增片段经胶回收、测序得到片段226 bp,与预测结果一致。表明,扩增片段为牛肺炎支原体的特异性条带。
2.2 PCR反应条件的优化
在25 μL反应体系中,最佳反应条件:退火温度52℃,Taq DNA聚合酶10 μL,引物浓度20 μmol/L,采用上述条件扩增出了目的片段,片段大小为226 bp(图1),无非特异性片段产生。
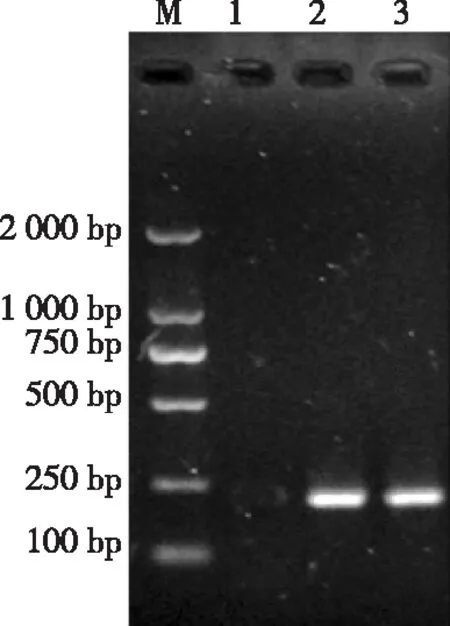
注:M,Marker DL2000;1,阴性对照;2,标准阳性;3,被检出的阳性样本。
Note:M,Marker DL2000; 1,negative control; 2,standard positive; 3,positive samples detected.
图1 牛支原体 PCR反应图谱
Fig.1 Map ofM.bovinaPCR reaction
2.3 特异性及敏感性
2.3.1 特异性 由图2可见,除牛支原体出现扩增带外,其他的菌株未见特异性226 bp片段,表明引物具有特异性。
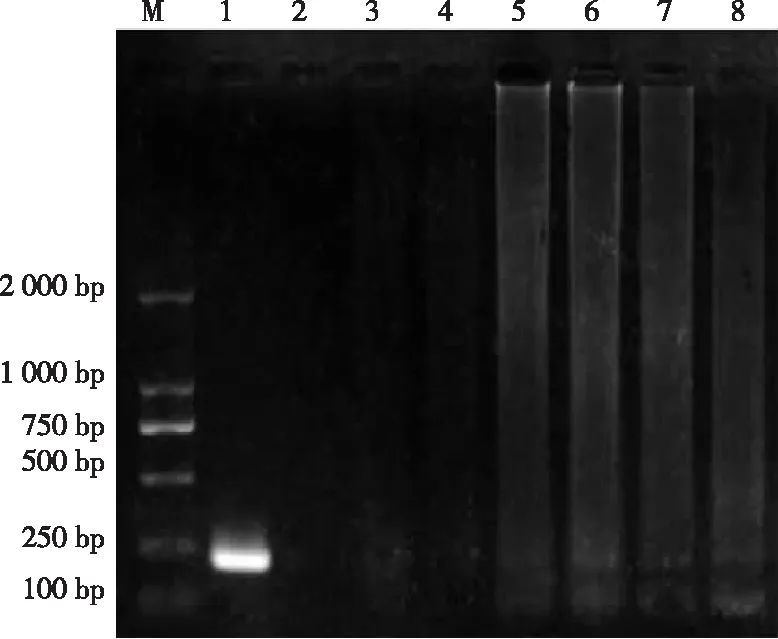
注:M,Marker DL2000;1,标准阳性;2,阴性对照;3,嗜血杆菌;4,魏氏梭菌;5,大肠杆菌;6,多杀性巴氏杆菌;7,沙门氏菌;8,牛结核分枝杆菌。
Note:M,Marker DL2000; 1,standard positive; 2,negative control; 3.Haemophilusinfluenza; 4,Clostridiumwilfordii; 5,Escherichiacoli; 6,Pasteurellamultocida; 7,Salmonella; 8,M.bovina.
图2 牛支原体PCR特异性试验图谱
Fig.2 Map of the PCR specificity test ofM.bovina
2.3.2 敏感性 经测牛支原体标准DNA模板的平均OD260值为0.633 nm,试验提取的牛支原体标准DNA模板的含量为0.5 μg/μL。由图3可见,在PCR反应中,可检出的牛支原体标准DNA模板的含量最小是1×10-7μg,即灵敏度为1×10-7μg。
2.4 临床样品的检测
经检测共得阳性样本43份,且与细菌学检验结果一致,同时将PCR扩增片段经胶回收、测序表明,扩增片段为牛支原体的特异性条带(图4)。整个检测过程仅需3.5 h。
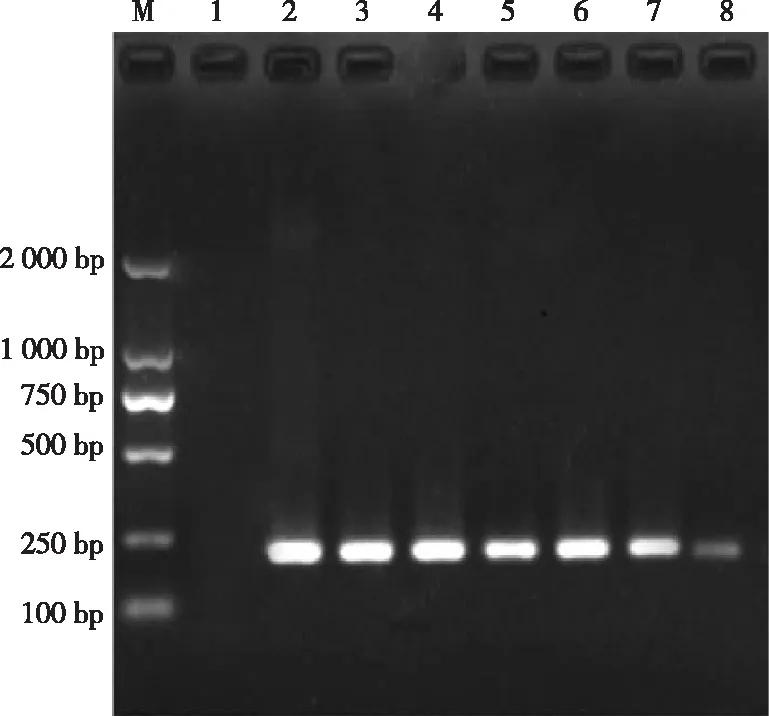
注:M,Marker DL2000;1,阴性对照;2~8,牛支原体 DNA稀释度分别为10-1~10-7。
Note:M,Marker DL2000; 1,Negative control; 2-8,the dilution ofM.bovinaDNA was 10-1-10-7,respectively.
图3 牛支原体PCR敏感性试验图谱
Fig.3 Map of the PCR sensitivity test ofM.bovina
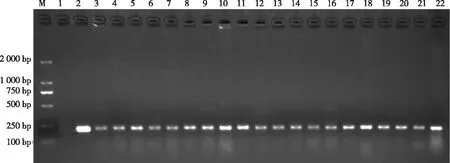
注:M,Marker DL2000;1,阴性对照;2,标准阳性;3~22,临床样本鼻拭子。
Note:M,Marker DL2000; 1,negative control; 2,standard positive; 3-22,nasal swabs from clinical samples.
图4 临床样本的检测图谱
Fig.4 Test Map of clinical samples
3 结论与讨论
目前,用于牛支原体诊断方法很多,如分离培养法、免疫学方法和核酸诊断技术等[3]。在标本中分离培养支原体,对于牛支原体感染的诊断有决定性意义,结合生化鉴定技术,可作为实验室诊断牛支原体感染的基本诊断技术,但不能作为确定感染的最终检测方法和结果。而大多数的肉牛支原体病伴有多病原混合感染,临床上难以及时鉴别诊断,细菌学培养分离鉴定,程序繁琐、培养周期长,免疫学诊断虽操作简单,但具有抗体依耐性,特别是在感染早期,血清中抗体水平低,检测的敏感性低,达不到早期诊断的目的,延误防治时机,给肉牛业造成巨大的经济损失。而PCR诊断技术具有敏感、特异的特点,能快速、准确地检测病原核酸,且不考虑菌体死活、抗体产生等因素,并可对疾病早期进行诊断,为防治该病争取到最佳的治疗时机。因此,核酸诊断技术是牛支原体感染较为理想的诊断方法。ATP结合蛋白OPPD/F基因和DNA聚合酶Ⅲ基因为目标基因的PCR,已证实能够较好地区别牛支原体与牛无乳支原体的感染[4]。本试验根据牛支原体OPPD/F基因序列保守区间设计引物,通过优化反应条件,建立了牛支原体PCR诊断方法,灵敏度为1×10-7μg,整个检测过程仅需3.5 h。由此可见,该检测方法具有快速、灵敏性高、特异性强等特点,对牛支原体感染的诊断、防治与预后评估具有重要意义。
经调查,贵州省肉牛运输综合症主要病因是肉牛支原体感染,肉牛支原体感染的治疗方法:肌肉注射治疗支原体病的特效药泰乐菌素,同时补充多种维生素及10%葡萄糖。若出现混合感染多种病原现象,治疗时采用四环素、庆大霉素、地塞米松合并用药,同时补充10%葡萄糖和维生素C,用药5~7 d。
引进和饲养肉牛应注意的事项:
1)严格引进新牛。不从疫区或发病区引进牛。牛群引进前要作好牛布鲁氏病、口蹄疫、牛结核、牛支原体、牛焦虫病的检疫检测,防止引进病牛和潜伏感染期的带菌牛。牛群起运前,要饲喂适量的水、料、草,适宜控制在八成饱,装车前运输车辆及上车台等用具进行消毒,装车避免拥挤,运输要匀速。到达目的地后必须进行充分休息,之后方可喂水(饲喂水清洁干净,加入电解多维和食盐,可适量补充葡萄糖),接着饲喂足够的青绿饲草。对牛场新进来的牛进行监控和隔离,包括犊牛都必须隔离,确保无病后方可与健康牛混群。
2)加强饲养管理。保证良好的卫生环境非常重要,牛舍保持干燥、清洁、通风良好,注意防寒保暖,定期对肉牛场的设施设备进行清洁。定期进行消毒,控制饲养密度适宜,防止过于拥挤。不同来源以及不同年龄的肉牛要采取分栏饲养。饲喂品质优良的饲料,补充适量的精料、微量元素和维生素,确保日粮含有全面、均衡的营养,增强机体抵抗力。
3)加强疾病预防。定期消毒牛舍,及时发现和隔离病牛,做到早诊断,早治疗,同时研制并开发兽用中药防控该病的发生和流行,以确保贵州省养牛业的健康和稳定发展。
