基于戊二醛偶联技术制备脲酶-Au-MMP“双面神”酶驱动马达及其运动性能
2019-06-04李守丽杨成林官建国
李守丽,杨成林,袁 月,官建国,罗 明
(武汉理工大学 材料科学与工程国际化示范学院; 材料复合新技术国家重点实验室,湖北 武汉 430070)
化学驱动型微纳米马达是一种能够将化学能转化成机械能,从而实现自主运动的自驱动人工智能器件[1]。它通过催化剂或活性金属与燃料之间在界面处发生的化学反应来推动。化学驱动型微纳米马达在环境修复[2-6]、货物运输[7-10]、微观手术[11-12]和靶向给药[13]等领域都有着广泛的应用。
化学驱动型微纳米马达在生物医学的实际应用中往往受到燃料的固有毒性或其在生物体内的燃料含量的限制[14]。最近,由于酶具备生物相容性和多功能性以及其催化底物天然存在于人体环境中,因此吸引着更多研究者研究酶驱动马达。脲酶自然存在于人体中,并且能够分解尿素产生氨气和二氧化碳[15]。人体环境中尿素的浓度为5~10 mmol/L[16],因此脲酶驱动微纳米马达有望实际应用到人体生物医药领域。人体生物医药领域的应用需要对马达进行运动方向控制,主要方法有磁控、光控等,其中以磁控最为精确并且简单[17]。因此开发具备生物相容性,能够在生物介质的燃料浓度下运动,并且运动方向精确可控的微纳米马达有望实现在生物医药领域中的实际应用。
鉴于此,在本文中采用磁控溅射方法在磁性微球的半球上溅射一层Au制备得到Au-磁性微球(MMP)“双面神”粒子;之后在Au侧依次偶联半胱胺、戊二醛(GA)和脲酶成功制备出脲酶-Au-MMP“双面神”酶驱动马达,并表征了制备的酶驱动马达上脲酶的活性及含量;研究了尿素浓度对酶驱动马达运动速率的影响,以及外加磁场对酶驱动马达运动方向的精确控制。具备自主运动并且运动方向精确可控的生物相容性的脲酶驱动微米马达有望应用在生物医药领域中。
1 实验
1.1 试剂与仪器
试剂: 磁性微球(MMP,2 μm,质量浓度为20 g/L,苏州纳微科技有限公司); 半胱胺(NH2CH2CH2SH,质量分数约为95%、戊二醛溶液(OHC(CH2)3CHO,体积分数为25%)、尿素(CO(NH2)2,质量分数为99.0%~100.5%)、磷酸二氢钠水合物(NaH2PO4·H2O,质量分数≥98.0%)、磷酸氢钠(Na2HPO4,质量分数≥99%)、脲酶(IX型,粉末,50 000~100 000 U/g)、脲酶活性检测试剂盒(均购于西格玛奥德里奇(上海)贸易有限公司); BCA蛋白定量分析试剂盒(赛默飞世尔科技(中国)有限公司); 无水乙醇(质量分数≥99.2%,国药集团化学试剂有限公司);实验用水由美国Milli-Q超纯水系统提供。
仪器:DMI3000倒置光学显微镜(德国徕卡有限公司);JCP500高真空多靶磁控溅射镀膜系统(北京泰科诺有限公司);Hitachi S-4800扫描电子显微镜(SEM,日立集团);X射线显微分析系统、X-Max 50型电制冷能谱仪(EDS,英国牛津仪器公司);TS-PL02等离子表面处理机(深圳东信高科自动化设备有限公司);HHS型数显式电热恒温水浴锅(上海博讯实业有限公司),PB-10 pH计(德国赛多利斯集团)。
1.2 Au-MMP“双面神”粒子的制备
图1为Au-MMP“双面神”粒子的磁控溅射制备过程示意图,利用磁控溅射技术制备[18],具体过程如下:0.05 mL的质量浓度为5 g/L的MMP的乙醇悬浮液滴到用等离子清洗仪处理的干净载玻片(25 mm×25 mm)上,在环境温度下干燥10 min以形成单层MMP。然后,利用磁控溅射系统,电流为0.8 A的条件下,在MMP的表面上不对称地溅射Au层。最后,制备得到的载玻片上Au-MMP“双面神”粒子(10片)通过超声处理和磁分离收集,用超纯水洗涤数次后分散在1 mL超纯水中以供进一步使用。
1.3 脲酶-Au-MMP酶驱动马达的制备
图2为脲酶-Au-MMP“双面神”酶驱动马达的制备过程示意图,是利用GA的醛基和脲酶的氨基形成酰胺键而得到[18-19],具体过程如下:取2 mg的Au-MMP“双面神”粒子,用乙醇洗涤3遍,分散于0.5 mL乙醇溶液中,再加入0.5 mL的浓度为20 mmol/L半胱胺乙醇溶液,混合均匀在25 ℃条件下振荡反应过夜;将得到的氨基化的Au-MMP“双面神”粒子通过磁分离收集、无水乙醇洗涤数次后分散在1 mL无水乙醇中,以供进一步使用。利用PB(浓度为10 mmol/L,pH=6.5)洗涤2次上述氨基化的Au-MMP“双面神”粒子取1 mg,分散在0.9 mL PB(浓度为10 mmol/L,pH=6.5)缓冲溶液中,立刻加入100 μL GA水溶液(质量分数为25%),将上述混合溶液室温振荡反应5 h。将得到的醛基化的Au-MMP“双面神”粒子通过磁分离收集,并用PB(浓度为10 mmol/L,pH=6.5)缓冲溶液洗涤2次后,加入0.2 mL的质量浓度为15 g/L的脲酶(分散在PB(浓度为10 mmol/L,pH=6.5)缓冲溶液),将上述混合溶液室温振荡反应过夜,将得到的脲酶-Au-MMP“双面神”酶驱动马达通过磁分离收集及超纯水洗涤数次,后分散在1 mL超纯水中,并4 ℃保存,以供进一步使用。
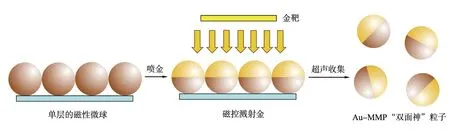
图1 Au-MMP“双面神”粒子的磁控溅射制备过程示意图Fig.1 Schematic illustration of preparation of Janus magnetic microspheres by using a magnetron sputtering technology
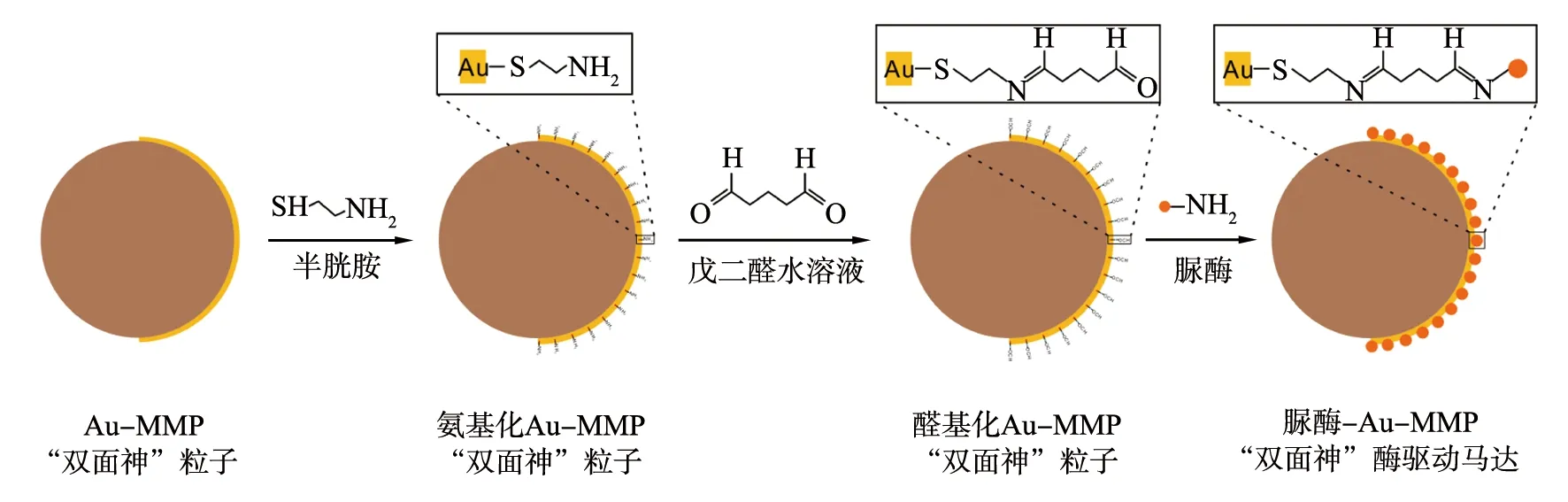
图2 脲酶-Au-MMP“双面神”酶驱动马达的制备过程示意图Fig.2 Schematic illustration of preparation of enzyme-powered urease-Au-MMP Janus motor
1.4 基于氪蛋白质染色对马达的表征
取100 μg脲酶-Au-MMP酶驱动马达与稀释10倍后的氪蛋白质染色溶液混合,混合震荡室温反应30 min后。之后将染色后的酶驱动马达通过磁分离收集及超纯水洗涤数次后分散在0.1 mL超纯水中使用荧光显微镜观察。氪蛋白的激发光的波长是(520±20)nm,检测波长是(580±20) nm。整个染色过程是在避光条件下进行的。
1.5 马达脲酶活性的测定
酶驱动马达上的脲酶活性通过试剂盒进行评估,该试剂盒通过Berthelots的方法测定生成的铵根离子的浓度,从而得到脲酶的米氏常数。测得酶驱动马达的浓度为5 mg/L。
1.6 马达中脲酶含量的测定
脲酶浓度由商用BCA蛋白试剂盒提供的方案测定得到。该试剂盒能够将蛋白质的量与肽键还原的铜的量相关联,测出脲酶-Au-MMP“双面神”酶驱动马达上脲酶的量为100 mg/L。
1.7 马达的表征及运动性能测试
使用SEM观察单层MMP和Au-MMP粒子的微观形貌(加速电压10 kV、工作距离8 mm),并通过能谱仪对其元素分布分析观察其结构。利用倒置荧光显微镜观察并记录马达的运动情况。
2 结果与讨论
2.1 Au-MMP粒子的表征
图3为粒子的SEM图像,其中图3a为单层MMP的SEM图像,图3b为Au-MMP粒子的SEM图像。
从图3a中可直观地观察到,MMP的单层结构中粒子互相紧凑地挨着,证明单层MMP的铺展是成功的,这为“双面神”粒子的制备提供了前提。由图3b可以看出,MMP的一个半球较亮并且粗糙的是溅射的Au层,另一半球光滑并且较暗的是MMP的表面,表明成功制备出了Au-MMP。
接下来,对得到的Au-MMP的C、Fe、Au 3种元素进行EDS面扫元素分析,结果见图4。
从图中可以看出,C和Fe 2种元素较为均匀地分布于MMP上,而Au元素不对称分布在MMP的半球上,由此也进一步证明,Au-MMP粒子的制备是成功的。
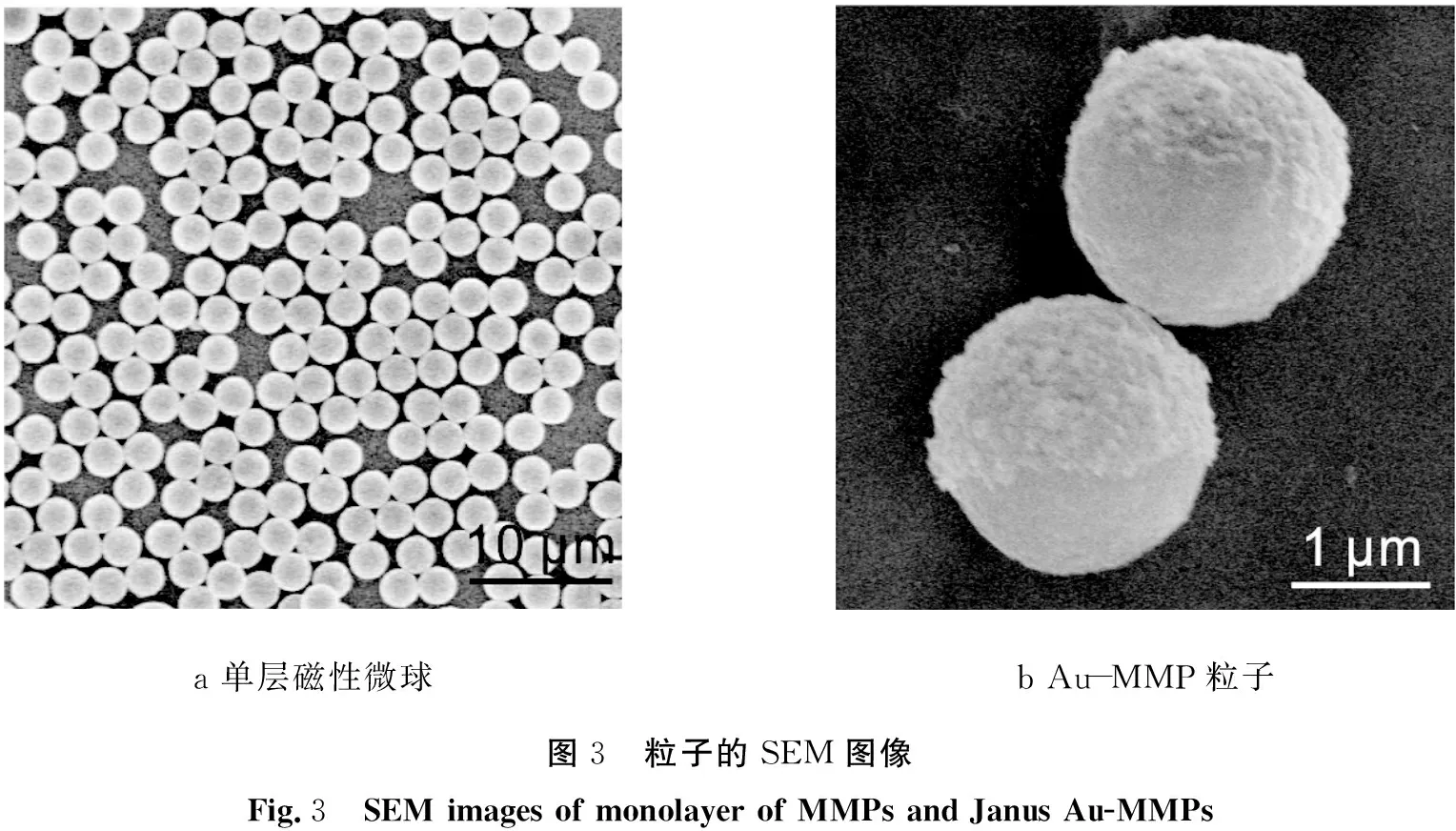
a 单层磁性微球b Au-MMP粒子图3 粒子的SEM图像Fig.3 SEM images of monolayer of MMPs and Janus Au-MMPs

图4 Au-MMP粒子的EDS面扫元素分析图像Fig.4 EDX elemental mapping analyses of Janus Au-MMP
2.2 脲酶-Au-MMP酶驱动马达的表征
为了直接证明脲酶不对称连接到脲酶-Au-MMP酶驱动马达上,利用文献报告过的荧光染色[20]来加以证明,结果如图5所示。
脲酶-Au-MMP酶驱动马达用氪蛋白染色剂染色后,在倒置荧光显微镜下观察结果。从图5a中可以看出,在明场下,马达呈现黑色,观察不到双面神结构; 从图5b中可以看出,当转到荧光场下后,在马达的半球上观察红色荧光出现,这表明脲酶偶联成功,并且不对称偶联到马达的半球上。这说明脲酶-Au-MMP酶驱动马达制备成功。
2.3 脲酶-Au-MMP酶驱动马达脲酶活性的表征
图6为脲酶-Au-MMP酶驱动马达上脲酶活性表征图,其中图6a为催化速率与尿素浓度的关系图;图6b为其催化速率和尿素浓度的双倒数图。
根据米氏方程,酶反应速率可由V=Vmax[S]/(Km+[S])计算得出(Km是米氏常数,[S]是尿素底物浓度,Vmax是最大反应速率)[18]。从上述方程中可以看出,在低尿素浓度情况下,脲酶的催化速率随着尿素浓度的增加呈线性增加;当尿素浓度达到一定数值,反应速率达饱和。利用脲酶活性检测试剂盒检测在不同尿素浓度条件下脲酶-Au-MMP酶驱动马达的反应速率,从而确定偶联到马达上的脲酶活性,也为后续实验提供理论支撑。
从图6a中可以看出,反应速率与尿素浓度的关系很好地契合了米氏方程,说明马达在随着尿素浓度的增加,反应速率也随之增加,尿素浓度为10 mmol/L时, 反应速率趋向于饱和,对后续运动有指导意义。而从图6b中,通过米氏方程的双倒数法测出米氏常数为2.61 mmol/L,在脲酶的正常值2~5 mmol/L范围内。综上所述,制备的脲酶-Au-MMP酶驱动马达具备活性,并且随着尿素浓度的增加,脲酶的催化速率随之增加,并在一定数值下达到饱和。

a 明场b 荧光场图5 氪蛋白染色后脲酶-Au-MMP酶驱动马达的显微镜图像Fig.5 Microscope images of enzyme-powered urease-Au-MMP Janus micromotors stained by Krypton protein staining dye
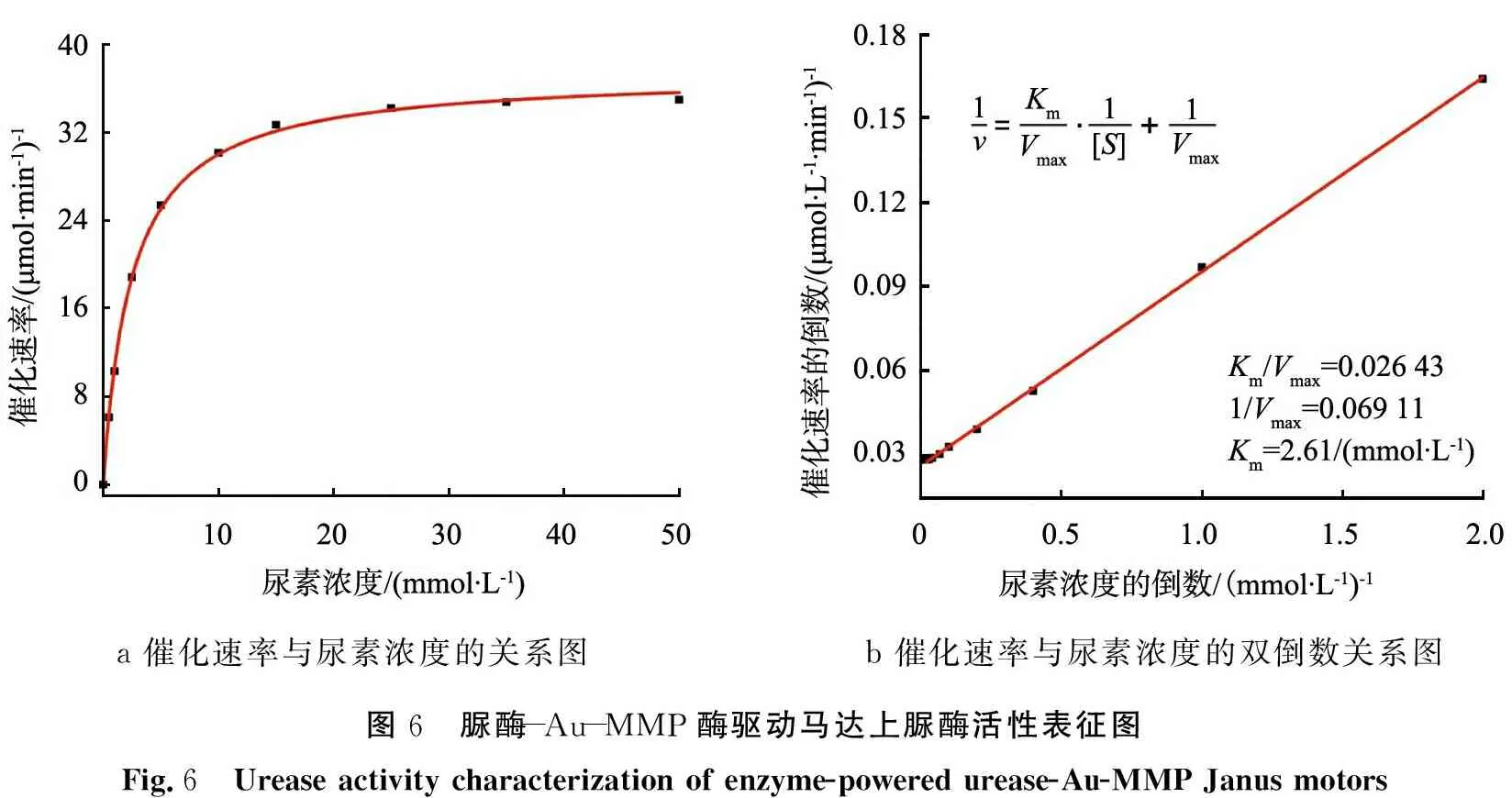
a 催化速率与尿素浓度的关系图b 催化速率与尿素浓度的双倒数关系图图6 脲酶-Au-MMP酶驱动马达上脲酶活性表征图Fig.6 Urease activity characterization of enzyme-powered urease-Au-MMP Janus motors
2.4 脲酶-Au-MMP酶驱动马达上脲酶含量的表征
图7所示为反应溶液的吸收值与标准脲酶浓度的线性关系。
酶驱动马达上酶的数量决定活性位点的数量,从而影响酶驱动马达的运动速率,因此利用BCA蛋白质定量检测试剂盒可测出脲酶含量。首先用脲酶的标准样品做标准曲线,得到拟合方程; 再对一定量制备的脲酶-Au-MMP酶驱动马达进行测试,根据拟合方程计算出脲酶-Au-MMP酶驱动马达上脲酶含量,结果如图7和表1所示。从图中可以得出,拟合方程为y=0.000 784x+0.000 512(R2=0.99)。
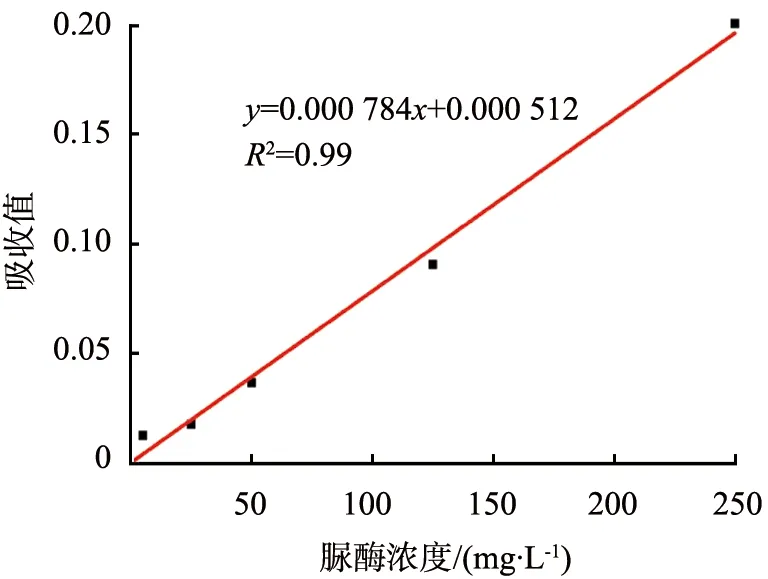
图7 反应溶液的吸收值与脲酶浓度的线性关系图Fig.7 Linear relationship between absorbance of reaction solution and concentration of urease molecules

表1 脲酶-Au-MMP“双面神”酶驱动马达上脲酶含量
从表1中可以看出,根据拟合方程进行计算脲酶-Au-MMP酶驱动马达上的脲酶含量得出每个脲酶-Au-MMP酶驱动马达上的脲酶含量为(1.87±0.12)×10-11μmol/L。
2.5 脲酶-Au-MMP酶驱动马达的运动性能
脲酶-Au-MMP酶驱动马达上的脲酶可分解尿素产生氨气和二氧化碳,由于其不对称分布,催化产物在球体周围形成浓度梯度,在扩散过程中,产生自扩散泳机制驱动酶驱动马达实现自主运动。
图8为脲酶-Au-MMP酶驱动马达在时间为30 s,不同尿素浓度条件下的运动轨迹图。其中图8a—8f分别展示了马达在尿素浓度为0、0.1、0.5、1、5、10 mmol/L条件下的运动轨迹图。从图中可以看出,当尿素浓度为0时,马达的轨迹很短并且基本上在粒子周围振动,证明只存在布朗运动。而当尿素浓度为0.1~10 mmol/L时,马达的轨迹变长并且按照一定轨迹运动,说明能够自主运动。随着尿素浓度增加,马达轨迹逐渐变长,说明马达速度变快。马达的速度与尿素浓度成正比关系,表明尿素浓度依赖于催化活性。
图9为脲酶-Au-MMP酶驱动马达的运动表征图。其中图9a为马达在不同尿素浓度下的平均速度图,图9b为马达在均方位移(MSD)与时间间隔的函数关系图。脲酶-Au-MMP酶驱动马达的速度是通过从光学显微镜记录的视频中一段时间内测量的轨迹长度所计算得到。

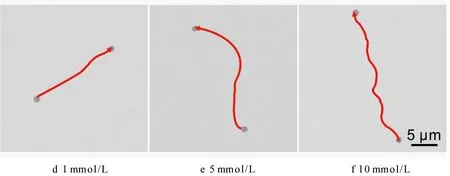
图8 时间为30 s条件下酶-Au-MMP酶驱动马达在不同尿素浓度中的运动轨迹图Fig.8 Motion trajectory of enzyme-powered urease-Au-MMP Janus motors in fuel solution with different urea concentration in 30 s
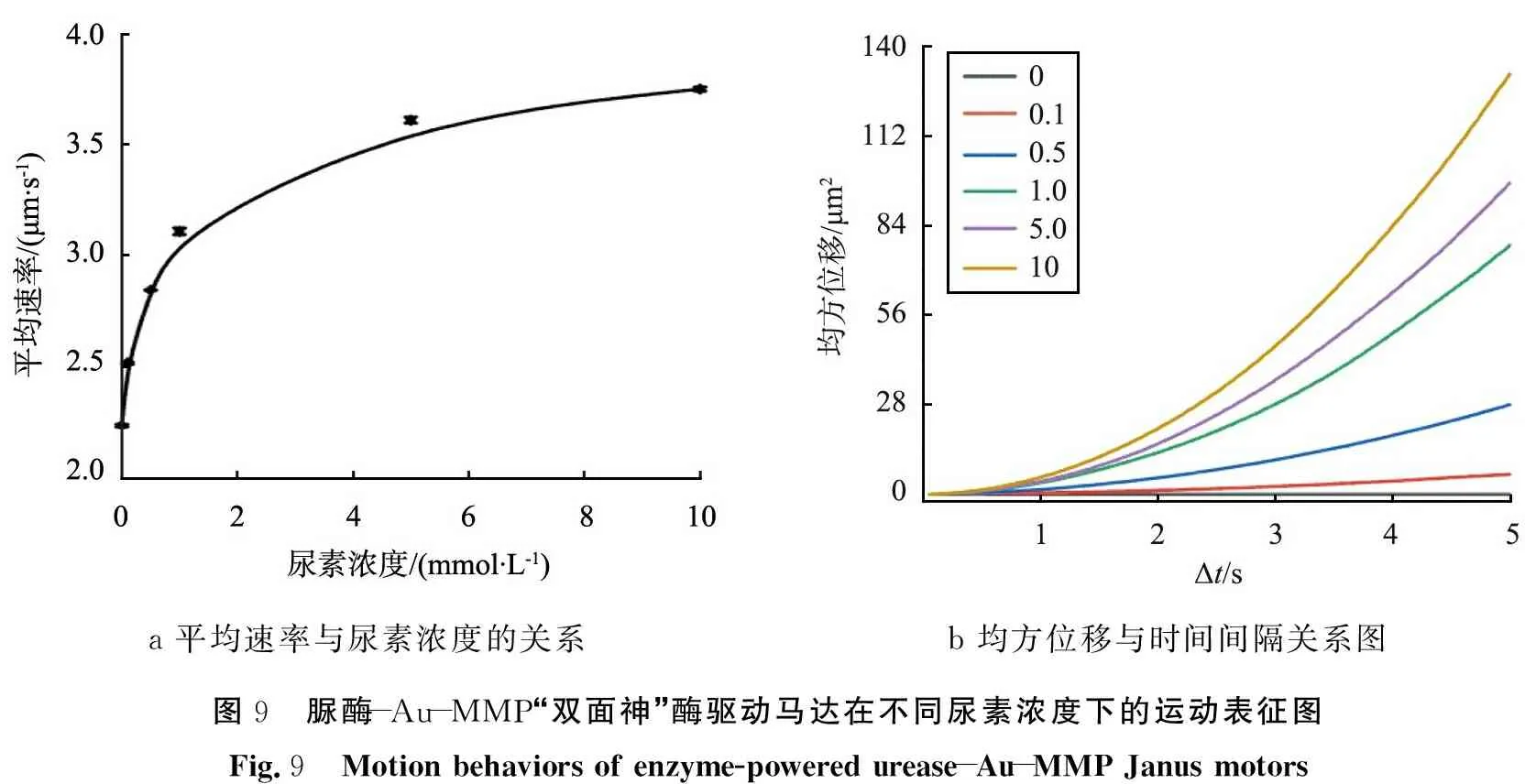
a 平均速率与尿素浓度的关系b 均方位移与时间间隔关系图图9 脲酶-Au-MMP“双面神”酶驱动马达在不同尿素浓度下的运动表征图Fig.9 Motion behaviors of enzyme-powered urease-Au-MMP Janus motors
从图9a中可以看出,随着尿素浓度的增加,其运动速率也随之增大;在尿素浓度到10 mmol/L的情况下,脲酶-Au-MMP酶驱动马达的速度可以达到(3.75±0.01)μm/s并且开始饱和。从2.3节中得到脲酶的Km值为2.61 mmol/L,在2~5 mmol/L范围内,对于低尿素浓度,速度表现出对尿素浓度的线性依赖性。理论上当尿素浓度达到10 mmol/L,马达的催化速率开始达到饱和,这与马达的速度很好地吻合。观察到的速度值与尿素浓度的关系与米氏方程拟合结果非常好地匹配,表明马达的主动运动与马达表面上固定的脲酶的酶活性直接相关。基于从粒子轨迹提取的坐标(xμm,yμm),计算不同尿素浓度下的MSD与时间间隔的函数。如图9b中,布朗运动的MSD曲线是线性的,而自主运动的MSD曲线为抛物线形状,并且随着曲线的斜率越大,说明马达的运动速率越大。随着尿素浓度的增加,MSD曲线显示出越来越抛物线的形状,表明马达从布朗运动到自主运动的运动的转变。从上述结果中得出,成功制备了能自主运动的脲酶-Au-MMP酶驱动马达。
2.6 脲酶-Au-MMP酶驱动马达运动方向的控制
控制酶驱动马达的运动方向是其实现货物的定向运输以及药物靶向治疗的前提和保证。本文中成功制备的脲酶-Au-MMP酶驱动马达,由于基体使用的是磁性微球,因此可以通过外部磁场的调控实现控制马达的运动方向,如图10所示。
图10a中展示了想要将马达从位置1运动到位置2,接着运动到位置3,再运动到位置4的预定路线。图10b中展示了施加纵向匀强磁场后,马达成功地从位置1运动到位置2。图10c中展示了在25 s后加横向匀强磁场后,马达成功地从位置2运动到位置3。图10d中展示了在50 s后再施加纵向匀强磁场后,马达成功地从位置3运动到位置4。说明制备的脲酶-Au-MMP酶驱动马达能够按照设想的路线精准控制运动,这一特性为之后酶驱动微米马达在生物医药领域在人体内应用提供了可能。
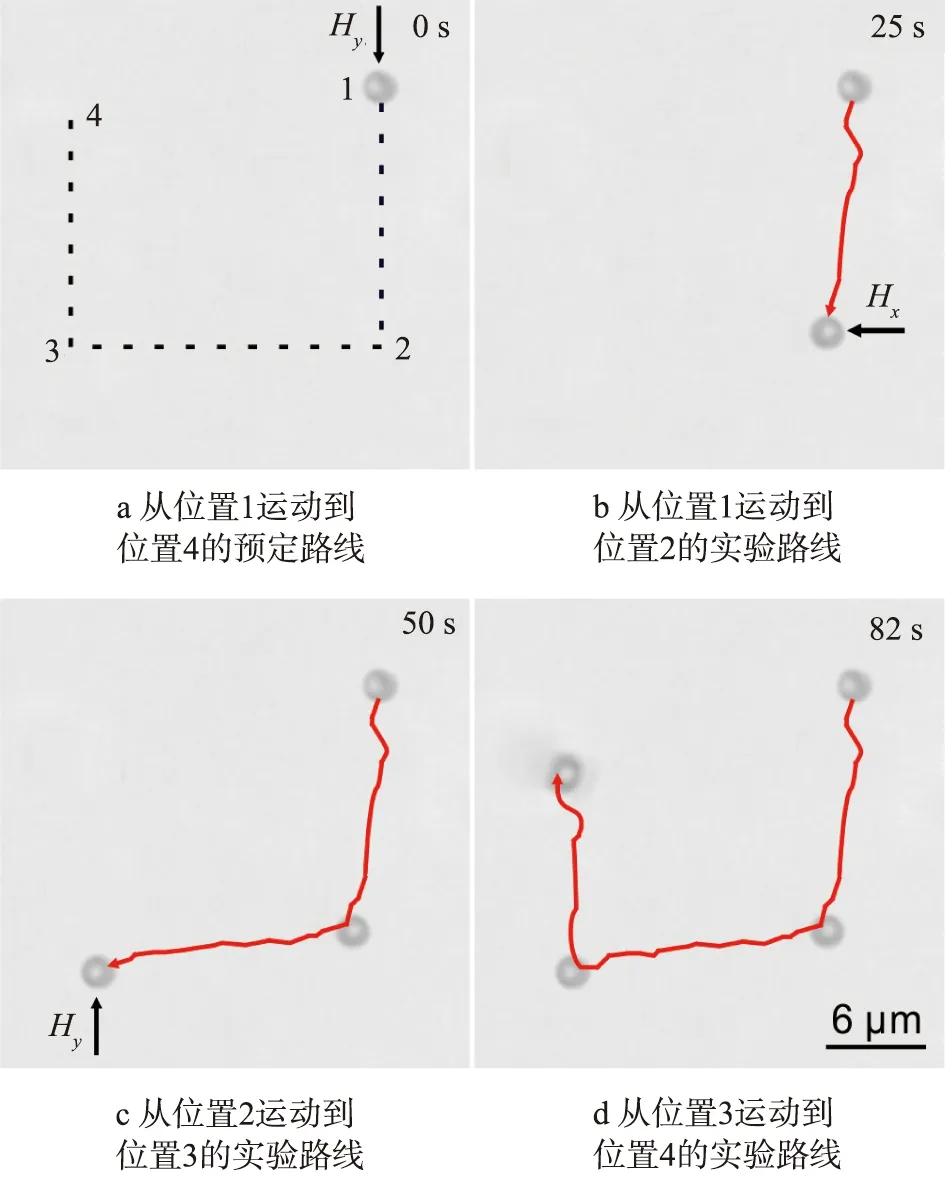
图10 外部磁场调控脲酶-Au-MMP酶驱动马达运动方向的视频截图Fig.10 Optical snapshot from a video shows motion direction of enzyme-powered urease-Au-MMP Janus motors with guidance of an external magnetic field
3 结论
1)成功制备脲酶-Au-MMP“双面神”酶驱动马达。
2)可通过提高尿素浓度进一步提高脲酶-Au-MMP酶驱动马达的运动速率。当尿素浓度增加到10 mmol/L时,马达的平均运动速率可增加到(3.75±0.01)μm/s。
3)脲酶-Au-MMP酶驱动马达具有磁性微球为基底,实现了通过外部磁场精确调控马达的运动方向。
