多功能非病毒载体在肿瘤基因治疗中的应用
2019-06-03李格非林桂淼
肖 月,李格非,刘 丹,陈 婷,林桂淼*
(深圳大学医学部基础医学院生理学教研室,广东 深圳 518060)
传统的肿瘤治疗方式包括手术治疗、化学药物治疗、放射性治疗,这些治疗方式并不能有效地阻止肿瘤的复发及转移,并且由于化疗的耐药性、放疗的副作用,使得它们的疗效受到限制。而基因治疗的兴起为癌症治疗带来了新的希望,其核心技术在于运用载体将治疗基因递送到患者的细胞中,通过替代突变基因、敲除异常表达基因或补充缺失基因,从而达到精准且靶向的治疗目的。
在1990年,使用逆转录病毒将腺苷脱氨酶(adenosine deaminase,ADA)基因转移到具有严重联合免疫缺陷(severe combined immunodeficiency,SCID)的两个儿童的T细胞中,这是基因治疗第一次应用于临床试验[1]。在这之后的20年里,全世界已经批准了1700多个关于基因治疗的临床试验[2]。用于临床试验的载体主要分为病毒载体与非病毒载体。但病毒载体存在的安全问题限制了它的应用,临床试验中首例死亡案例正是与腺病毒载体所带来的严重免疫反应有关[3]。与之相比,非病毒载体具有更加优越的安全性,且易于制备,可携带大量核酸,但其缺点在于转染效率低下,基因表达的持续时间短。
传统的非病毒载体包括物理载体及化学载体,物理递送方式包括直接注射裸DNA、电穿孔、基因枪、声孔效应、流体动力基因转移等。但这些治疗方式并不能有效的保护基因不被核酸酶降解。化学载体包括无机纳米颗粒(二氧化硅、磁性纳米粒子、磷酸钙、金纳米粒子、碳纳米粒子、量子点等)、阳离子聚合物、脂质体等。这些载体易于被化学基团包装修饰,从而克服将基因递送入核的层层障碍[4]。但是,早期的非病毒载体存在作用单一、靶向性差、转染效率低且无法示踪等缺点,以至不能达到很好的治疗效果。为此,近年来,人们发展了一系列多功能病毒载体。
1 多功能非病毒载体概述
多功能非病毒载体是在传统非病毒载体的基础上研发出的一系列具有多项功能的非病毒载体递送系统。它将多种功能整合于同一个非病毒载体中,使之能同时实现靶向、成像、示踪、光热疗、载药或可控释药等。例如Kogure等[5]设计了多功能包络型纳米器件(multifunctional envelope-type nano device,MEND),这种MEND可以通过层层包装,在特定时点执行特定的功能,从而实现将基因递送入核的屏障。它们可以通过表面官能化来减少网状内皮系统的摄取、逃逸细胞的内吞作用、保护核酸免于过早降解、添加配体以靶向到达肿瘤部位[6]。
此外,一些无机纳米粒子也可以利用其自身材料特性,发展为多功能载体。例如磁性纳米颗粒可以作为磁共振成像的造影剂;金纳米颗粒可以产生光热效应;量子点颗粒可以进行示踪成像;还有些纳米颗粒可同时搭载药物与基因。对这些特殊的材料进行包装,不仅能有效的将基因药物递送入细胞内,同时能通过外部干扰达到最佳的抑癌作用。如今发展的“组合”纳米医学,将多功能非病毒载体运用于化学药物的递送,已在癌症治疗中进行了大量的实验,证实能够有效减少肿瘤细胞的耐药性及化疗药物的副作用[7]。虽然,多功能非病毒载体在运载基因中的应用不如化学药物成熟,但是也处于快速发展中。
目前,多功能非病毒载体在肿瘤基因治疗领域涵盖了影像导向基因治疗、光热驱动基因治疗和联合药物基因治疗等。
2 多功能非病毒载体的应用
2.1 影像导向基因治疗
影像导向基因治疗,是指非病毒载体既可以进行影像成像,又可以进行基因运载,在医学影像导向作用下实现肿瘤的基因治疗。影像导向基因治疗的多功能非病毒载体以磁性纳米颗粒最为常见。磁性纳米颗粒是指具有磁性的铁、镍、钴等材料合成的纳米颗粒,它们可在临床实践中被用作磁共振成像(MRI)的对比增强剂。以氧化铁为核心材料合成的超顺磁性氧化铁纳米粒子(superparamagnetic iron oxide nanoparticles,SPIONs)在生物医学应用中作用广泛[8]。使用磁性纳米颗粒作为递送基因的载体可以通过多种方式提高癌症治疗的有效性。首先,磁性纳米颗粒可作为造影剂用于MRI监测并定量测定其在体内的分布情况,这有利于控制药物剂量。第二,通过成像作用可以对疗效进行评估。第三,磁性纳米材料通过影像导向作用可以靶向于肿瘤的特异位点,从而提高了治疗的选择性,减小副作用,降低治疗成本。同时,利用磁场驱动是一种非侵入性的治疗方式[9]。
Wu等[10]运用了SPION运载siRNA治疗肝细胞癌(hepatocellular carcinoma,HCC),用聚乙二醇(PEG)连接聚乙烯亚胺(PEI)对SPIONs进行官能化修饰,并连接三肽精氨酸甘氨酸天冬氨酸(RGD)从而使siRNA能够靶向且高效地到达HCC细胞中,SPION可作为体外和体内成像的MRI探针,对此递送系统的治疗效果进行了评估。同样针对HCC,Guo等[11]利用叶酸靶向递送系统Fa-PEG-g-PEI-SPION/p siRNA-TBLR有效地使人类HCC细胞系中的TBLR1基因沉默,从而抑制HCC细胞增殖及血管生成。该递送系统因包含SPION,对于MRI检测具有高灵敏度,使其可以运用MRI技术轻松追踪载体的递送途径。
除HCC以外,影像导向基因治疗还广泛应用在其他类型的癌症研究中。Gd-NGO/Let-7g/EPI递送系统通过对钆(Gd)官能化修饰,将miRNA递送至人类胶质细胞瘤细胞,同时可作为造影剂帮助确定血脑屏障的开放位置和开放程度,以便精准计算药量[12]。Lin等[13]运用SPION通过MRI导向将siRNA递送入人乳腺癌MCF-7/ADR细胞,以克服多药耐药性乳腺癌。Fe3O4@SiO2(FITC)PEI-FA/Notch-1 shRNA递送系统能够高效率将Notch-1 shRNA递送入人乳腺癌MDA-MB-231细胞,同时有效保护shRNA免受外源性DNaseI和核酸酶的降解。磁共振成像和荧光成像显示癌细胞能优先吸收此纳米复合物[14]。此外,影像导向基因治疗还可应用于肺腺癌[15]、鼻咽癌[16]的治疗研究。
在众多研究应用中,我们发现SPIONs等磁性示踪载体材料在血液中代谢过快,具有不稳定性,这些缺点限制着其在临床上作为影像导向多功能非病毒载体的实用性,但将基因治疗与成像示踪技术结合在一起,为非病毒载体在肿瘤基因治疗应用上提供了一种新思路,通过实时成像有利于观察治疗基因在体内的分布以及肿瘤对治疗基因的反应,便于及时调整治疗方案等,这对临床肿瘤的诊断与治疗有着不可估量的价值。
2.2 光热驱动基因治疗
光热驱动基因治疗也是近年发展起来的一种新的基因治疗策略,是通过在组织中诱导热疗杀死癌细胞并协同基因治疗的一种新方法。传统的热疗通常是侵入性的,容易造成非特异性的细胞损伤。如今开发出的金纳米材料(AuNs)具有独特的光热性能,能够在近红外光(NIR)的照射下,将光能转化为热能,并且具有稳定性、良好的生物相容性和易于制备等优点[17]。运用此类载体将治疗基因递送入细胞内,同时在外部近红外光的照射下,对肿瘤部位进行非侵入性的光热疗法,从而达到更加有效的抑癌作用。
很多非病毒载体都可以用于光热驱动基因治疗,如金纳米棒(AuNRs)。Shen等[18]利用AuNRs作为siRNA的载体,在其表面运用PEI逐层组装修饰,使MDA-MB-231和SUM-159乳腺癌细胞系中的丙酮酸激酶同工酶M2(PKM2)表达下调。并在转染后用NIR照射AuNRs,在近红外辐射下,激发的带电粒子衰减到周围的介质中,产生热量,肿瘤细胞对热敏感,从而得以将基因治疗与光热疗法相结合,达到理想的抑癌作用。此外,利用壳聚糖-金纳米棒(Chit-Au NRs)递送系统可对三阴性乳腺癌同时进行基因沉默和光热消融治疗[19]。使用载有多西他赛(DTX)和p65 siRNA的金纳米棒能有效治疗转移性乳腺癌,抑制癌细胞的增殖和肺转移[20]。
除金纳米材料以外,能进行光热疗法的还有氧化石墨烯(GO)、单壁碳纳米管(SWNT)等。Yin等[21]将氧化石墨烯聚乙二醇化,有效递送HDAC1和K-Ras siRNA进入胰腺癌细胞MIAPaCa-2内,实现双重基因沉默效应并诱导细胞发生凋亡,同时联合使用NIR光热疗法抑制体内肿瘤体积增长>80%。运用功能化的单壁碳纳米管递送系统SWNT-PEI/siRNA/NGR作用于PC-3人前列腺癌细胞,基因沉默和NIR光热疗法的组合显著提高了治疗效果[22]。
碳纳米材料与金纳米材料都能有效地运载基因并介导NIR光热疗法。但是,仍有许多尚未解决的问题限制其临床应用。例如,剂量依赖性及细胞毒性,虽然材料本身可被认为无毒,但其修饰基团或降解产物仍然可能产生毒性。
2.3 联合药物基因治疗
由于肿瘤细胞对化疗药物的耐药性以及化疗药物带来的不良反应,传统化疗药物的抑癌作用非常局限。因此,基因与药物的联合递送系统近来受到越来越多的关注。将基因疗法与化学疗法结合,可以有效降低药物耐药性,协同增强抗癌效果。这种方法的难点在于如何进行共同递送,因为核酸与小分子药物具有显著不同的物理化学性质[23]。能够同时携带基因与药物的纳米载体要求具备非免疫原性、无毒、有效浓缩和固定核酸,并能够封装小分子等特点[24]。
Zheng等[25]应用 PEI修饰的新型 TPGS-b-(PCL-ran-PGA)纳米粒子同时递送肿瘤坏死因子相关凋亡诱导配体(TRAIL)和内皮抑素至HeLa细胞中,内皮抑素可以有效抑制血管生成,两者协同产生抗癌作用,使针对HeLa细胞的细胞毒性显著增加。Xiong等[26]基于β-环糊精共轭多聚赖氨酸(PLCD)与透明质酸共同递送靶向肝细胞癌(HCC)的基因和化疗药物,设计出了具有核-壳结构的新型超分子纳米粒子系统。该纳米颗粒可以通过CD44受体介导的内吞作用有效地将多柔比星(DOX)和oligo RNA转运到HCC细胞中,显著抑制细胞增殖。Reddy等[27]设计了pH敏感脂质体纳米载体用于同时递送紫杉醇和Bcl-2 siRNA,该多功能载体可以对黑色素瘤进行协同治疗,以减少化疗的耐药性。此外,联合药物基因治疗还广泛应用于胶质细胞瘤[12]、非小细胞肺癌[28]、结直肠癌[29]、乳腺癌[30]等肿瘤的治疗研究中。
联合药物基因治疗将化疗与基因治疗结合在一起,可以扬长避短,最大效率地发挥抗肿瘤的作用。通过减少药量从而减小对正常组织的损害及不良反应。并且由于靶向递送,使得药物强有效的针对肿瘤,从而进一步增强抗肿瘤效果。尽管联合治疗具有很大的优势,但将药物与基因在单一载体中有效的共同转运用于癌症治疗仍然是一个挑战。本文对多功能非病毒载体在肿瘤基因治疗中的应用进行了总结,见表1。
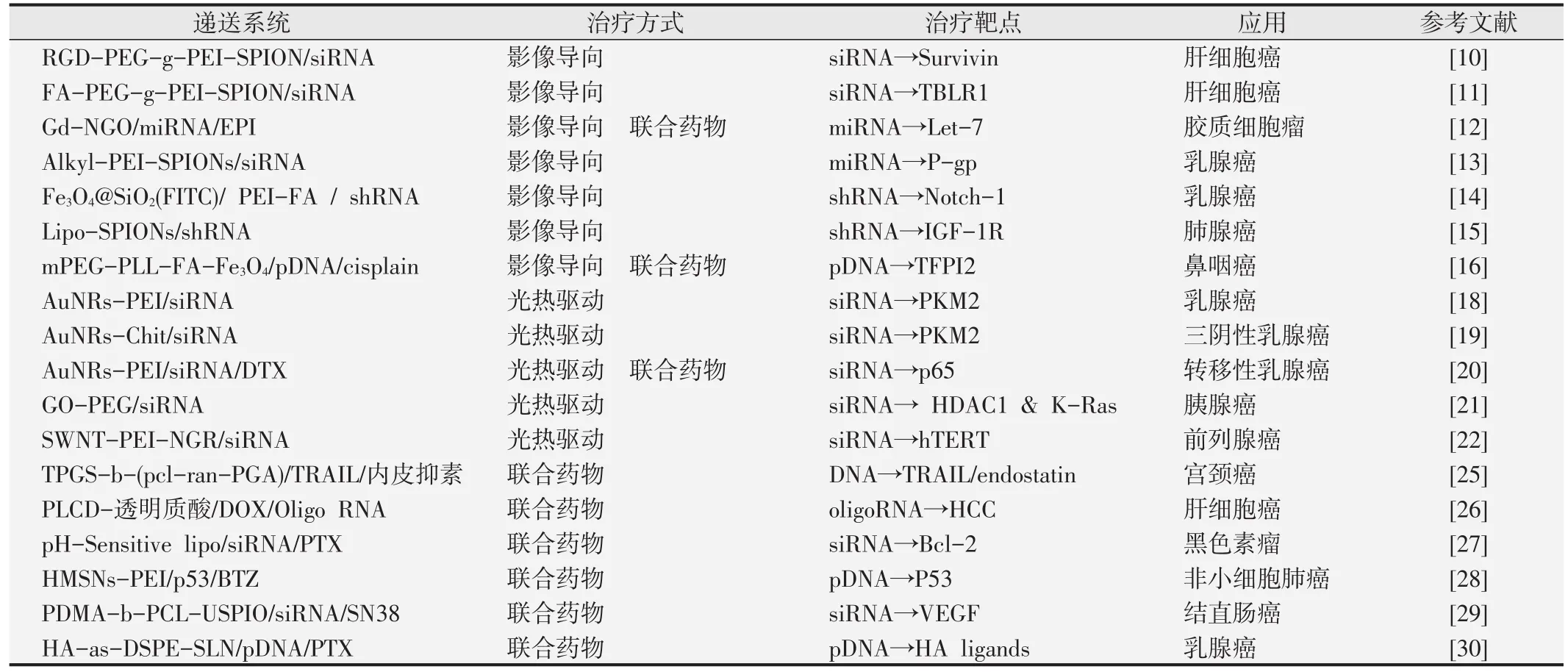
表1 多功能非病毒载体在肿瘤基因治疗中的应用
3 应用前景
将具有不同功能的元件组合成单个递送系统用于运载核酸,是一个具有潜力的策略,但方法仍然面临多种困境。包括“聚阳离子困境”、“PEG困境”、“包装与释放困境”[31],针对这些困境,人们也研究出了许多解决方案,例如增加或改变载体的表面涂层,轻微调整载体的内在结构。
但若想将多功能载体应用于临床,需要更加精确的评估载体的尺寸、表面特性及用于诊断与治疗的剂量,同时需要减小修饰其表面的化学官能团的细胞毒性,提高其生物相容性。从而得到一个理想方案,即得到一种递送系统,能够有高效的转染效率、低生物毒性、剂量可控、并能稳定且精准的到达肿瘤部位。
同时,我们更希望研究出能够发挥多项功能的载体材料,其不仅能够作为MRI的造影剂,且能在近红外光的照射下将光能转化为热能,同时能够稳定的联合运载基因与药物等,以期待其在临床应用中达到最佳的抑癌作用。
