基于TK6细胞的体外PIG-A基因突变检测方法的建立
2019-06-03李若婉周长慧黄鹏程
李若婉,周长慧,黄鹏程,常 艳*
(中国医药工业研究总院国家上海新药安全评价研究中心,上海益诺思生物技术股份有限公司,上海 201203)
遗传毒性的危害识别和风险评估在临床前化学品和药品的安全性评价中起着至关重要的作用。目前监管机构已通过一系列用于遗传毒性诱变剂检测的标准试验检测系统,体外试验包括基于细菌试验的Ames试验,基于哺乳动物细胞的tk基因突变试验以及HPRT基因突变试验;体内试验包括转基因动物试验,例如MutaTMMouse、BigBlueTM小鼠和Xenomouse小鼠转基因突变试验。
近年来,基于内源性磷脂酰肌醇聚糖A类基因(phosphatidylinositol glycan class-A,人类为PIG-A基因,啮齿类动物为Pig-a基因)在啮齿类动物中开发了另一种体内基因突变的检测方法[1]。细胞中PIG-A基因发生突变可导致细胞表面糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚的合成障碍并导致其锚链蛋白缺失。参与GPI锚合成的30多个基因中只有PIG-A基因位于X染色体。在胚胎发育中,两条X染色体中的一条随机灭活,因此一旦PIG-A基因发生突变,即可导致GPI锚合成障碍,并导致细胞表面锚蛋白(例如CD48、CD55、CD59、CD90)缺失[2]。啮齿类动物外周血Pig-a基因突变试验就是基于流式细胞术检测外周血细胞表面GPI锚链蛋白的缺失,推断Pig-a基因是否发生突变,进而判定受试物是否具有致突变性。该方法在美国、欧洲和日本均已开展联合验证,证实其可与其他遗传学试验终点结合综合评价受试物的遗传毒性,也可以整合至一般毒理学研究中[3]。
体外PIG-A基因突变检测方法是基于PIG-A基因物种保守性开发的,该方法既符合3R原则,又可以作为啮齿类动物Pig-a基因突变检测方法的补充[4]。Krüger等[5]率先使用了人成淋巴母细胞系TK6细胞,建立了通过流式细胞术检测TK6细胞中GPI(-)频率的方法。之后Rees等[6]对比了TK6细胞和MCL-5细胞应用于PIG-A基因突变试验的利弊,同时对流式细胞术的检测方法进行了优化。在Pig-a基因型与表型关系的研究中[7]已表明人PIG-L基因与PIG-A基因在TK6细胞GPI锚蛋白缺失中均发挥重要作用。McKinzie等[8]通过全基因组测序预测小鼠淋巴瘤L5178Y细胞系亦适合于体外Pig-a检测方法的开发,且有研究相继开发并验证了L5178Y细胞系的体外Pig-a检测方法[9-11]。本研究的目的是采用p53基因完整的人成淋巴TK6细胞为试验体系,采用免疫磁珠分离的方法清除TK6细胞中预先存在的GPI(-)细胞并测定TK6细胞的自发GPI(-)频率,然后以甲基磺酸乙酯(ethylmethylsulfone,EMS)与苯并芘(benzo[a]pyrene,B[a]P)为阳性对照品,建立基于流式细胞术的体外PIG-A基因突变检测方法,探讨其应用于药物遗传毒性早期筛选和评价的潜力。
1 材料与方法
1.1 主要材料与仪器
人成淋巴TK6细胞购自美国模式培养物集存库(American type culture collection, ATCC); 苯 并 芘 、甲基磺酸乙酯、多聚甲醛和放线菌素D均购自Sigma公司;RPMI-1640培养基、热灭活马血清、PBS和L-谷氨酰胺购自Gibco公司;APC鼠抗人CD19抗体(货号561742)、PE鼠抗人CD55抗体(货号341030)、PE鼠抗人CD59抗体(货号560953)和核酸染料7-氨基放线菌素D(7-Aminoactinomycin D,7-AAD)(货号 559925)均购自BD Bioscience公司;牛白蛋白(BSA)购自国药集团化学试剂有限公司;大鼠肝S9购自美国Moltox公司;肝S9辅助因子为本实验室制备的储备液;anti-PE磁珠、MACS分选柱和MACS分选器均购自Miltenyi Bioscience公司;细胞计数仪为丹麦Chemometec(型号NucleoCounter®NC-100); 流 式 细 胞 仪 为 BD 公 司AccuriTMC6 PLUS。
1.2 试验方法
1.2.1 细胞培养 TK6细胞培养于含10%热灭活马血清和2 mmol/L L-谷氨酰胺的RPMI-1640完全培养基中,于37℃、CO2体积分数为5%,加湿条件下悬浮培养。每周传代2~3次,细胞密度维持在0.8×105~1.0×106/mL之间。
1.2.2 受试物和体外代谢活化系统 EMS和B[a]P均以二甲亚砜(DMSO)为溶剂配制终浓度100倍的储备液,同时以1%DMSO作为本试验的阴性对照品。
体外代谢活化系统是大鼠肝S9和辅助因子的混合物,临用前新鲜配制,保存于冰上。大鼠肝S9在培养液中的终浓度为1%(V/V)。
1.2.3 清除TK6细胞中预先存在的GPI(-)细胞 传代培养的TK6细胞,计数后取约2×106个细胞,加入PBS洗涤1次。4℃、150 g离心5 min,弃去上清液,加入抗体染液 180 μL(含 CD19 抗体 40 μL、CD55抗体24 μL、CD59抗体40 μL以及2%BSA的PBS溶液),2~8℃避光孵育30 min。使用预冷的PBS缓冲液(含2%BSA)漂洗细胞。加入含anti-PE-微珠的PBS缓冲液(含2%BSA),2~8℃避光孵育30 min,加入预冷的PBS缓冲液(含2%BSA)将细胞重悬。随后,使用MACS分选柱和MACS分选器分离anti-PE-微珠标记的PIG-A基因野生型[即GPI(+)细胞]和PIG-A基因突变型[即GPI(-)细胞],收集吸附在分选柱中的TK6细胞,即GPI(+)细胞。最后,将分离获得的TK6细胞重新悬浮至RPMI-1640培养基中传代并扩大培养。使用流式细胞仪测定扩大培养TK6细胞中PIG-A基因的基础突变率,即GPI(-)细胞频率(CD55-CD59-/CD19+细胞群在CD19+细胞群中的频率)。
若基础突变率仍然较高(≥7.5×10-5),可重复清除过程。基础突变率合格的TK6细胞,扩增后进行冻存。后续新复苏的细胞传代时间不超过3~4周。所有操作步骤均在冰上避光进行。
1.2.4 TK6细胞中自发GPI(-)频率测定 将已清除预存GPI(-)细胞的TK6细胞维持0.8×105~1.0×106/mL的浓度传代培养,每4 d测定PIG-A基因突变频率。依据Glaab以及Tindall描述的方法计算GPI(-)细胞自发产生的频率[12]。以TK6细胞中GPI(-)频率为纵坐标,以传代培养天数为横坐标绘制图形,线性回归分析后,得到的斜率值/4,即为自发的GPI(-)频率。
1.2.5 EMS和B[a]P的体外PIG-A试验 受试物信息及浓度设置见表1。方法建立试验均使用已清除预存GPI(-)细胞的TK6细胞。

表1 受试物信息及浓度选择
24 h-S9和4 h+S9处理组分别选择EMS和B[a]P作为阳性对照。T25细胞培养瓶中分别加入阴性对照品或阳性对照品(加样体积1%)和细胞浓度为3.0×105/mL的细胞悬液10 mL,混匀后放入培养箱培养(第1天),其中+S9组细胞培养液中加入S9工作液,使S9的终浓度为1%。每个处理条件设置2个重复样。其中+S9处理组,细胞暴露于B[a]P 4 h后,将细胞用不含血清的培养基或PBS洗涤,之后加入1640完全培养基重悬后放入培养箱继续培养至24 h。-S9处理组,细胞直接暴露于EMS,连续处理24 h。
1.2.6 相对细胞增长数的测定 B[a]P和EMS组培养24 h后,使用细胞计数仪计数,计算相对细胞增长数(relative increase in cell count,RICC),用于受试物对细胞作用的评价。同时,每瓶取2×106个细胞,加入PBS缓冲液漂洗细胞,150 g离心5 min,弃上清。加入25 mL 1640完全培养基,调整细胞浓度至0.8×105/mL。将细胞接种到T75细胞培养瓶中继续培养。表达期细胞在第2、4、6、8、10天分别使用细胞计数仪进行计数,计算每个处理组在表达期内的RICC变化并且每次传代调整细胞浓度至0.8×105/mL传代培养(不足0.8×105/mL时,按照原浓度接种),第10天调整细胞浓度为1×105/mL传代。RICC计算公式如下:

*:接种细胞浓度为每次调整接种时的细胞浓度。
1.2.7 抗体标记及流式细胞术分析 在流式细胞术分析当天(第11天),使用细胞计数仪计数细胞。取阴性对照组细胞5份,每份1×106细胞。其中1份作为空白对照不进行抗体孵育,1份进行全抗体孵育(同1.2.3所示方法),另3份用于单一抗体染色180 μL孵育标记(分别仅标记CD19,CD55和CD59,核酸)。孵育完成单色标记的细胞后,加入600 μL固定液(含2.5 μg/mL放线菌素D、1%甲醛的PBS溶液)重悬细胞。每个样品取100 μL,混匀后,制备成为模拟样品。
PIG-A突变频率检测时,每个处理组取2×106个细胞转移至离心管,150 g离心5 min,弃上清后加入PBS缓冲液漂洗。漂洗后,将细胞加入到抗体染液中(配制方法同1.2.3所示)轻轻混匀置于冰上避光孵育30 min,加入预冷的PBS缓冲液(含2%BSA)漂洗细胞。每管加入核酸染液(含1 μg/mL 7-AAD的PBS溶液),置于冰上孵育10 min。漂洗细胞后加入600 μL固定液重悬细胞,转移至流式管,置于冰上或2~8℃待流式分析。过程如下:首先使用制备的3份单一抗体染色样品、一份空白样品和1份全染色样品进行模板建立。使用流式细胞仪逐个分析空白细胞样品,仅标记APC-CD19细胞样品,标记PE-CD55和PE-CD59细胞样品和仅标记7-AAD细胞样品,调节FL2-FL4、FL2-FL3和FL3-FL4荧光通道间补偿。最后分析模拟样品用于流式散点图的十字门位置确定。模板设立完成后,使用全染色样品验证建立的模板,并进行EMS和B[a]P处理样品及阴性样品的检测。设置流式细胞仪终止条件为:分析总细胞达到1×106个或分析样品体积达到400 μL。
1.2.8 结果判定标准 每组PIG-A基因突变率[即GPI(-)细胞频率]以 xˉ± s表示。至少一个浓度的GPI(-)细胞频率与阴性对照相比有2倍及以上增加且呈现浓度-效应关系,则判定为阳性结果。
2 结果
2.1 清除预先存在的GPI(-)TK6细胞
经过两次清除,本实验室TK6细胞中GPI(-)细胞的背景值由23.4%降低至2.5×10-5,符合文献建议的TK6细胞PIG-A基础突变率范围5×10-6~7.5×10-5[5],见图1。

图1 清除TK6细胞中预先存在GPI(-)细胞的情况
2.2 TK6细胞的自发GPI(-)率
自发GPI(-)率表示每天细胞分裂时自发产生GPI(-)细胞的频率。为了评估TK6细胞系的自发GPI(-)率,本试验每隔4 d测定GPI(-)率至第40天(后两次间隔8 d检测)。由GraphPad Prism 7软件拟合出自发GPI(-)率曲线,计算得出,自发GPI(-)率为每天5.04×10-7个。自发GPI(-)频率拟合曲线见图2。
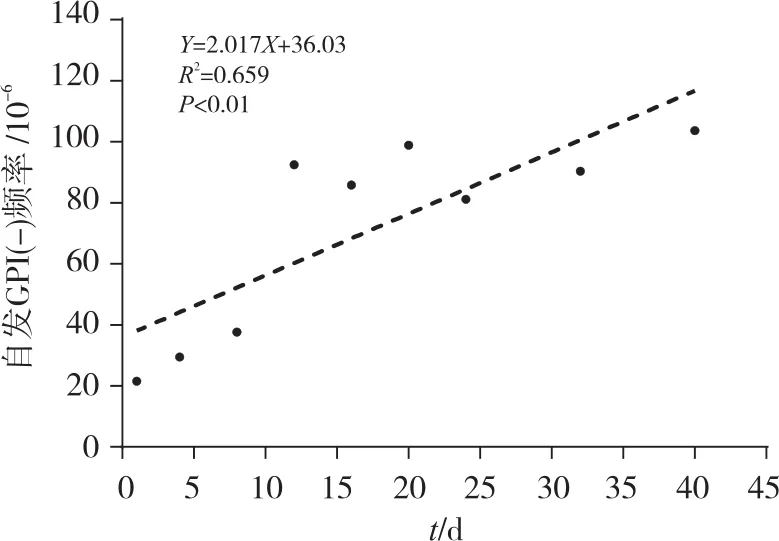
图2 TK6细胞自发GPI(-)频率拟合曲线
2.3 相对细胞增殖
使用表达24 h的RICC评价受试物对细胞的毒性作用,结果见图3。计算得出100 μmol/L EMS处理24 h后的RICC为45.13%(图3A)。16 μmol/L B[a]P处
理4 h并继续培养至24 h的RICC为31.86%(图3B)。

图3 EMS和B[a]P作用24 h后的RICC曲线
2.4 EMS和B[a]P的体外PIG-A基因突变试验
模板建立及样品检测流式图见图4。EMS 50、75和100 μmol/L各浓度组在-S9代谢系统条件下持续处理TK6细胞24 h。与阴性对照组相比,第11天的GPI(-)频率呈现浓度-效应相关性增加;其中75和100 μmol/L组GPI(-)频率增加2倍以上(图5A)。
B[a]P 4、8和16 μmol/L浓度组+S9代谢系统条件下持续处理TK6细胞4 h。与阴性对照组相比,第11天的GPI(-)频率呈现浓度-效应相关性增加;其中8和16 μmol/L组GPI(-)频率增加4倍以上(图5B)。
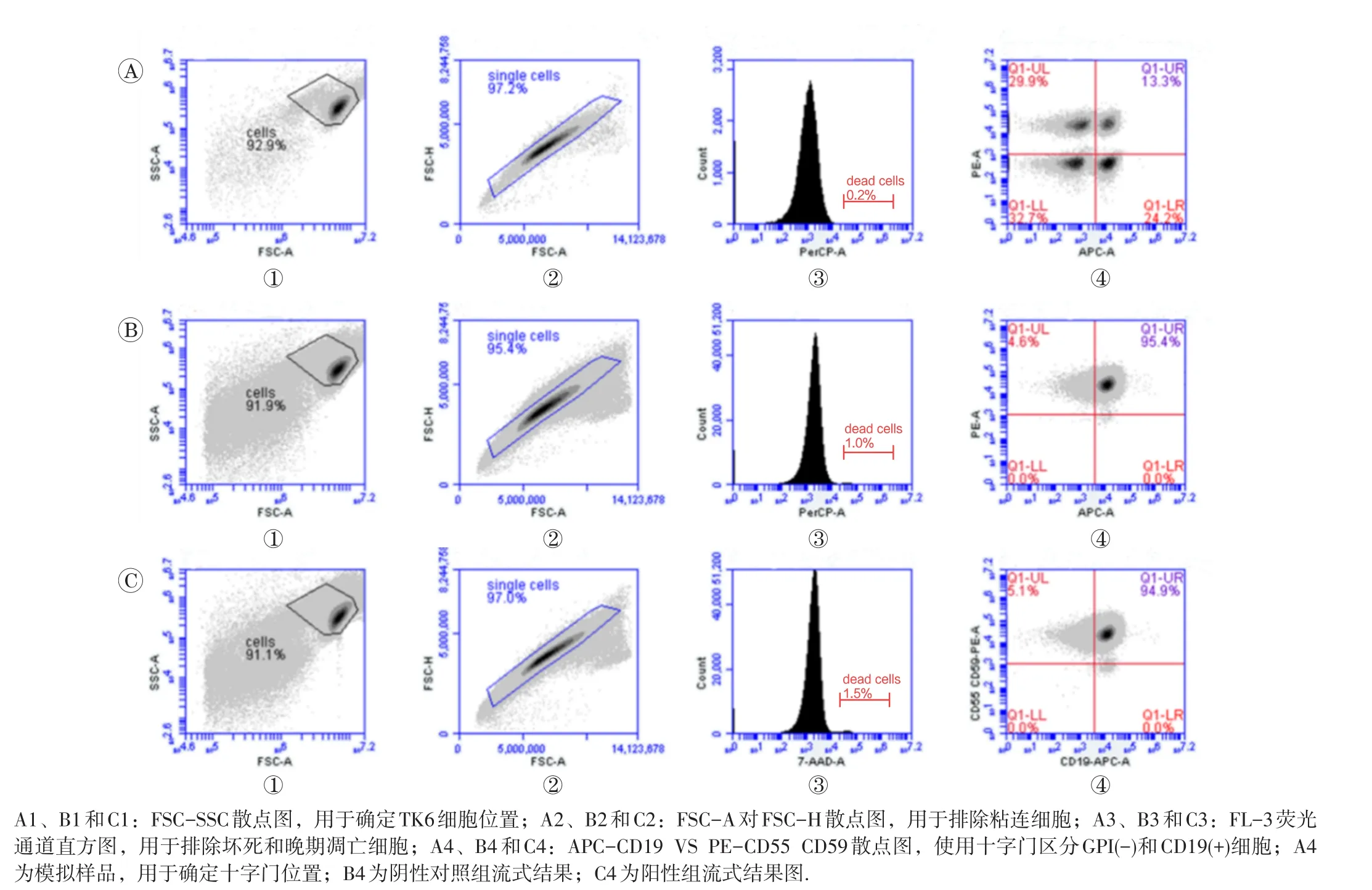
图4 流式检测模板及样品检测流式图
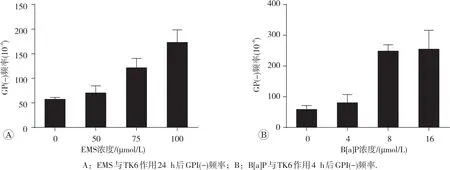
图5 EMS和B[a]P与TK6细胞作用后GPI(-)频率
2.5 EMS和B[a]P的突变表达期RICC
合适的细胞毒性选择对遗传毒性试验结果的判定至关重要,毒性表征不合适会导致与遗传毒性无关的假阳性结果[13]。本试验使用毒性表征参数24 h RICC评估了经EMS和B[a]P处理24 h后以及10 d表达期间的细胞毒性。EMS处理TK6细胞后,与对照组相比,48 h后的RICC降至最低(图6A),之后随着细胞的传代培养,RICC值逐步升高。在表达期结束时,RICC值接近100%。而B[a]P处理TK6细胞后,与对照组相比,24 h后RICC降至最低(见图6B)。之后随着细胞的传代培养,RICC值逐步升高。
3 讨论
本试验采用流式细胞仪分析EMS和B[a]P诱导TK6细胞产生的PIG-A基因突变结果均为阳性,提示本实验室初步建立了基于TK6细胞的体外PIG-A基因突变试验方法。后续,我们将应用多种机制的遗传毒性物质和非遗传毒性物质来继续验证该方法的灵敏度和特异性。
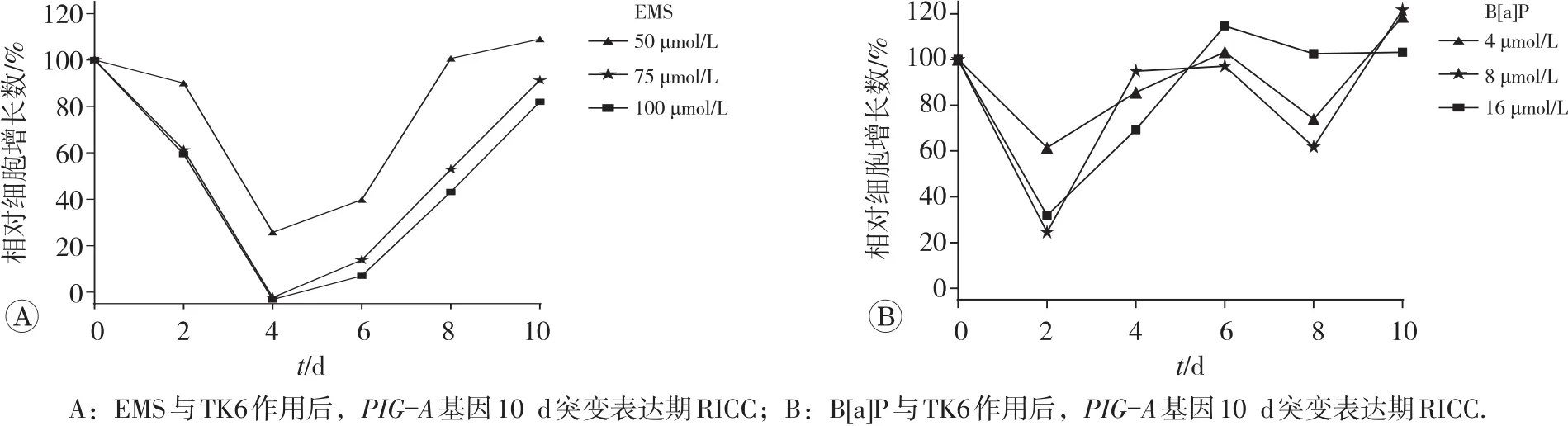
图6 PIG-A基因10 d突变表达期RICC
试验选择人成淋巴TK6细胞,该细胞系起源于人造血系统,可悬浮培养并且具有完整的p53基因功能,在遗传毒性试验中具有较高的灵敏度和特异性,可减少试验结果的假阳性[14]。但是,由于TK6细胞自发突变率较高,该细胞用于基因突变检测时对TK6细胞的传代次数要求较高,一般在复苏后传代10 d内开展实验。此外,长期冻存的TK6细胞在复苏传代后,需再次清除传代细胞中预先存在的突变细胞,以降低基础突变值,提高试验的灵敏度。同时,该细胞不表达代谢酶,在评价一些需经代谢活化的前致癌物时,需添加S9。因此,虽然TK6细胞本身在种属上优势巨大,但在试验可操作性上存在缺陷,未来可能需要测试更多的细胞株用于PIG-A基因突变试验,以获得自发突变率低、具有代谢能力和p53基因功能完善的人源化细胞用于该试验。
为了提高试验系统检测诱变剂的灵敏度,试验开始前需清除TK6细胞中预先存在的GPI(-)细胞。然而,流式细胞仪分选成本高,耗时较长,操作较复杂;免疫吸附分离方法分离效果较低;单细胞克隆分离方法耗时较长,操作复杂;抗体包被平皿吸附分离方法分离效率较低。啮齿类动物体内Pig-a基因突变试验中,Dertinger等[15]提出了利用免疫磁珠分离富集啮齿类动物红细胞Pig-a基因突变细胞的方法。本试验利用该分离原理尝试进行清除试验,最后通过洗涤收集MACS分选柱吸附的GPI(-)细胞,使长期传代培养的TK6细胞中GPI(-)背景值从分离前的23.4%降低到2.5×10-5。清除试验结果表明,该方法能以较高的分离效率去除人成淋巴TK6细胞中预存的GPI(-)细胞,此法不但分离效果好,而且操作简单、成本低廉、耗时短。
综上所述,相较于现有的基因突变检测方法,体外PIG-A基因突变检测方法操作简单、样品制备速度快、具有较短的试验周期、使用流式细胞仪检测可实现高通量检测;另一方面可以作为体内PIG-A基因突变试验的补充试验和其他致突变试验阳性结果的追加试验,具有应用于药物开发早期遗传毒性筛选和评价的潜力。
