成纤维细胞生长因子结合蛋白2过表达促进食管癌细胞的增殖
2019-06-03孙晓男杨荔艳王明荣郝佳洁贾雪梅
孙晓男,苑 青,杨荔艳,张 钰,蔡 岩,徐 昕,王明荣,郝佳洁,*,贾雪梅*
(1.安徽医科大学组织胚胎学教研室,安徽合肥 230032;2.国家癌症中心/中国医学科学院北京协和医学院分子肿瘤学国家重点实验室,北京 100021)
食管癌是人类消化道恶性肿瘤之一。食管癌的主要病理类型包括食管鳞癌和食管腺癌。中国人群最常见的病理类型为食管鳞癌[1-2](以下简称“食管癌”)。在中国,食管癌的发病率在恶性肿瘤中排名第5,死亡率排名第4[3],某些地区仍是世界上食管癌发病率最高的地区之一[4]。食管癌是一种进展迅速、预后较差的恶性肿瘤。一旦被诊断为食管癌,超过50%的患者为晚期肿瘤或伴有影像学上可见的远处转移瘤[5]。虽然大部分食管癌患者可以通过手术治疗,但仍有许多患者死于局部复发、病情进展及远处转移[6]。食管癌患者(包括食管腺癌患者)的总体5年生存率仅为15%~25%[7]。病理分期可以作为临床预后判断指标,但相同分期患者的预后可能存在很大差异,因此寻找与食管癌预后有关的分子标志物,对于食管癌患者临床治疗和提高生存率具有重要意义。
FGFBP2属于纤维母细胞生长因子结合蛋白家族基因,编码KSP37蛋白。据报道,KSP37蛋白是由细胞毒性淋巴细胞CTL和NK细胞选择性分泌的。KSP37蛋白表达升高与轻度外源性哮喘密切相关[8-9]。研究表明,FGFBP在致癌物诱导的皮肤状细胞癌和一些结肠肿瘤组织中高表达[10]。Yamanaka等[11]观察到FGFBP2低表达与胶质瘤患者的不良预后密切相关。然而,FGFBP2与食管癌之间的关系及其作用仍不清楚。
本研究中,我们采用组织微阵列联合RNA原位杂交技术检测FGFBP2 mRNA在食管癌组织中的表达,分析了FGFBP2 mRNA表达与食管癌患者临床病理参数和术后生存时间的相关性,探讨FGFBP2 mRNA表达是否可以作为食管癌预后判断的分子标志物。进一步通过功能研究,检测敲降FGFBP2对食管癌细胞系恶性表型的作用。
1 材料与方法
1.1 临床标本信息
190例食管癌组织和42例配对手术切缘形态学正常的组织(癌旁组织),取自河南省林州市人民医院病理科,上述标本来源于190例食管癌患者手术切除组织,其中71名患者具有完整的预后信息。本研究中使用的组织均为病理诊断后剩余的标本。所有患者术前均未接受任何治疗,并签署了知情同意书。本研究的设计和开展获得了中国医学科学院肿瘤医院伦理委员会的批准(16-084/1163)。
1.2 组织芯片制备
组织标本先经过福尔马林固定,石蜡包埋。然后切成厚度为4 μm的切片进行苏木精和伊红(HE)染色,显微镜下阅片,选取相应的组织蜡块标记。每个病例选取3个肿瘤组织点和2个正常组织点。将标记好的供体蜡块组织移入受体蜡块,切成厚度为(5±1)μm的组织微阵列。
1.3 RNA原位杂交及评分标准
FGFBP2的RNAscope探针购自Advanced Cell Diagnostics公司(ACD,Newark,LA)。相关程序参照说明书进行。组织芯片经过二甲苯脱蜡和梯度乙醇洗涤两次后,双氧水处理10 min,靶标修复液修复15 min;进行RNAscope探针杂交及放大处理,DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,封片后用NanoZoomer数字病理切片扫描仪(日本滨松)扫描。
评分采取双盲原则。FGFBP2 mRNA表达水平根据染色强度和阳性细胞百分比确定。染色强度分为0(阴性)、1(弱阳性)、2(中度阳性)、3(强阳性)。阳性细胞比例分为 0(0)、1(1%~20%)、2(21%~50%)、3(51%~100%)。肿瘤细胞染色强度×阳性细胞百分比的平均得分代表标本的最终得分。≥3分被认为是阳性。
1.4 细胞培养
人体食管癌细胞系KYSE30、KYSE70、KYSE140、KYSE150、KYSE450和KYSE510由日本京都大学的Shimada Y教授惠赠。细胞培养条件参考本实验室前期发表论文[13]。
1.5 小干扰RNA(siRNA)转染
FGFBP2 siRNA由上海GenPharma公司合成,其序列为:敲降靶点1(5′-CCTGACAGACAACCATCTCTT-3′)、敲降靶点 2(5′-GAACATTGTTGGAAACCCTTC-3′)和阴性对照 siRNA(5′-TTCTCCGAACGUGUCACGT TT-3′)。 使 用 Lipofectamine 2000(Invitrogen)转 染 48 h,采用实时荧光定量PCR(quantitative real-time PCR,qPCR)检测转染效率。
1.6 RNA提取、cDNA合成和实时定量PCR
使用RNApure组织和细胞总RNA提取试剂盒(康为世纪)提取细胞中总RNA。使用HiFi Script cDNA合成试剂盒(康为世纪)进行逆转录。qPCR操作步骤如文献[13]所述。引物序列:FGFBP2,5′-AGAGATTCCT GCACTATGCGT-3′(正向),5′-ACACCAGTAGGTCTG GTCTGT-3′(反向);内参 GAPDH,5′-TAGGCGCTCA CTGTTCTCT-3′(正 向),5′-GTTAAAAGCAGCCCTGG TGAC-3′(反向)。
1.7 细胞增殖检测
在KYSE150和KYSE510中转染FGFBP2 siRNA培养48 h后,收集细胞并进行计数,取1 000个细胞接种于含有100 μL RPMI-1640培养基的96孔板中,每组设置3个平行孔,于37℃、CO2体积分数为5%的培养箱中培养,每天取出一块96孔板进行检测。CCK-8(日本同仁化学)用RPMI-1640按1∶10比例稀释,每孔加入100 μL的CCK-8稀释液,于37℃培养箱中培养1 h。用酶标仪(BioTek)在450 nm处测量细胞的吸光度值,以不同处理组的吸光度值为纵坐标,培养时间为横坐标,绘制细胞生长曲线。
1.8 Western blot
转染48 h后收集细胞,用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液提取总蛋白。加入5×上样缓冲液,100℃煮沸10 min。采用Pierce BCA蛋白检测试剂盒(Thermo)测定蛋白浓度。20 μg蛋白质样品经过SDS-PAGE凝胶电泳和PVDF转膜,5%脱脂牛奶封闭1 h,一抗孵育过夜,二抗孵育1 h。采用超增强化学发光试剂(普利莱)检测发光信号。
实验过程中所用的AKT、p-AKT、ERK、p-ERK和E-cadherin一抗购自Cell Signaling Technology公司,均以1∶1 000比例稀释。GAPDH(Cell Signaling Technology)以1∶5 000比例稀释作为内参。
1.9 统计学分析
采用SPSS 17.0软件进行统计分析。使用χ2检验分析FGFBP2 mRNA在食管癌组织和正常组织中的表达差异。采用Kruskal-Wallis或Mann-WhitneyU方法分析FGFBP2 mRNA表达与临床病理指标之间的相关性。绘制Kaplan-Meier生存曲线,确定FGFBP2 mRNA表达与食管癌患者总生存时间的关系。单因素及多因素Cox回归分析不同因素对患者生存的影响。生存分析针对的是总生存时间,指的是患者从手术之日起到因食管癌死亡的时间或最后一次随访确定患者己死亡的时间。如到随访截止终点患者仍存活,则此随访数据截止。采用t检验对细胞增殖、侵袭和迁移数据进行组间差异比较。以α=0.05为检验水准。
2 结果
2.1 FGFBP2 mRNA在食管癌患者癌组织中的表达
我们对190例食管癌组织和42例癌旁组织进行mRNA原位杂交检测,结果显示食管癌组织中FGFBP2 mRNA的表达阳性率为25.8%(49/190),而在癌旁组织中不表达(图1)。FGFBP2 mRNA的表达水平在肿瘤组织和癌旁正常组织中的表达差异具有统计学意义(P<0.01),见表1。

表1 食管癌组织和癌旁正常组织中FGFBP2 mRNA的表达情况
2.2 FGFBP2 mRNA表达情况与食管癌患者临床病理指标的关系
我们分析了FGFBP2 mRNA的表达与食管癌患者临床病理指标之间的关系(表2)。结果显示,FGFBP2mRNA阳性表达与性别、年龄、T分期、淋巴结转移、分化程度和病理分期等指标均无显著相关关系(P>0.05)。
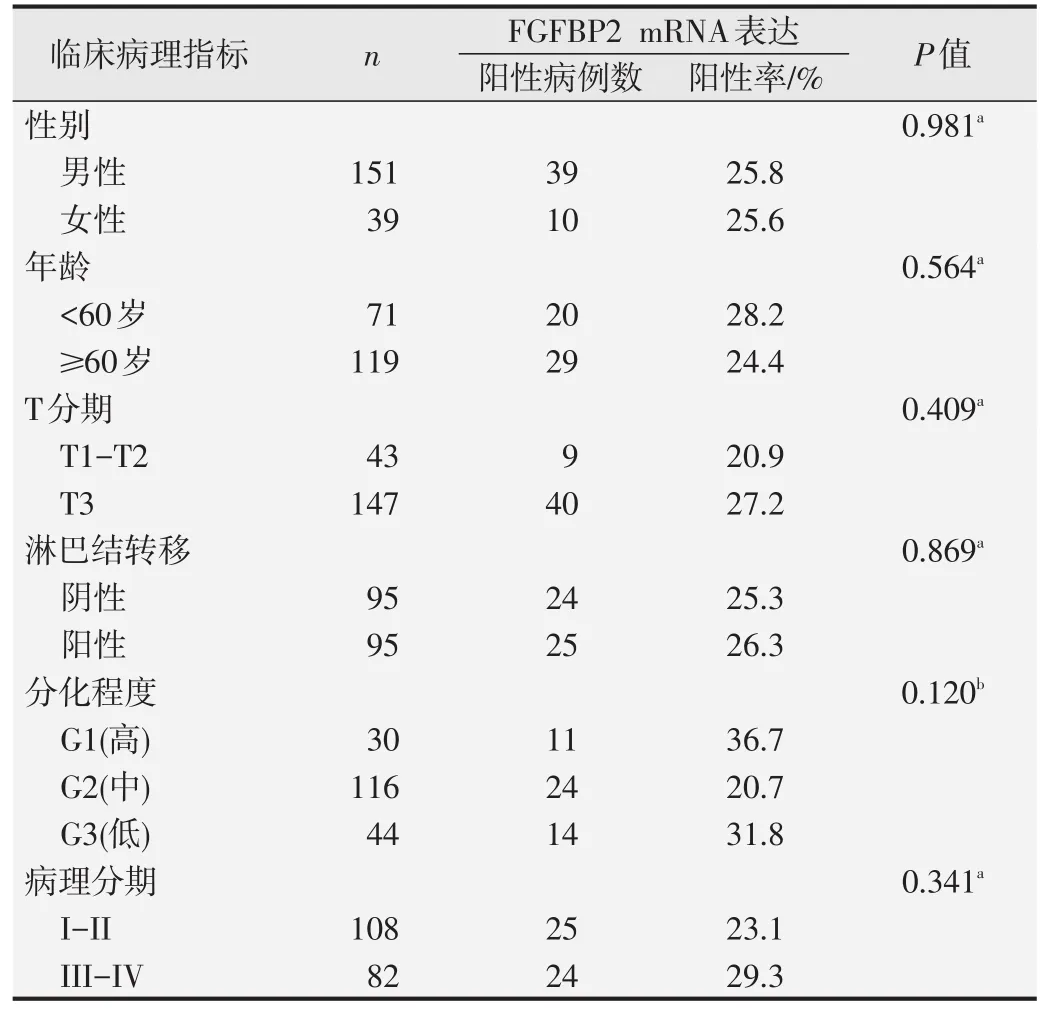
表2 FGFBP2 mRNA表达与食管癌患者临床病理指标的关系
2.3 FGFBP2 mRNA表达与食管癌患者预后的关系
对具有随访资料的病例进行Kaplan-Meier分析,结果显示FGFBP2 mRNA表达影响食管癌患者术后生存时间,且FGFBP2 mRNA表达阳性患者的总生存时间明显短于mRNA表达阴性的患者(P=0.002,图2)。
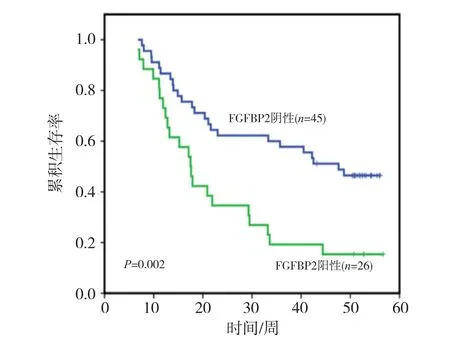
图2 食管癌患者FGFBP2 mRNA表达的Kaplan-Meier生存分析图
我们对食管癌患者临床病理指标和FGFBP2 mRNA表达进行了Cox单因素回归分析,进一步选取淋巴结转移和FGFBP2 mRNA表达进行了多因素回归分析,结果显示FGFBP2 mRNA表达可作为食管癌患者的一个独立预后影响因素,危险度为2.291,95%置信区间为1.271~4.129(P=0.006),见表3。
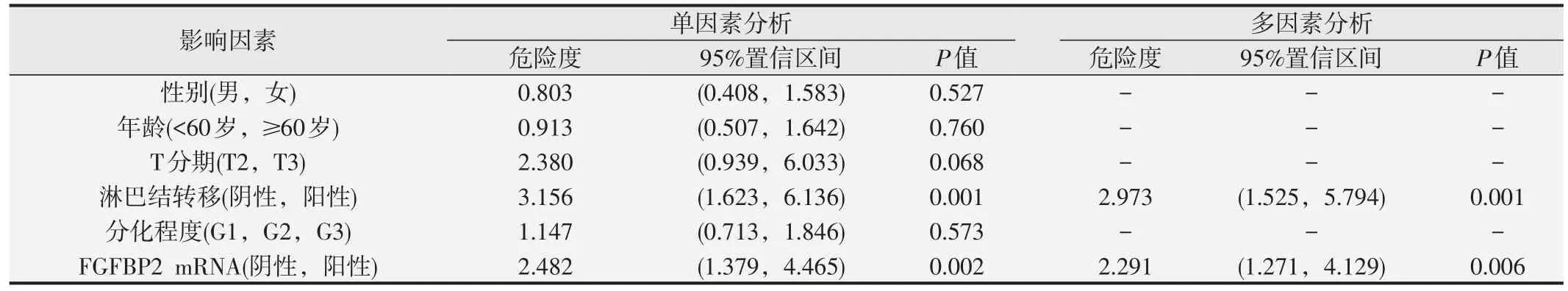
表3 Cox回归分析
2.4 敲降FGFBP2抑制食管癌细胞的增殖
利用qPCR技术检测6株食管癌细胞系中FGFBP2的表达,结果显示KYSE150和KYSE510中FGFBP2 mRNA水平高于其他细胞系(图3A),因此我们选取这两种细胞系进行敲降实验。与对照组相比,敲降FGFBP2基因可显著抑制KYSE150和KYSE510细胞FGFBP2 mRNA的表达(图3B,KYSE150细胞未给出)和增殖(图3C和3D)。我们进一步检测了与增殖相关分子的表达情况。Western blot结果显示,在KYSE150和KYSE510中敲降FGFBP2后,AKT的磷酸化水平降低,而ERK的磷酸化水平未发生改变(图4)。
3 讨论
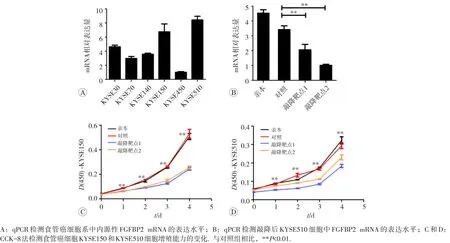
图3 敲降FGFBP2抑制食管癌细胞的增殖
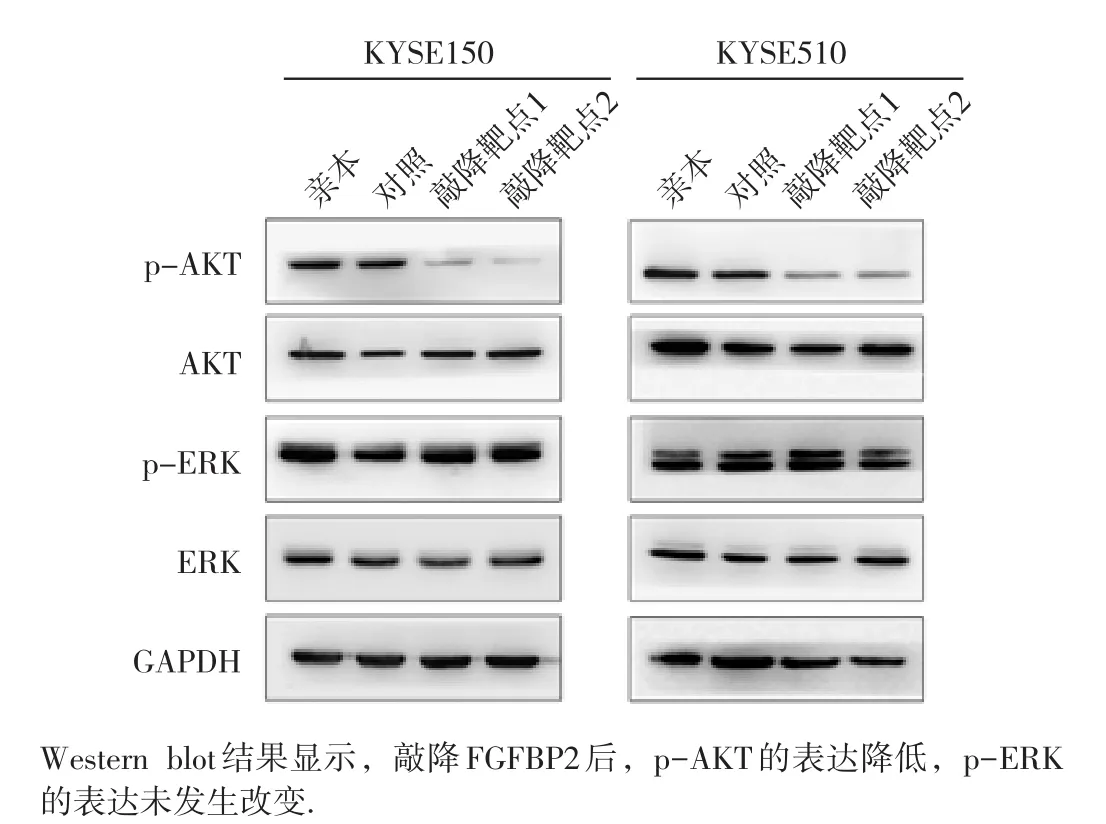
图4 敲降FGFBP2后下游分子的变化
肿瘤预后分子标志物的研发可能为肿瘤患者的治疗提供潜在的靶点、疗效预测及评价指标。目前已有大量报道采用qPCR技术获得食管癌潜在的预后判断mRNA标志物,例如ANRIL[14]、GOLM1-NAA35[15]等,也有非常少量的研究采用常规RNA原位杂交技术发现食管癌患者预后相关mRNA分子,例如Stathmin[16]、HCCR-1[17]等。然而,由于mRNA容易降解,特别是经福尔马林固定和石蜡包埋组织中的mRNA,导致qPCR和常规RNA原位杂交对于检测固定和包埋组织中的mRNA均有明显的局限性。因此,目前尚无任何一种mRNA标志物应用于食管癌临床检测。
RNAscope原位杂交是近年来发展的一种用于检测细胞以及经固定和包埋组织中目标RNA分子的原位杂交新技术,其利用双“Z”探针(靶RNA识别序列长约18~25个碱基)和信号放大系统,保证信号的特异性和强度,具有较高的灵敏度和较低的背景。特别是,该技术对于检测石蜡组织中的RNA分子,可以获得稳定可靠的结果。由于该技术通常针对目标RNA设计多对探针(可达20对),利用多个短探针覆盖目标RNA较长的片段,可以弥补固定和包埋样品中部分RNA降解对信号强度造成的影响[18-20]。越来越多的研究利用RNAscope原位杂交技术发现了肿瘤患者预后相关mRNA分子[21-24]。因此,该技术有望成为肿瘤病理诊断、治疗和预后判断的手段之一。Du等[25]通过对食管癌冰冻组织进行Western blot分析,以及对石蜡组织进行RNAscope原位杂交分析,验证了KRT17蛋白和mRNA在食管癌细胞中均存在高表达,而在正常上皮细胞中不表达,表明RNAscope检测结果具有较高的稳定性。然而,到目前为止,在食管癌中使用该技术原位检测RNA分子的研究很少,且尚无关于预后判断RNA标志物的报道。在本研究中,我们对食管癌组织中FGFBP2 mRNA进行了RNAscope检测分析,发现FGFBP2 mRNA在肿瘤组织中的表达水平显著升高。我们的结果显示,FGFBP2 mRNA仅在肿瘤细胞中高表达,而在正常组织、以及肿瘤中的间质细胞中均不表达,且原位杂交信号反差强;同时,其在预后较好和预后较差患者的肿瘤细胞中的信号反差也较明显,表明该探针具有较高的特异性。我们发现FGFBP2 mRNA表达是食管癌患者的一个独立预后影响因素,提示其有潜力作为食管癌患者预后判断的分子标志物,以及为T分期、淋巴结转移和分化程度等临床病理指标提供有效补充。
目前尚无关于FGFBP2在肿瘤发生发展中相关机制的研究报道。本研究结果揭示了FGFBP2在食管癌细胞中的潜在作用和相关信号通路的变化,发现FGFBP2高表达通过激活AKT信号通路,进而促进食管癌细胞的增殖。癌细胞增殖是肿瘤发生发展的重要特征,其受到缺氧诱导因子1、磷酸肌醇3激酶(PI3K)/AKT丝氨酸/苏氨酸激酶1(AKT)、胰岛素样生长因子受体1、细胞周期相关蛋白、以及雄激素和雌激素受体信号等的调控[26],上述信号通路和关键分子可能为恶性肿瘤提供辅助诊断标志物和潜在的分子靶点。PI3K/AKT和Ras/MEK/ERK是参与调控多种细胞增殖最重要的两条信号通路[27]。活化的AKT可通过调控多个下游关键信号节点,促进肿瘤细胞存活、增殖、生长和细胞代谢通路的改变[28]。
综上所述,我们的研究结果表明,利用RNAscope原位杂交技术检测的FGFBP2 mRNA表达有潜力作为食管癌患者的预后判断分子标志物。同时,本研究揭示了FGFBP2通过AKT信号通路对食管癌细胞增殖的作用,为进一步深入研究食管癌的发生发展机制以及发现新靶点提供前期实验基础。
