2种萱草属植物花器官自然衰老的阶段划分及抗氧化指标的变化
2019-06-01张建文崔虎亮史晓露亢秀萍
张建文,崔虎亮,史晓露,亢秀萍
(山西农业大学园艺学院,山西省设施园艺工程技术中心,山西 太谷 030801)
萱草属(Hemerocallis)是多年生草本植物,兼具观赏、食用和药用价值,且适应性广,在我国深受欢迎。萱草属有14 个原生种,现有品种多达8.3 万个[1-2],其中,黄花菜是重要的食用干菜,萱草类群是重要的园林绿化材料[3]。目前,关于萱草属植物的研究主要集中于种质资源评价与分类[4-8]、功能物质检测和提取[9-11],以及形态学鉴定[12-14]。然而,萱草在自然条件下花器官衰老速度较快,单朵花从开放到衰老仅仅24~48 h[15],直接影响到萱草花朵的观赏和食用价值,而有关萱草花器官衰老的研究尚无报道。
本试验选择黄花菜类群和萱草类群的代表性品种为试验材料,通过探究其花器官衰老过程中相关生理生化指标的变化,分析萱草衰老过程中的主要影响因素,旨在为提高黄花菜产量、延长采摘期、提高萱草观赏价值提供理论依据,对探析萱草花器官自然衰老机制及其产业价值开发具有重要意义。
1 材料和方法
1.1 试验材料
本研究选择黄花菜品种茄子花(Hemerocallis cv.Qie Zi)和萱草品种宿迁3 号(Hemerocallis cv.Suqian 3)2 个品种进行试验,相关试验材料均栽培于山西农业大学园艺站萱草种质资源圃。
1.2 试验方法
本研究于2018年6—12月进行。根据萱草属植物开花动态变化特性,划分成蕾期和花期2 个阶段,蕾期根据花蕾生长情况进行样品采集,其中,茄子花采集 4,7,10,13 cm(A1~A4)长度的花蕾用于后续试验,宿迁 3 号采集 2.85,4.7,6.55,8.4 cm(B1~B4)长度的花蕾用于后续试验。笔者观察发现,在连续晴朗的天气下,宿迁3 号花蕾通常在3:00—3:30开口,茄子花通常在 17:50—18:20 开口,2 个品种的单朵花从开口至完全衰败仅20 h,因此,本研究在2 个品种花蕾初开后,每间隔2 h 采集一次样品,直至花朵完全衰老,最终茄子花共采集10 次(A5~A14),宿迁 3 号共采集 12 次(B5~B16)。不同采样时期花器官形态如图1所示。
将内瓣、外瓣、雄蕊和雌蕊手动分离进行各项指标的测定。利用天平称量鲜质量,然后105 ℃杀青10 min 后80 ℃烘至恒质量;参照高俊凤[16]的方法测定相关生理指标,其中,丙二醛(MDA)测定采用硫代巴比妥酸法(TBA),超氧化物歧化酶(SOD)测定采用氮蓝四唑法(NBT),过氧化物酶(POD)测定采用愈创木酚法。

2 结果与分析
2.1 萱草花器官不同时期花蕾和花冠直径的变化
从图1可以看出,2 种萱草品种蕾期可划分为初蕾期(A1~A2,B1~B2)、中蕾期(A3,B3)和成蕾期(A4,B4)共 3 个时期,其中,初蕾期至中蕾期花蕾长度和直径均有明显增加,而成蕾期的花蕾已临近开放,在花蕾长度和直径上不再有明显变化;花期可划分为开口期(A5,B5)、初开期(A6~A7,B6~B7)、盛开期(A8~A9,B8~B9)、始衰期(A10,B10~B11)、衰败期(A11~A12,B12~B13)、落花期(A13~A14,B14~B16)共 6 个时期,其中,开口期至盛开期的花冠直径呈现不断增长趋势,而进入始衰期之后,花器官开始闭合,并丧失水分,花朵的观赏性大大下降,而衰败期的花器官基本接近死亡。
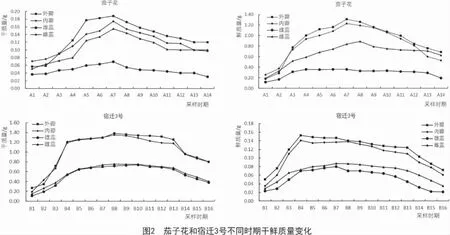
2.2 萱草花器官不同时期样品干鲜质量变化规律
随着采样时间的变化,茄子花和宿迁3 号的干质量和鲜质量总体呈现先升高后降低的趋势,具体如图2所示。从图2可以看出,茄子花花器官各个部位的干质量均在A7 时期达到最高,外瓣、内瓣、雌蕊和雄蕊分别为 0.19,0.17,0.16,0.07 g;外瓣、内瓣和雄蕊的鲜质量也在A7 时期达到最高,分别为1.31,1.23,0.36 g,雌蕊鲜质量在 A8 时期达到最大值(0.89 g),此后逐渐下降。而宿迁3 号在B1~B4 阶段干鲜质量迅速增加,外瓣和内瓣干质量在B4 时期达到最高,分别为0.153,0.141 g,雌蕊和雄蕊在B7 时期达到最大,分别为 0.088,0.080 g,然后开始缓慢下降;鲜质量自B5 时期缓慢上升,至B8 时期达到最高,雄蕊、雌蕊、内瓣和外瓣干质量分别为0.72,0.76,1.35,1.38 g,然后才开始缓慢下降。在干鲜质量最高时期,茄子花和宿迁3 号各个部位干鲜质量均是外瓣最高,其次为内瓣和雄蕊,雌蕊干鲜质量最低。
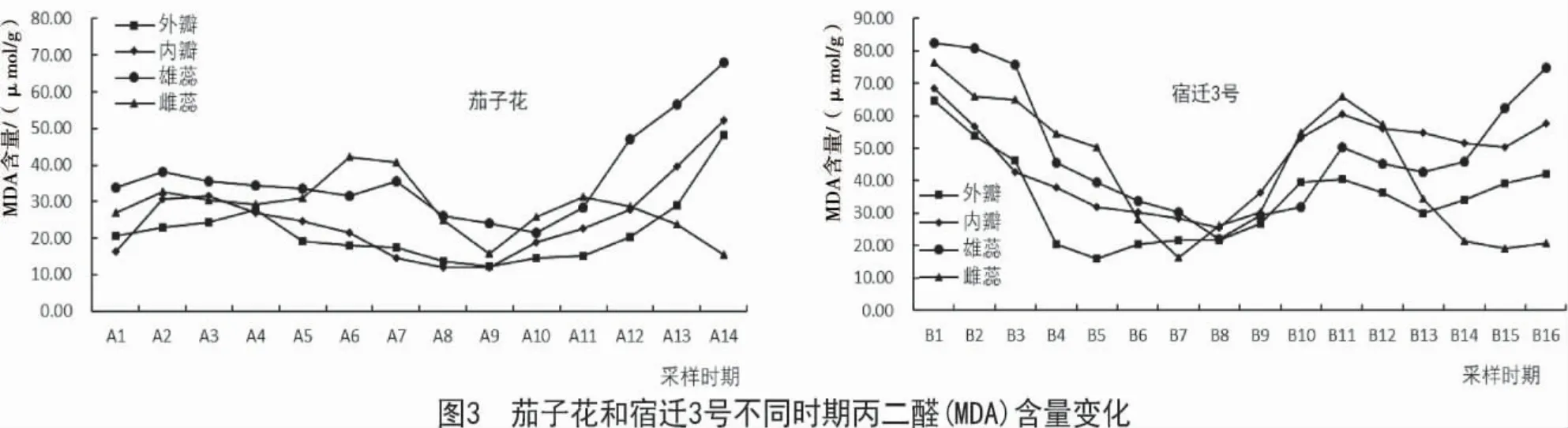
2.3 丙二醛(MDA)含量的变化
丙二醛是植物膜脂化过程的最终分解产物[17],随着2 个品种的自然成熟和衰老,MDA 含量变化趋势存在明显差异(图3)。茄子花在A1-A2(初蕾期)不同部位MDA 含量均呈现上升趋势,之后外瓣、内瓣和雄蕊总体均为开始缓慢下降趋势,外瓣和内瓣在A9(盛开期)达到最低,内瓣含量最低,仅为 11.97 μmol/g,外瓣为 12.15 μmol/g;雄蕊在 A10时期(始衰期)达到最低,为 21.48 μmol/g;雌蕊在A1~A6 时期总体呈上升趋势,之后下降,在A9 时期达到最小,为 15.60 μmol/g,此后,A9~A11 时期呈上升趋势,A11~A14 时期呈下降趋势。宿迁3 号不同部位的变化趋势基本一致,均在B1 时期(初蕾期)最高,其中,雄蕊的MDA 含量最高,达到82.40 μmol/g,其次是雌蕊,为 76.46 μmol/g,然后是外瓣(64.55 μmol/g)和内瓣(68.41 μmol/g),此后即呈现不断下降的趋势,外瓣在B5 时期(开口期)达到最低(15.80 μmol/g),雌蕊在 B7 时期(初开期)达到最小(16.10 μmol/g),内瓣和雄蕊在 B8 时期(盛开期)达到最小(分别为 25.48,21.90 μmol/g);随着内外瓣的不断展开,MDA 含量逐渐升高,但是外瓣、内瓣和雄蕊在B14~B16 时期(落花期)依旧呈现先下降后升高的趋势。
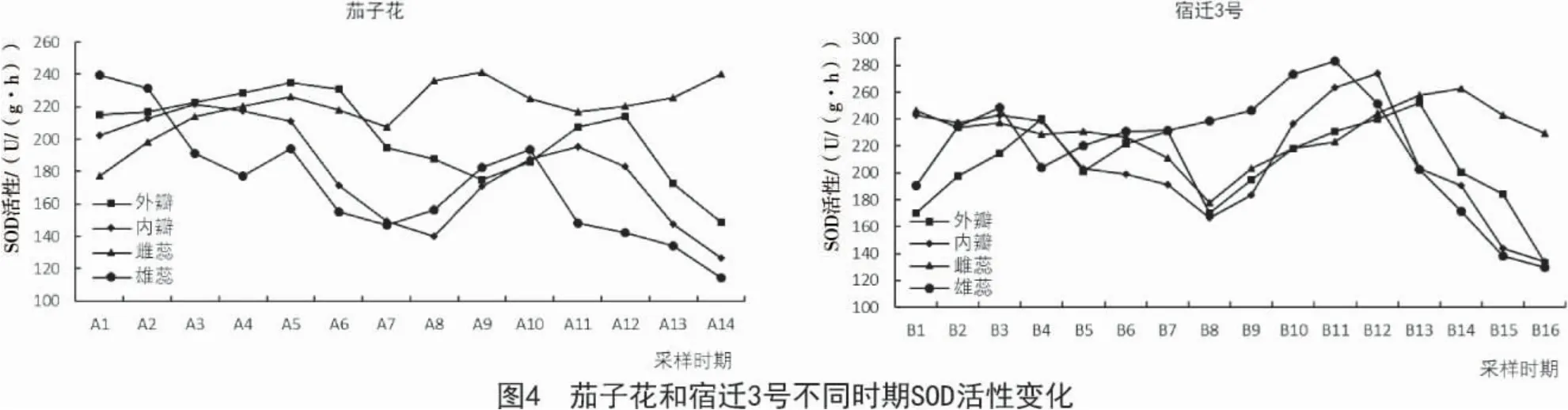
2.4 SOD活性变化
本研究中,随着花器官的不断衰老,2 个品种的SOD 活性除雌蕊外,其余3 个部位均从衰败期(A11~A12,B12~B13)开始呈现大幅下降趋势,并在落花期(A13~A14,B14~B16)降到最低(图4);茄子花雌蕊的SOD 活性从衰败期(A11~A12)到落花期(A13~A14)一直呈上升趋势;宿迁3 号雌蕊的SOD 活性却从落花期(B14~B16)开始呈下降趋势,但活性还很高,活性达到229.57 U/(g·h)。
在茄子花中,随着花器官的不断衰老,外瓣和内瓣的SOD 活性均呈先升高、后下降、再上升、最后下降的趋势,外瓣在开口期(A5)活性达到最大(235.12 U/(g·h)),内瓣在中蕾期(A3)活性达到最大(221.65 U/(g·h));而雄蕊的SOD 活性呈先下降再上升后下降的趋势,在A1 时期(初蕾期)最大(134.26 U/(g·h)),在A14 时期(落花期)降到最小(114.263 U/(g·h));在雌蕊中SOD 活性总体呈现上升趋势,在A5 时期(开口期)和A8 时期(盛开期)之间出现稍降低后上升的趋势,SOD 活性总体较高。
在宿迁3 号中,随着花器官的不断衰老,外瓣和内瓣在盛开期(B8)活性最小(分别为170.24,166.33 U/(g·h)),之后变化趋势均为先上升后下降,分别在B13,B12 时期达到最大,活性值分别为252.35,274.42 U/(g·h),但总体趋势基本相同;雄蕊中的SOD 活性总体呈先上升后下降的趋势,在始衰期(B11)达到最大,活性值达到283.65 U/(g·h)。
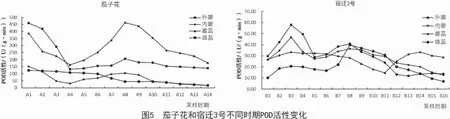
2.5 POD活性变化
由图5可知,随着花器官的不断衰老,茄子花和宿迁3 号的POD 活性变化存在明显区别。在茄子花中,外瓣POD 活性较内瓣变化幅度小,外瓣在蕾期活性急速下降,但外瓣和内瓣总体变化趋势基本一致;雌蕊POD 活性呈先下降后上升再下降的趋势,且在A4(成蕾期)总体高于其他3 个部位;雄蕊总体呈下降趋势,在落花期(A13~A14)降到最小(16.02 U/(g·min));此外,外瓣、内瓣和雌蕊均在盛开期(A8)达到最大,活性值分别为205.46,103.7,463.57 U/(g·min)。
在宿迁3 号中,随着花器官的不断衰老,外瓣和内瓣的POD 活性变化趋势基本相同,均在初蕾期(B1~B2)快速上升,中蕾期(B3)达到最大,其中,外瓣活性值为58.00 U/(g·min),内瓣活性值为48.88 U/(g·min),然后快速下降,开口期(B5)之后又开始上升,在盛开期(B8)达到最大,后又开始缓慢下降;雄蕊从初蕾期到盛开期(B8)总体表现为上升趋势,同样在盛开期(B8)达到最大(39.94 U/(g·min));而雌蕊却从蕾期(B1~B3)迅速上升,到始衰期(B10~B11)逐渐下降,在始衰期(B11)达到最小,后呈现缓慢上升趋势,在落花期(B15~B16)稍下降,但高于其他3 个部位。
3 结论与讨论
衰老是生物界的正常现象,学界普遍认为自由基的产生是植物衰老的主因。花器官通常包括萼片、花瓣、雄蕊、雌蕊等部位,不同部位的生理生化特征往往有所区别。本研究分别选取萱草属植物中黄花菜和萱草2 个不同品种类群中的代表性品种茄子花和宿迁3 号,于蕾期和花期各个时期分别采样,测定其干鲜质量和MDA,SOD,POD 的变化。结果表明,外瓣、内瓣、雄蕊和雌蕊4 个部位在不同时期各项指标的差异较为明显,张永平[18]对蝴蝶兰花器官不同部位自然衰老生理指标的研究也得出相似结果。可见,植物花器官不同部位在开花过程中存在不同的生理响应规律。花蕾生长发育的过程是干物质不断积累的过程,而花器官衰老的过程则是代谢物质不断消耗的过程,这在本研究中十分明显,随着采样时间的变化,茄子花和宿迁3 号花器官各个部位的干鲜质量均呈现先增高后下降的趋势,且均在盛花期达到最大值。
植物自身的防卫体系能够维持活性氧的产生与清除的平衡,活性氧自由基的积累与植物成熟和衰老密切相关[19],而SOD 和POD 是活性氧清除的关键酶;MDA 是活性氧积累诱发膜脂过氧化最重要的产物之一,它的含量可以间接反映细胞膜系统受损程度。大丽菊花器官衰老过程中,花瓣的SOD和POD 在其衰老前期呈现上升趋势[20];而蝴蝶兰的自然衰老,除萼片中的SOD 活性在初开期有小幅回落外,萼片、花瓣和唇瓣的SOD 活性总体呈上升趋势,而从衰老前期开始MDA 含量呈急剧上升趋势[18]。本研究中,雄蕊、内瓣和外瓣的SOD 和POD在花蕾开口后总体呈上升趋势,但进入衰败期后开始下降,而MDA 含量开始快速上升,这表明萱草花器官活性氧清除能力急剧丧失,活性氧大量积累,致使膜系统受到严重伤害,是导致萱草单朵花期较短的重要因素。
雌蕊在落花期的SOD 活性和POD 活性呈上升趋势,且活性很高,MDA 却呈下降趋势,这可能是由于雌蕊受精后正在发育成种子,代谢活动旺盛,酶活性升高从而保护细胞膜系统免受损害,但这还需要进一步的试验来证明。此外,2 个品种的SOD活性都呈现出从始衰期(A10,B10~B11)开始,按雄蕊、内瓣、外瓣、雌蕊先后顺序活性下降的规律,这与笔者观察到的外部形态衰老顺序基本一致:雄蕊最先,内瓣其次,外瓣再次,雌蕊最后。而POD 活性在整个过程中没有出现这种规律,除茄子花的雌蕊外,整体变化平缓,与此同时宿迁3 号活性很小,对花的整个发育过程作用较小。因此,可以看出,在整个萱草花发育过程中,SOD 是决定花快速衰老进程的重要因素之一。
综上所述,萱草花器官发育和衰老可划分成花蕾阶段和开花阶段2 大时期,其中,花蕾阶段包括3 个时期,开花阶段包括6 个时期;花蕾阶段干物质不断积累,进入开花阶段后物质代谢加快。萱草花器官衰老过程中活性氧清除能力在花蕾阶段较高而进入开花阶段后迅速下降。同时,萱草花器官不同部位的生理指标变化并不一致,证明萱草花器官不同部位存在不同的自然衰老进程。
