胰腺实性假乳头状瘤与非功能性神经内分泌肿瘤的多层螺旋CT鉴别诊断
2019-05-31赵莹佳殷小平闫旭新王谦刘洋周志强
赵莹佳 殷小平 闫旭新 王谦 刘洋 周志强
胰腺实性假乳头状瘤 (solid psuedopapillary tumors of pancreas,SPTP)在胰腺疾病中较为罕见,约占胰腺疾病的2%[1];胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PNET)起源于胰腺多能神经内分泌干细胞,根据其有无临床表现又分为功能性和非功能性PNET(non-functional pancreatic neuroendocrine tumors,NFPNET)[2]。SPTP 及 NFPNET的病理组织学特点极其相似,因此通过分析22例经病理确诊的SPTP及12例NFPNET病人的临床病史及影像资料,旨在获得更准确的检查手段,以利于肿瘤定性、临床确定诊疗方法及提示病人预后。
1 资料与方法
1.1 一般资料 对2013年5月—2018年8月间在河北大学附属医院行手术治疗并经病理确诊的22例SPTP及12例NFPNET病人的腹部平扫和增强CT影像资料进行回顾性分析。SPTP病人中7例因腹胀、腹痛入院,1例因发现腹部包块入院,14例为体检偶然发现且自身无任何不适。NFPNET病人中4例因腹胀、腹痛入院,1例因腰背部酸痛入院,7例为体检偶然发现。以上病人除外下述情况:①伴有其他胰腺疾病(如神经内分泌肿瘤)者;②虽术后病理结果证实,但影像资料不全或缺失;③影像资料提示此病,但病人保守治疗或转入上级医院治疗,且拒绝回访。
1.2 设备与方法 采用64层GE HD 750螺旋CT设备进行平扫及增强扫描。病人取仰卧位,扫描范围自膈顶至髂前上棘。扫描前8 h禁食,扫描前15min嘱病人适量饮水。扫描参数为:管电压120kV,管电流200~400 mA,准直器宽度0.625 mm×64,螺距1.0。使用非离子型对比剂碘海醇(含碘320mg/mL)80 mL,以3.0 mL/s流率推入肘正中静脉,而后继续注入30 mL生理盐水。动脉期及门静脉期延迟时间分别为30 s、90 s,部分病人于180 s行延迟扫描,三期扫描范围与平扫相同。
1.3 影像及病理分析 采用GE后处理系统(Advantage Workstation 4.6),由1名擅长腹部疾病诊断的影像科主治医师与1名副主任医师对所有病人的影像资料进行对比分析,若两者诊断意见产生分歧,则共同商议后获得一致结论。观察重点为增强后兴趣区(ROI)的选择、病灶位置、密度、长径等。病灶位置分为胰头部、胰体部、胰尾部,钩突部归为胰头部,胰颈部归为胰体部;密度分为囊性、实性及囊实性;若出现钙化则注意观察钙化的形态及部位;若病灶未见清晰边界则视为边界模糊;转移征象包括邻近器官的浸润及其他部位出现转移灶;强化特征主要判断强化峰值出现时相,计算强化幅度(强化峰值与平扫差值绝对值),并观察病灶的强化形态,测量CT值时注意ROI的选择要避开钙化及血管。病理切片行常规HE染色及免疫组织化学染色。
1.4 统计学处理 采用SPSS 22.0统计软件对数据进行分析。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验。计数资料以例表示,2组间比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 2组病人性别和发病年龄比较 SPTP组与NFPNET组性别差异无统计学意义(P>0.05)。NFPNET组发病年龄高于SPTP组(P<0.05),详见表1。

表1 2组病人性别和发病年龄的比较
2.2 2组影像资料比较 2组的边界、有无钙化、强化峰值出现时相、强化幅度、有无远处转移间差异均有统计学意义(均P<0.05),详见表2。SPTP组边界较NFPNET组清晰,且NFPNET组边界模糊的8例中有4例向周围脏器浸润 (图1);NFPNET组肿瘤钙化者少于SPTP组,SPTP组钙化多见于肿瘤包膜(图2);SPTP组强化峰值多出现于门静脉期 (图3),而NFPNET组强化峰值多见于动脉期(图4),且强化幅度较SPTP组高。SPTP组肿瘤实性成分于动脉期平均CT值为26~102 HU,门静脉期平均CT值为32~137 HU,NFPNET组肿瘤实性成分于动脉期平均CT值为20~250 HU,门静脉期平均CT值为36~140 HU,2组囊性成分均未见明显强化。NFPNET组发生远处转移者(图5)多于SPTP组。2组间肿瘤的位置、长径、密度、钙化出现位置、是否环形强化、有无导管扩张间差异均无统计学意义(均P>0.05),见表 2。
2.3 手术及病理 34例病人均为手术切除,SPTP组术式包括胰体尾并脾切除、胰体尾切除、胰十二指肠切除、胰腺中段切除并胰胃吻合术等,NFPNET组术式包括胰十二指肠切除、胰体尾并脾切除或保脾术、胰体尾并脾胆囊切除术等。免疫组织化学结果:SPTP 组 CK (+)、Ki-67 (+)、Syn (+)、Vimentin(+)、CD10(+),部分可见 CD56(+)、CD99(+),Ki-67≤2%19例,Ki-67≥3%3例;NFPNET组 CHG(+)、Syn(+)、Ki-67(+)、AE1/AE3(+),部分可见 CgA(+)、CD56(+)、CD99(+),Ki-67≤2%4 例,Ki-67≥3%8例,处于G1级肿瘤4例,G2级肿瘤8例。
3 讨论
3.1 一般情况 SPTP及NFPNET在胰腺肿瘤中均较少发现,但医学影像检查技术及内镜病理组织活检等手段不断完善,提高了两者的检出率。1996年WHO为了区别SPTP与其他胰腺肿瘤,将其命名为实性假乳头状瘤。SPTP一般为良性或低度恶性,但组织形态及生物学行为目前尚未明确,WHO将其认定为交界性潜在恶性肿瘤[3]。PNET自发现以来,尚不明确发病原因和具体机制,2010年WHO正式命名其为神经内分泌肿瘤,并认为此肿瘤生物学行为未定或偏恶性倾向[4]。NFPNET占PNET的10%~45%,因其不分泌有活性的神经内分泌激素,或分泌的少量神经内分泌激素并不对机体造成影响,故在临床上一般难以发现特征性症状[5]。另外,NFPNET缺乏特异性肿瘤标志物,对肿瘤的检出增加了难度,因此临床发现此病时大多为晚期。目前预后效果最好的治疗方法是手术切除病灶,也是临床医师最为推崇的有望治愈疾病的手段。SPTP好发于年轻女性[6],而NFPNET好发于年龄较大者[5]。本研究中SPTP病人的发病年龄普遍小于NFPNET病人,且2组病人的平均发病年龄差异有统计学意义。

表2 SPTP组与NFPNET组影像资料比较
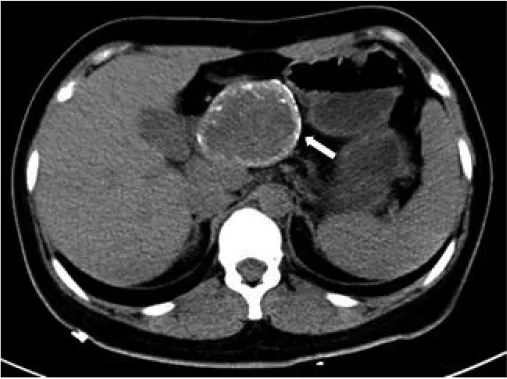
图1 病人男,49岁,NFPNET。增强扫描动脉期病灶边缘模糊,内密度不均(箭)。
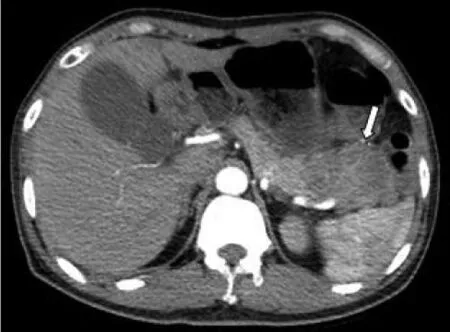
图2 病人女,31岁,SPTP。CT平扫示胰头部稍低密度灶,边界清晰,呈包壳样钙化(箭)。
3.2 SPTP与NFPNET的影像资料对比分析
3.2.1 肿瘤大小及位置 本研究中SPTP组与NFPNET组的肿瘤长径相比,差异无统计学意义,这是因为2类肿瘤生长较快且无特异性临床症状,以致检出时长径均较大。NFPNET多发于胰头、尾部[7],SPTP在胰体、尾部多见[8]。但是,本研究中2组肿瘤的发生部位差异无统计学意义,分析其原因:①2种肿瘤均来源于胰腺多潜能干细胞,具有多种分化趋势,病灶发生部位可无特异性[2];②纳入病例数较少,对于SPTP及NFPNET发生部位是否有倾向性尚需更大样本的研究。
3.2.2 肿瘤密度 2组肿瘤多数呈实性或囊实性,SPTP组纯囊性2例,NFPNET组纯囊性1例,可见纯囊性肿瘤所占比例很小,此结果与岑等[9]的研究结果相似。SPTP与NFPNET在病理学上亦表现为3种形式,实性成分为肿瘤细胞围成实性巢团,肿瘤细胞液化坏死后形成囊性成分,囊变彻底时呈现纯囊性[10]。本研究中2组肿瘤的密度与病理学基础相吻合,但2组影像学上肿瘤密度差异无统计学意义。3.2.3 肿瘤钙化 本次研究中2组肿瘤有无钙化的差异有统计学意义,SPTP组钙化多见,但2组钙化位置差异无统计学意义,与王等[11]结论一致。而有文献[12]报道,SPTP的钙化多位于包膜,NFPNET的钙化多位于内部,提示包膜钙化时SPTP的可能性较大,或许与肿瘤代谢时钙盐易沉积于包膜有关。

图3 病人女,31岁,SPTP。A图,增强扫描动脉期病灶轻度云絮样强化(箭),CT值约67 HU;B图,门静脉期病灶较动脉期强化明显,呈渐进性强化方式(箭),CT值约96 HU。
3.2.4 肿瘤边界 多数SPTP边界清晰,包膜完整,而NFPNET大多与之相反[13]。NFPNET无特异性临床表现,发现时病灶体积多数较大,较易发展为恶性肿瘤,表现为边界模糊、包膜不完整等侵袭性特点。本研究NFPNET组8例(66.7%)肿瘤边界模糊,其中4例肿瘤向周围脏器浸润,提示肿瘤恶性程度较高,可作为与SPTP的鉴别诊断要点。
3.2.5 肿瘤强化特点 SPTP动脉期多强化不均或边缘强化,门静脉期强化程度明显,呈渐进性强化方式;NFPNET动脉期迅速不均匀强化,门静脉期强化值明显低于动脉期,呈“快进快出”的表现形式[14]。本研究中2组病例的强化峰值出现时相、强化幅度间差异具有统计学意义,可以作为鉴别两者可靠的影像学依据。2组中均有未见明显强化的病例,可能与肿瘤囊性成分占据大部分,而实性成分的强化存在容积效应导致ROI的CT值偏低有关。有研究者[15]认为SPTP强化方式与病理学特征相关,由于SPTP实性成分中间质少,因此肿瘤多数乏血供,另外大量红细胞填充于假乳头状结构中,使得对比剂的血池驻留时间较长,进而强化峰值多处于门静脉期。有研究[16]发现增强扫描后病灶呈环形强化为NFPNET的典型影像征象,但本研究中出现环形强化的例数2组间并无统计学差异,推测SPTP亦出现环形强化可能与其病理学特征相关,如前文所述,肿瘤周边多为包膜完整的实性成分,内部为大量红细胞积聚的假乳头状结构,实性成分明显强化而假乳头强化轻微即呈现环形强化,此表现于内部结构坏死囊变后最为显著。

图4 病人女,54岁,NFPNET。A图,增强扫描动脉期病灶不均匀强化,囊实分界欠清,CT值45~102 HU,可见胰头部导管扩张(箭);B图,门静脉期病灶强化较均匀,CT值约88 HU(箭);C图,延迟期强化程度下降,CT值约 56 HU(箭)。

图5 病人女,62岁,NFPNET。增强扫描门静脉期示胰尾部软组织密度占位,肝右叶下段可见2枚类圆形稍低密度结节,边缘强化,提示转移(箭)。
3.2.6 导管扩张与远处转移 SPTP呈外生性或膨胀性生长,且多位于胰体、尾部,即便病灶体积较大也难以造成胆总管或胰管的扩张[1];NFPNET多发生于胰头部,肿瘤长到一定大小后侵犯胆总管或胰管即可造成扩张[9]。本研究2组均有1例导管扩张(图4A),2组间无差异,可能与纳入病例较少有关。SPTP和NFPNET均可表现为潜在恶性,因此可出现远处转移。Peng等[17]回顾性分析553例SPTP后发现直接侵犯和远处转移病例占2.3%。另有文献[18]显示33%的NFPNET可出现远处转移。本研究SPTP组未见远处转移,NFPNET组5例(41.7%)远处转移,这与以上结论[17-18]大致相符。
3.3 病理结果 WHO 2010关于PNET的病理类型进行以下分级:①G1级:Ki-67≤2%,为高分化神经内分泌肿瘤;②G2级:3%≤Ki-67≤20%,为高分化神经内分泌癌;③G3级:Ki-67≥20%,为低分化神经内分泌癌[4]。表明Ki-67指数越高,组织分化越差,但肿瘤良恶性并不能完全依据免疫组织化学[19],其与肿瘤细胞的异型性、核分裂象、是否侵及周围组织、是否存在淋巴结或远处脏器转移有关。有文献[20]报道NFPNET强化方式受Ki-67指数影响,指数较低易造成“快进快出”的表现,但本研究中SPTP组Ki-67指数普遍低于NFPNET组,与此结果不符,可能由于强化方式主要受到肿瘤血供及其内成分的影响,而与细胞分化程度无较大关联。CgA可由PNET大量释放,被视为特异性和敏感性均较高的肿瘤标志物[21],本研究中SPTP组未见CgA,而NFPNET组部分CgA阳性,这与本研究结果较一致。
但本研究只对比分析了SPTP及NFPNET,或许其他胰腺肿瘤亦能表现相仿的病灶特点或强化方式,加之本次纳入病例数较少,病人之间存在个体差异,易造成数据偏倚,仍需进一步深入探讨。
综上所述,SPTP发病年龄较小,多有钙化,边界清晰,强化峰值位于门静脉期,呈渐进性强化,不易远处转移;NFPNET发病年龄较大,肿瘤少钙化,边界模糊,强化峰值位于动脉期,呈快进快出方式。SPTP及NFPNET在病理组织学与CT平扫上有诸多相似表现,多层螺旋CT增强扫描对其两者的鉴别诊断具有重要价值。但针对CT影像分辨力的局限性,后续需开展MRI或PET/MRI研究以提高肿瘤良恶性判断的准确度[22-23],使早期微小肝脏转移灶零漏诊[24],以获取更具鉴别诊断意义的信息。