解读“国际心血管CT协会TAVI/TAVR相关CT成像的专家共识”
2019-05-31国晶晶李东
国晶晶 李东*
作者单位:1天津市环湖医院医学影像科,天津 300350;2天津医科大学总医院医学影像科
近年来,经导管主动脉瓣植入术(transcatheter aortic valve implantation,TAVI)/经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)快速发展,适应证不断扩大[1-3]。CT目前是测量主动脉瓣环大小、评估瓣环损伤和冠状动脉闭塞风险的金标准[4],并能够在术前预测最佳的X线投照角度。此外,CT还可用于随访评估术后并发症。2019年1月,国际心血管CT协会发表了《国际心血管CT协会TAVI/TAVR相关CT成像的专家共识》[5],该共识是对2012年版的更新,纳入了目前所有已发表的关于CT在评估TAVI/TAVR术前和术后中应用的新数据。
1 CT数据采集和重建
CT数据采集通常包括主动脉根部结构的心电门控CTA数据和主动脉/髂动脉/股动脉的非心电门控CTA数据。
1.1 主动脉根部和心脏的心电门控CTA 心电门控CTA至少覆盖主动脉根部,若能够覆盖整个心脏则更佳,以提供无搏动伪影的解剖信息。主动脉根部在收缩期通常较大[6],且人工瓣膜大小的计算多基于收缩期,因此收缩期扫描数据最有价值。但是,舒张期主动脉瓣形态的评估也有意义,在室间隔增厚并反向运动时,瓣环的最大尺寸也可能出现在舒张期[6]。因此,影像采集应该覆盖整个心动周期。如果采用辐射剂量调制技术,则峰值管电流应该设在收缩期,舒张期的管电流设置也要保证主动脉瓣环和瓣膜特征的显示。
1.2 主动脉/髂动脉/股动脉的非心电门控CTA 在主动脉根部的心电门控CTA采集之后,立即采用非心电门控螺旋扫描方式进行主动脉/髂动脉/股动脉CTA的扫描,范围应从胸廓入口至股骨小转子。将2次CTA扫描合并为1次检查,从而减少对比剂总用量。
1.3 辐射剂量 扫描参数设定应遵循“尽可能低的合理可行性(aslowasreasonablyachievable,ALARA)”原则,通过各种技术降低辐射剂量[7]。但是目前接受TAVI/TAVR治疗的病人主要是70岁以上的老年人[1-3],因此CT成像需要在确保影像诊断质量的基础上,最大限度地减少重复扫描和对比剂重复注射。
1.4 对比剂注射 在升主动脉内设定兴趣区,采用团注追踪技术确定扫描开始时间。对比剂总量为50~100 mL,注射流率为4~6 mL/s,动脉内的CT值应大于250 HU。
1.5 病人准备 应指导病人在检查前保持足够的液体摄入量[8]。在肘前静脉预埋至少20 G的静脉留置针。不推荐使用β受体阻滞剂,硝酸甘油则为禁忌。
1.6 心脏CT平扫 心脏CT平扫不是TAVI/TAVR术前检查的必要组成部分,在不确定主动脉瓣狭窄的严重程度时,主动脉根部的CT平扫可进行瓣膜的钙化积分,判断是否存在严重的主动脉瓣狭窄[9]。1.7 重建技术 心电门控CTA数据应重建为多期相薄层横断面影像。重建间隔应≤10%心动周期或者进行间隔50 ms的绝对期相重建,后者对于心房颤动等心率和心律变异大的病人成像质量更优[10]。重建层厚≤1 mm,使用仅包含心脏结构的小视野重建和512×512矩阵以提高空间分辨力。主动脉/髂动脉/股动脉的CTA应当以无间隔或重叠的方式重建为≤1.5 mm层厚的横断面影像,使用大视野和滤过反投影或迭代重建技术。
1.8 小结 TAVI/TAVR术前CT检查推荐要点总结见表1。
2 主动脉根部的解剖学定义和评估
主动脉根部是左心室流出道 (left ventricular outflow tract,LVOT)的延伸,从主动脉瓣叶基部到窦管连接处,包括冠状动脉窦(sinus of valsalva,SOV)、瓣叶间纤维三角和瓣叶。准确理解和评估主动脉瓣复合体的解剖结构,对于经导管心脏瓣膜(transcatheter heart valves,THV)最佳尺寸的测量以及识别冠状动脉闭塞等不良事件的解剖学风险等至关重要。
2.1 主动脉瓣环的定义和测量 主动脉瓣环为3个主动脉瓣叶基部附着点构成的虚拟平面上的管腔轮廓。瓣环平面可采用多平面重组(MPR)技术手动定位(图1),也可通过软件简化流程,甚至进行半自动分割,但是后两者需要操作者确认所生成的瓣环平面的准确性,必要时手动校正。瓣环轮廓的勾画应沿血池界面,避免轮廓内包含其他任何组织,亦避免轮廓外有对比剂。在瓣环钙化的情况下,无论是新月形还是突入腔内的钙化,轮廓应以谐波方式绘制,忽略钙化,这样有助于测量的标准化。测量工具可提供瓣环面积和周长,还可提供长径和短径并计算偏心率。
主动脉瓣环的测量应该在影像质量合格且瓣环面积最大的时相上进行,大多为心脏收缩期。需要注意的是,心动周期不同时相的瓣环平面方向的变化可能需要调整成像平面[11]。
2.2 锚定区钙化 THV锚定区由瓣叶、主动脉瓣环和LVOT构成。LVOT和主动脉瓣的严重钙化会导致瓣周反流、房室传导阻滞的风险明显增加,尤其是钙化突入LVOT[12]。根据钙化的环周程度、向下延伸至LVOT的深度、钙化突入LVOT的厚度等分为无、轻度、中度和重度。轻度为单发附壁钙化灶;中度为≥2个钙化结节或单发钙化略突入腔内;重度为单发或多发钙化结节明显突入腔内和/或延伸至LVOT。

图1 采用MPR技术手动定位主动脉瓣环平面的步骤图
2.3 二叶式主动脉瓣(bicuspid aortic valve,BAV)的确定和测量 BAV在TAVI/TAVR病人中占6%,其手术成功率较低,瓣周反流的发生率较高[13]。常用的BAV形态学分类方法为Sievers法[14]。近年来,针对TAVI/TAVR提出了简化的BAV分类[15],根据闭合线数量(3条或2条)和有无嵴,将BAV分为三大类:①3条闭合线,临床中通常称为“功能性”或“获得性”BAV;②2条闭合线有嵴型(相当于Sievers-1型);③2条闭合线无嵴型 (相当于Sievers-0型)。TAVI/TAVR术前CT报告需要系统描述瓣膜形态特征,包括嵴的钙化程度,因为严重的嵴钙化造成瓣周反流风险增加。
瓣环平面的确定是BAV的难点,尤其是Sievers-0型,因为只能根据2个附着处确定瓣环平面,因此方法有所不同。此外,BAV也需要测量瓣环大小,评价升主动脉情况[16]。
2.4 冠状动脉开口高度和SOV的评估 冠状动脉闭塞是TAVI/TAVR的严重并发症,发生率为0.66%,预后差,死亡率高达40.9%[17]。CT可以在术前评估冠状动脉闭塞的风险,也是影像学评价的金标准。冠状动脉开口距离瓣环较近(<12 mm)、SOV平均直径<30 mm,均提示冠状动脉闭塞的风险增加。但是,这些测量值的特异性相对较低,不能作为绝对阈值而成为禁忌证。
为保证冠状动脉开口测量的可重复性,应该采用互相垂直的电子卡尺测量瓣环平面到冠状动脉开口下缘的距离。SOV直径指在瓣环平面上测量从3个瓣尖分别到其各自附着处的距离。对于对称的SOV,可计算3个测量值的平均值。选择收缩期还是舒张期进行测量尚无相关报道。
2.5 窦管连接部(sinotubular junction,STJ)和升主动脉 所选择的THV需要与STJ贴合,因此需要测量STJ直径和高度。如果STJ直径<THV直径,则STJ损伤的风险增加。STJ高度应该采用互相垂直的电子卡尺测量瓣环平面到STJ最下缘的距离。STJ直径应在其横截面上测量,还应通过MPR的双斜位测量升主动脉直径,评价有无主动脉病变。
2.6 最佳投影角度 CT可用于提供病人个体化的“最佳”C型臂角度,优化初始透视角度的设定,减少重复设定,降低辐射剂量,减少对比剂用量和缩短手术时间[18]。
2.7 THV选择的相关因素 CT是主动脉瓣环测量和THV选择的无创成像金标准[4]。球囊扩张装置的尺寸主要依据瓣环面积进行选择,自扩张装置则主要依靠周长。
2.7.1 尺寸过大 指所选择的THV尺寸大于主动脉瓣环,表示为百分比,公式如下:尺寸过大(%)=(THV 正常测量值/瓣环测量值-1)×100%[2]。 必须注意,尺寸过大的百分比计算主要取决于瓣环测量值,面积值过大产生的影响超过了周长值或直径值过大带来的影响。常规报告中不需要写出尺寸过大,但掌握该概念有助于后期的团队讨论[19]。
2.7.2 根据主动脉根部钙化情况调整尺寸 瓣环和瓣环下的钙化,尤其是突入腔内时,会导致瓣环破裂和瓣周反流的风险增加。如果同时伴有瓣环尺寸过大,则风险进一步加大[20]。锚定区钙化的有无、位置、特征应该体现在TAVI/TAVR术前CT报告中。
2.7.3 瓣环破裂 瓣环破裂是不常见的并发症,但致死率很高[21],其危险因素包括女性、球囊扩张瓣叶的使用、THV明显尺寸过大 (尤其是超过20%)、先前接受过放疗。
2.7.4 房室传导阻滞 球囊扩张和自扩张人工瓣膜植入深度的增加被认为是左束支传导阻滞的预测因子。在TAVI/TAVR手术过程中,减少植入深度能够明显降低死亡率和永久起搏器的使用率[22]。另外,室间隔膜部较短与术后传导紊乱风险增高有关,长度<8 mm则高度提示房室传导阻滞的风险。室间隔膜部可在冠状位上测量,即瓣环平面和室间隔肌部的最长距离[23]。
2.8 小结 主动脉瓣、瓣环、流出道测量和报告的推荐要点总结见表2。
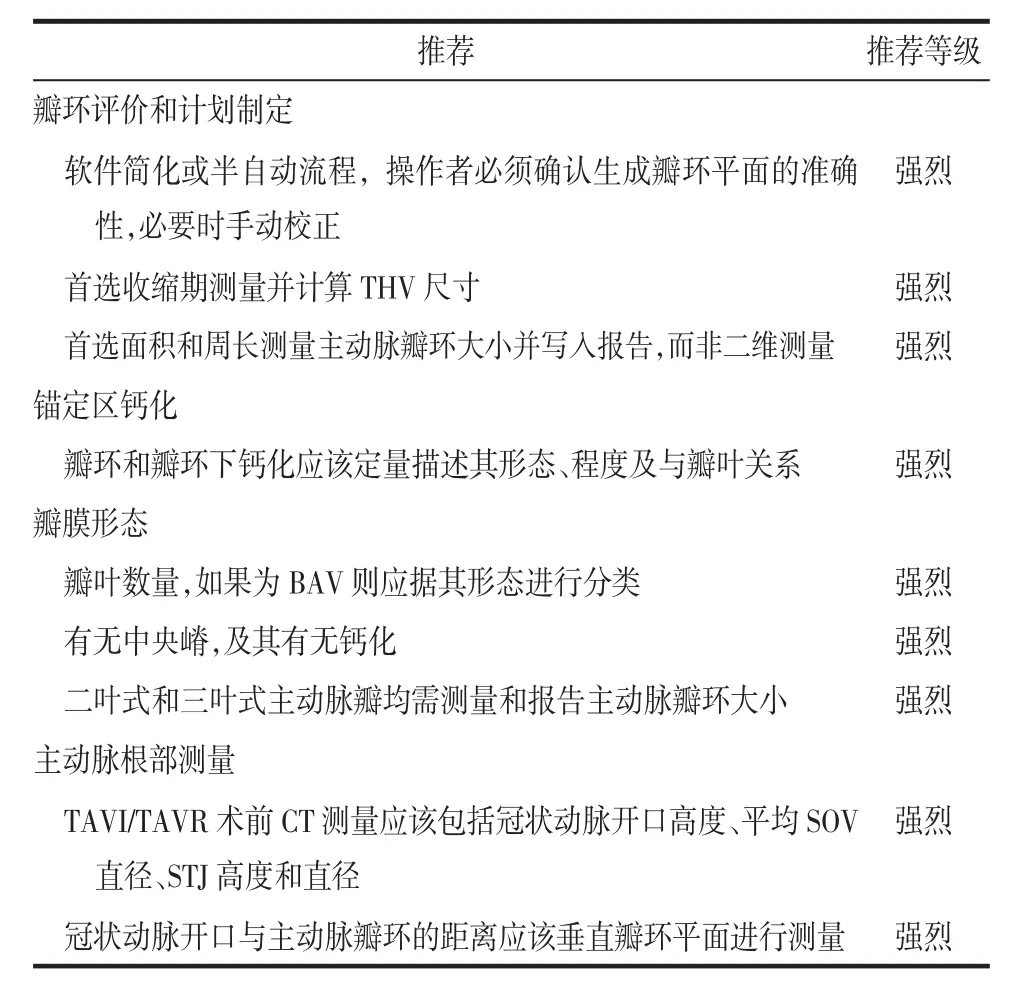
表2 主动脉瓣、瓣环、流出道测量和报告的推荐要点
3 血管路径
血管并发症与TAVI/TAVR术后致死率和致残率增加有关,约为4.5%[24]。血管并发症的危险因素包括外鞘直径超过最小血管直径(早期多采用直径比≥1.05,现因技术进步调整为≥1.12)、中度或重度钙化、血管迂曲等。因此,经股动脉入路需要分析髂股动脉的大小、钙化、迂曲,是否能够实现或者是否需要其他路径[25]。CT能够准确定量这些信息,对血管并发症的预测价值高于有创的血管造影。CT可通过MPR或曲面重组(CPR)等后处理方法测量主动脉瓣至两侧股总动脉间的最小管腔直径,而横断面影像不能用于评价血管管径大小。CT可采用主观半定量分级方法描述髂股动脉钙化的严重程度:无、轻度(斑点状)、中度(团块状)、重度(大块状、突出状、马蹄状、环周)。在分叉处或迂曲血管处出现环周或接近环周的马蹄状钙化时尤为重要,会影响导管鞘和人工瓣膜的通过。
虽然CT横断面影像可评价血管迂曲,但是采用容积再现的不同方位影像进行评价更为便捷。无钙化的髂股动脉迂曲不是股动脉入路的禁忌证,而伴有钙化的迂曲血管节段将会带来巨大风险,甚至造成手术失败。CT可确定穿刺点,保证局部没有影响动脉穿刺和动脉闭合装置放入的狭窄或钙化[26]。对于股动脉入路,应该评估胸、腹主动脉相关病变,尤其是升主动脉瘤和升主动脉严重钙化,其他病变还包括腹主动脉伸长、迂曲、夹层、动脉瘤等。如果股动脉入路不可行,那么还需要根据临床实际情况测量和报告锁骨下动脉和/或颈动脉的相关参数。如果采用经腔静脉入路,那么邻近下腔静脉的主动脉壁有无钙化、钙化大小和位置都应该报告[27]。血管路径报告的推荐要点见表3。
4 冠状动脉
TAVI/TAVR的术前CT扫描须谨慎使用β受体阻滞剂,硝酸甘油则禁忌使用,因此可靠评价冠状动脉狭窄程度是具有一定挑战性的,尤其是冠状动脉严重钙化、高心率造成运动伪影时[28]。除了评价冠心病之外,冠状动脉畸形和走行异常也应该进行评价。冠状动脉报告的推荐要点见表3。
5 非心脏、非血管的偶然发现
TAVI/TAVR术前CT的所有影像,均应该由接受过培训的放射科医师仔细判读有无偶然发现,其后续处理和临床建议取决于具体的病人和临床状况。非心脏非血管发现报告的推荐要点见表3。

表3 血管路径、冠状动脉和非心脏非血管发现报告的推荐要点
6 TAVI/TAVR术后CT
心脏CT可评价TAVI/TAVR术后瓣膜的形态、位置、瓣叶状况,是超声心动的重要补充工具,能够评价病人的瓣膜血栓形成、感染性心内膜炎、结构退变[29]。CT显示的低密度瓣叶增厚(hypoattenuated leaflet thickening,HALT)和瓣叶运动受限提示瓣叶血栓形成[30]。发现HALT时应描述其位置、长度、厚度,并可根据其沿弧线状瓣叶的累及范围进行主观评分。运动受限则需要采用全心动周期成像进行评价,通常是在HALT基础上出现的。TAVI/TAVR术后CT报告的推荐要点见表4。
7 瓣中瓣植入
通过THV瓣中瓣植入处理生物瓣衰坏的成功率高、病人预后好,成为外科手术治疗的替代方法。冠状动脉闭塞在瓣中瓣中常见,发生率达2.3%[31]。生物瓣膜广义上分为支架瓣膜、无支架瓣膜、经导管瓣膜。
支架瓣膜的刚性支撑导致主动脉根部的形态在心动周期中无变化,因此仅需要采集单个心电图时相。支架瓣膜在主动脉根部的位置是倾斜的,会导致THV与冠状动脉开口非常接近。VIV术前CT可测量所选择的THV与冠状动脉开口之间的距离,称为虚拟THV到冠状动脉距离[32]。该距离是冠状动脉闭塞的唯一独立预测因子,当其<4 mm表明冠状动脉闭塞风险增加。
无支架瓣膜的瓣中瓣术前评估与先天主动脉瓣的TAVI/TAVR类似。然而,无支架瓣膜多用于主动脉根部较小的病人,如果合并主动脉迂曲则会增加冠状动脉闭塞的风险。瓣中瓣术前CT报告的推荐要点见表4。
8 报告
所有关于主动脉根部和血管路径的测量值均应该截屏存储到PACS系统以备查看与参考。截屏图像应该包括带有定位线的MPR参考图,能够识别测量所在平面的方向和位置。完整报告应该包括的相关内容见表5。
9 小结
CT检查是TAVI/TAVR的重要组成部分,应该包括正确的图像采集和重建方式以及对主动脉根部和血管路径的系统评价。CT检查的个体化判读和测量是TAVI/TAVR团队工作的一部分,CTA数据能够准确指导病人选择和手术计划制定。

表5 TAVI/TAVR术前CT报告内容要点
