含糊精成分的银耳提取物中的多糖含量的测定
2019-05-31丘燕杨潞芳
丘燕,杨潞芳
(通标标准技术服务有限公司广州分公司,广东 广州 510663)
多糖是由10个以上单糖通过糖苷键连接而成的碳水化合物,包括活性多糖和膳食纤维两大类[1-2]。活性多糖专指具有某种特殊生物活性的多糖化合物,如真菌多糖、植物多糖和壳聚糖等。真菌多糖有香菇多糖、银耳多糖、金针菇多糖、云芝多糖、灵芝多糖、黑木耳多糖、虫草多糖、真菌猪苓等;植物多糖有茶多糖、魔芋葡甘露聚糖、银杏(叶)多糖等。这类多糖具有复杂的、多方面的生理活性和功能,因而越来越引起人们的关注[3-4]。
在多糖工业生产中,常需对多糖的含量进行测定和监控,由于多糖的种类繁多,含量和存在形式也多变,因此选择适当的、操作简单的多糖分析方法十分重要。多糖常见的检测定方法有苯酚-硫酸分光光度测定法、蒽酮-硫酸分光光度测定法、碱性酒石酸铜滴定测定法[5-6]等。苯酚-硫酸法原理是多糖在浓硫酸作用下水解成单糖并迅速脱水生成糠醛衍生物,与苯酚缩合成有色化合物,以葡萄糖标准品,然后用紫外分光光度计在490 nm 处测定吸光值与葡萄糖浓度的线性关系,进而对样品定量。该法具有操作简单、快速、显色后稳定性好、测定用试剂便宜、设备简单等优点,而被广泛应用[7]。
银耳营养丰富,食味鲜美,银耳多糖是银耳中的主要活性物质。银耳多糖主要生理功能有提高免疫调节能力、辅助抑制肿瘤作用、延缓衰老作用、调节血糖血脂、预防血栓、抗辐射、保护胃粘膜等[8]。银耳多糖以其独特的生物学功能和良好的食用安全性,近年来在天然功能性食品添加剂、保健品、化妆品等领域崭露头角[9-10]。不过现在市面上的银耳多糖或银耳提取物产品,很多都有添加糊精成分,在测定中经常被误判为多糖而影响多糖的定量。如何确认银耳多糖或银耳提取物产品中的多糖含量成为一个重要的课题。本文就苯酚-硫酸法测定含糊精成分的银耳提取物中的多糖含量进行研究验证,为市场中掺有糊精的银耳提取物中的多糖含量的准确测定提供一种操作简单、准确测定的方法。
1 材料与方法
1.1 仪器
TU-1901 双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;5804R 离心机:Eppendorf;DK-S26 双列六孔电热恒温水浴锅:上海精宏实验设备有限公司;MM-2 快速漩涡振荡器:姜堰市沈高康健生器具厂。
1.2 试剂
无水葡萄糖对照品、葡聚糖对照品(45 万~65 万分子量)、葡聚糖对照品(4 万分子量):中国药品生物制品检定所;硫酸、无水乙醇、苯酚:分析纯,国药集团化学试剂有限公司;糖化酶(10 万U/mL):上海阿拉丁生化科技股份有限公司。
1.3 其他材料
银耳提取物:西安雨诺生物工程有限公司;糊精:西安锦源生物科技有限公司。
1.4 方法
1.4.1 标准溶液的配制
准确称取干燥恒重的分析纯葡萄糖对照品0.500 0 g加水溶解并定容至50 mL,此溶液1 mL 含10 mg 葡萄糖,用前稀释100 倍为使用液(0.1 mg/mL)。
1.4.2 5%苯酚溶液配制
称取精制苯酚5.0 g,加水溶解并定容至100 mL,混匀。溶液置于冰箱中可保存1个月。
1.4.3 标准曲线的制备
准确吸取葡萄糖标准使用液 0、0.1、0.2、0.4、0.6、0.8、1.00 mL(相当于葡萄糖 0、10、20、40、60、80、100 μg),分别置于25 mL 比色管中,补加水至2 mL,加入1 mL 5%苯酚溶液,在漩涡混合器上混匀,小心缓慢地滴加浓硫酸10 mL,在漩涡混合器上小心混匀,置于沸水浴中2 min,冷却至(约26℃),用分光光度计在485 nm波长处,1 cm 比色皿测定吸光度。
1.4.4 多糖含量的测定
称取银耳提取物0.80 g+糊精0.20 g 置于200 mL容量瓶,加水80 mL 左右,于沸水浴中加热1 h,冷却至室温定容混匀后过滤,取50 mL 滤液置于100 mL 锥形瓶中,加入1 mL 糖化酶,置于60℃水浴酶解60 min取出(用碘液检验是否水解完全),与电炉上小心加热至沸(灭酶)冷却,定容至100 mL,过滤,取滤液5 mL置于50 mL 离心管中,加入20 mL 无水乙醇,混匀,置于 4℃冰箱 4 h 以上,以 4 000 r/min 离心 5 min,弃去上清液,残渣用80%乙醇溶液10 mL 洗涤3 次,残渣用水溶解并定容至25 mL,摇匀。准确吸取样液1 mL置于25 mL 比色管中,补加水至2 mL,按标准曲线的步骤于485 nm 处测定吸光度,根据标准曲线求得样品多糖含量[11-13]。
1.5 多糖的计算
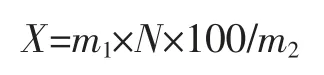
式中:X 为样品中多糖含量,mg/100 g;m1为样品测定液中葡萄糖的质量,mg;m2为样品质量,g;N 为稀释倍数。
2 结果与分析
2.1 测定方法的优化
2.1.1 专属性
考虑到用糖化酶去除糊精干扰的步骤,用实验室用水、实验室用水+糊精(下称20%糊精水溶液)作为样品空白,考察方法的专属性;同时用实验室用水作为样品空白,按方法进行测定(不使用糖化酶步骤),考察糖化酶带来的影响;分别采集吸光度数据,结果如表1所示。
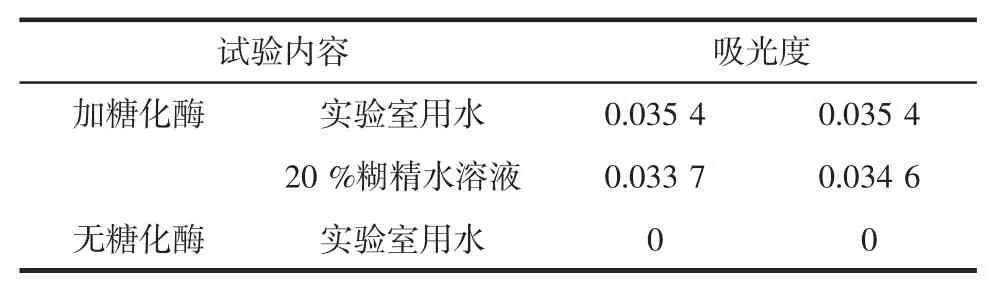
表1 专属性试验结果Table 1 Specific experimental results
从表1 数据分析可知,样品为实验室用水和20%糊精水溶液时,吸光度均在0.03 附近,证明此测试过程试剂会带入干扰;而试验过程未使用糖化酶试剂的测定吸光度的结果为0,表明在测试过程中糖化酶试剂会给测定带来一定的影响,使得测试结果偏高[14-15]。
2.1.2 糖化酶的使用量考察
考虑到不同的银耳提取物掺杂糊精的含量不一样,评估糊精的含量和糖化酶使用量的情况,本方法中糖化酶使用量为0.1 mL,考察不同糊精含量时糖化酶是否能完全地将糊精干扰去除,所以分别配制20%、40%、60%、80%糊精水溶液,按1.4.4 进行测定,分别采集吸光度,结果如表2。

表2 糖化酶的使用量考察Table 2 Estimated usage of glucoamylase
表1 两组数据的相对标准偏差为0.80%,无明显差异,证明样品中的糊精的干扰已被糖化酶去除,不会影响最终多糖的含量,专属性良好;表2中4组数据相对标准偏差为0.000 7%,无明显差异,证明不同含量的糊精样品,用糖化酶进行处理后带入的影响稳定,所以确定在后续的方法中,糖化酶的加入量为0.1 mL,且增加方法空白以扣除糖化酶带来的空白影响[14-15]。
2.2 精密度考察
实验室1 称取6 份样本(银耳提取物0.80 g+糊精0.20 g)按以上确定的方法进行多糖的测定,以考察方法的重复性;同时安排在另一实验室(实验室2)另一位测试工程师同样称取6 份样本(银耳提取物0.80 g+糊精0.20 g)按以上确定的方法进行多糖的测定,以考察方法的重现性,测定结果如表3 示。
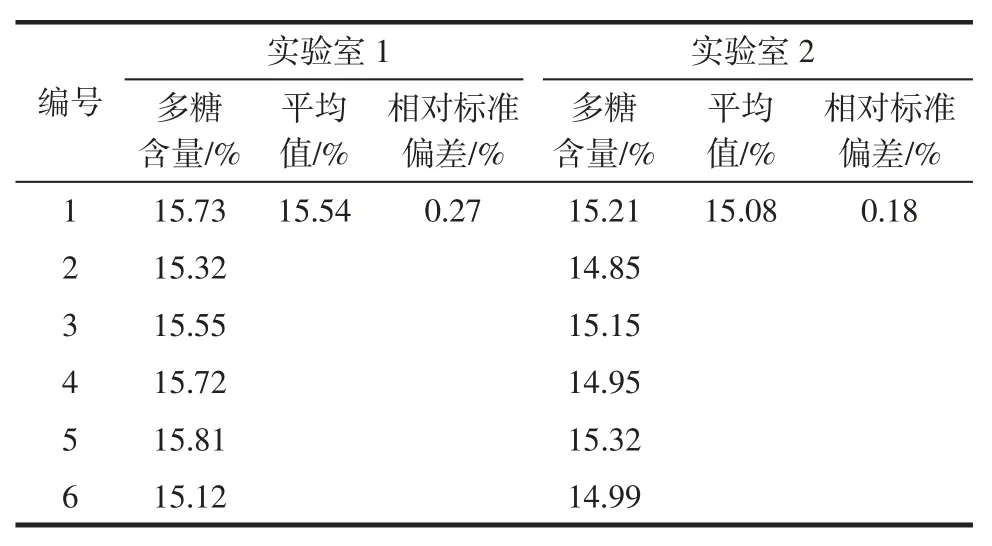
表3 精密度试验结果Table 3 Precision experimental results
由表3 精密度试验结果数据看出,两个实验室6组平行试验的相对标准偏差分别为0.27%和0.18%,此方法在同一实验室内的重复性良好;两个实验室的测定平均值分别为15.54%和15.08%,相对标准偏差为3%,此方法在不同实验室间的重现性良好。因此此方法的精密度达到分析方法的要求,精密度良好[16-18]。
2.3 准确度考察
考虑到多糖的分子量从几万到几千万,而该方法中所使用的标准品是葡萄糖,所以本方法的准确度试验除了考察用葡萄糖进行加标外,还增加用不同分子量葡聚糖的加标。
2.3.1 葡萄糖加标
精确称取样本(0.8 g 银耳提取物+0.20 g 糊精)于200 mL 容量瓶,平行称取6 份,制得供试品溶液。按试样含量的100 %进行加标,再准确量取供试品溶液1.00 mL,加水补至2.0 mL,按照1.4.3 步骤测定吸光度,从标准曲线上读出补水后供试品溶液中多糖的浓度,计算得到加标回收结果。进行6 次平行试验,试验数据如表4所示。
2.3.2 不同分子量葡聚糖加标
对样品从称样开始进行100%的葡聚糖(分子量分别为4 万和45 万~65 万)加标,分别称取6个平行样,制得供试样品溶液,按照1.4.4 步骤测定吸光度,从标准曲线上读出补水后供试品溶液中多糖的浓度,计算得到加标回收结果,试验结果如表4所示。
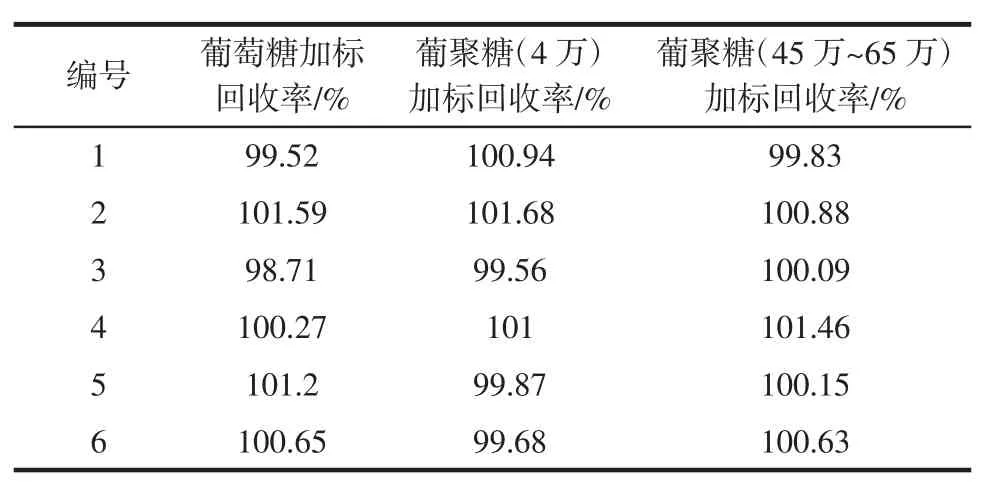
表4 加标回收结果Table 4 Recovery results
由表4 加标回收结果数据看出,葡萄糖加标回收率在99.52%~101.59%之间,葡聚糖(4 万)加标试验回收率在99.56%~101.68%之间,葡聚糖(45 万~65 万)加标试验回收率在99.83 %~101.46 %之间,均落在98%~102%之间,回收良好,符合分析方法的要求,证明该方法准确度良好[16-18]。
2.4 线性和范围考察
精密量取无水葡萄糖标准使用液0、0.08、0.10、0.20、0.40、0.60、0.80、1.00、1.20 mL(相当于正常的标准曲线上下各延伸20%的浓度点)分别置于25 mL 比色管中,准确补水至2 mL(分别相当于葡萄糖含量为0、8、10、20、40、60、80、100、120 μg 的供试标准溶液),精确加入5 %苯酚溶液1.0 mL,混匀;精密加入硫酸10 mL,摇匀,置水浴(98℃~100℃)中煮沸 2 min,取出,冷却至(约26℃),用分光光度计在485 nm 波长处以试剂空白溶液为参比,1 cm 比色皿中测定吸光度值。以无水葡萄糖浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,线性回归方程如图1所示。
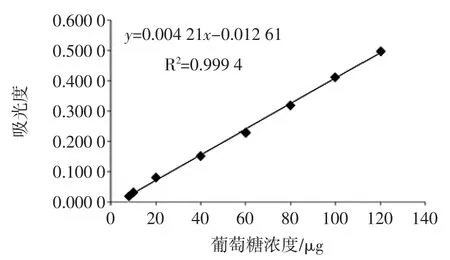
图1 标准曲线Fig.1 Standard curve
由图 1可知,无水葡萄糖在浓度 8 μg~120 μg 范围内,吸光度与葡萄糖浓度成良好线性关系,标准曲线回归方程:y=0.004 21x-0.012 61,R2=0.999 4,相关系数R2大于0.995 0,适用于定量分析。
2.5 耐用性考察
针对测试过程中容易产生变化的某些重要影响因素进行试验,评估方法的耐用性。具体试验的因素包括:测试溶液酶解温度分别为 50、55、58、60℃、酶解时间分别为 50、60、65 min,煮沸时间分别为 2、5、10 min,沉淀多糖时间分别为 4、8 h、〉12 h(放置过夜),其他条件固定,分别进行3 平行试验,多糖测定结果如表5所示。
从表5 耐用性试验结果看出,酶解温度偏低,酶的活力会产生变化,以致测试结果偏低,所以测试时,必须严格控制酶解温度;酶解时间在50 min~65 min 之间时,多糖的测定结果的相对标准偏差为0.15%;煮沸时间在2 min~10 min 之间时,多糖的测定结果的相对标准偏差为0.12%;沉淀多糖时间在大于4 h 时,多糖的测定结果的相对标准偏差为0.08%;酶解时间、煮沸时间、沉淀多糖时间在一定的波动范围内,多糖的测定结果无明显变化,该方法耐用性良好。
3 结论
苯酚-硫酸法测定多糖所用试剂糖化酶会在测定过程中带入干扰,严重影响定量结果,使定量结果偏高。本试验通过专属性和糖化酶使用量的考察,确定干扰的程度,优化测定方法为增加方法空白的测定并在计算时扣除。对优化后方法进行精密度、准确度、线性和范围、耐用性进行考察研究,其中精密度中不同实验室测试结果相对标准偏差为3%,准确度中加标回收率在98%~102%之间,相关系数R2大于0.995 0,耐用性良好,所建方法符合分析要求,该测定方法有使用设备简单、操作方便、试剂便宜等优点,为市场中掺有糊精的银耳提取物中的多糖含量的准确测定提供了一种有效方法[19-20]。
