桶装饮用水中铜绿假单胞菌的污染调查及分型
2019-05-31郦娟董华夏张珣涂凤琴戴小芳曾慧君胡筱静杨永
郦娟,董华夏,张珣,涂凤琴,戴小芳,曾慧君,胡筱静,杨永
(武汉食品化妆品检验所,湖北 武汉 430012)
铜绿假单胞菌(Pseudomonas aeruginosa),又称绿脓杆菌,是一种非发酵革兰氏阴性杆菌,在土壤、水、空气、正常人的皮肤、呼吸道和肠道中广泛存在,被世界卫生组织(world health organization,WHO)的危害分析关键控制点(hazard analysis critical control point,HACCP)评估为婴儿瓶装饮用水的危害指示菌[1]。铜绿假单胞菌在桶装饮用水中的污染屡见报道,已逐渐成为桶装饮用水质量不合格的主要指标。
对致病菌进行分型分析,对污染源的识别和污染途径的追踪有重要意义。分子分型技术已成为致病菌分型的重要手段[2]。常见的方法有基于脱氧核糖核酸(deoxyribonucleic acid,DNA)水平差别,例如脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)、多为点序列测定(multi-locus sequence typing,MLST)、随机扩增DNA 多态性(randomly amplified polymorphic DNA,RAPD)和核糖体分型(ribotyping)等方法[3-5]。近年来,基于蛋白质差别的分型技术也发展起来,例如基于基质辅助激光解析电离质谱(MALDI-TOF MS)技术和表面增强激光解吸电离飞行时间质谱(surface enhanced laser desorption/ionization time of flight,SELDI-TOF MS)技术的方法[6-7]。
对本地生产的82 批次桶装水进行铜绿假单胞菌检测,初步了解桶装水中铜绿假单胞菌的污染情况,并对分离出的铜绿假单胞菌采用核糖体分型和基质辅助激光解析电离质谱技术的方法进行分型分析,可建立桶装饮用水中铜绿假单胞菌数据库,为桶装水中铜绿假单胞菌的污染溯源积累数据。
1 材料与方法
1.1 材料与试剂
CN 琼脂、金氏B 琼脂、乙酰胺肉汤和绿脓菌素测定培养基:购自北京陆桥技术股份有限公司;Riboprinter 系统EcoRⅠ试剂套装、Riboprinter 系统样品制备包:购自美国杜邦公司;三氟乙酸(色谱纯)、乙腈(色谱纯):购自赛默飞世尔科技有限公司;α-氰基-4-羟基肉桂酸(HCCA),细菌实验标准品:购自德国布鲁克公司;VITEK2 GN 鉴定卡:购自生物梅里埃公司。
1.2 仪器与设备
BSC-1300ⅡA2 生物安全柜:苏州安泰空气技术有限公司;VITEK2 compact system 全自动生化鉴定系统:梅里埃公司;SPX-Ⅱ生化培养箱:上海新苗医疗器械制造有限公司;Riboprinter 全自动微生物基因指纹鉴定系统:美国杜邦公司;基质辅助激光解析电离质谱 MALDI-TOF-MS/MS(autoflex speed):德国布鲁克公司。
1.3 方法
1.3.1 铜绿假单胞菌检验方法
按照GB 19298-2014《食品安全国家标准包装饮用水》[8]规定,采用GB/T 8538—2008《饮用天然矿泉水检验方法》[9]中4.54 矿泉水中铜绿假单胞菌的检测方法。分离株用VITEK2 compact system 进行确认。
分离株经革兰氏染色后,根据染色结果选用鉴定卡按VITEK2 compact system 仪器操作说明进行生化鉴定。经过确认的分离株用于分型分析。将分离株在CN 平板上划线,(36±1)℃培养 48 h。
1.3.3 核糖体分型
按照杜邦Riboprinter 全自动微生物鉴定系统操作程序进行。
将Riboprinter 生成的指纹图谱与Riboprinter 数据库比对。再将图谱导入BioNumerics 软件包,用UPGMA 法进行聚类分析,Pearson 相关系数为1%。
1.3.4 MALDI-TOF MS 分型
样品制备。用灭菌牙签刮取单菌落少量菌体,在靶板的靶点内涂成薄层。在其上覆盖1 μL HCCA 溶液,自然晾干。
仪器参数:线性正离子(LP)采集模式;加速电压:19.50 kV;检测分子质量范围2 000 Da~20 000 Da,激光频率为500 Hz。每次试验之前都用标准品溶液进行质量校正。用Flex Control 软件进行数据采集,用Biotyper 和FlexAnalysis 软件进行后续聚类分析。
采用电抗子模块分段投切的模块化多电平换流器降电容方法//李钰,李帅,赵成勇,许建中,曹均正//(19):90
按照Biotyper 软件使用说明,鉴定结果与铜绿假单胞菌匹配分数为1.700 以上的,为铜绿假单胞菌。进一步确认后的菌株蛋白质指纹图用FlexAnalysis 软件分析,相似性判定水平为50%。
2 结果与分析
2.1 铜绿假单胞菌的检测结果
在2016年桶装饮用水82 批次样品中18 批次检出铜绿假单胞菌,检出率为22.0%,各季度结果见表1。
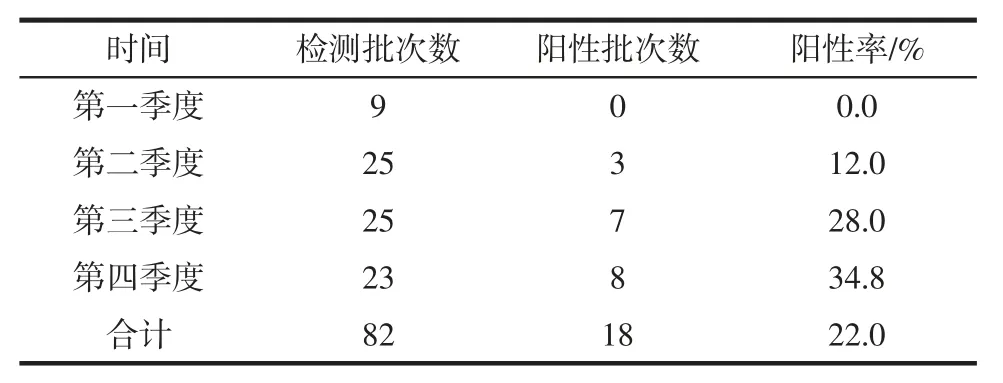
表1 2016年各季度桶装饮水中铜绿假单胞菌检出率Table 1 Detection rate of Pseudomonas aeruginosa in bottled drinking water in 2016
表1 每个批次检测5个样品,每批次检出铜绿假单胞菌的样品数范围在1~4,样品中铜绿假单胞菌计数范围在1 CFU/250 mL~320 CFU/250 mL,具体见表2。

表2 各批次中铜绿假单胞菌计数情况Table 2 Counting of Pseudomonas aeruginosa in batchs

续表2 各批次中铜绿假单胞菌计数情况Continue table 2 Counting of Pseudomonas aeruginosa in batchs
2.2 铜绿假单胞菌的核糖体分型结果
将从样品中分离得到的36 株铜绿假单胞菌用杜邦Riboprinter 全自动微生物基因指纹鉴定系统进行核糖体分型,鉴定结果均为铜绿假单胞菌。用BioNumerics 软件进行聚类分析,结果分为2个大群,其中1群包括16 株,2 群包括20 株,每群再分为了2个亚群。结果见图1。
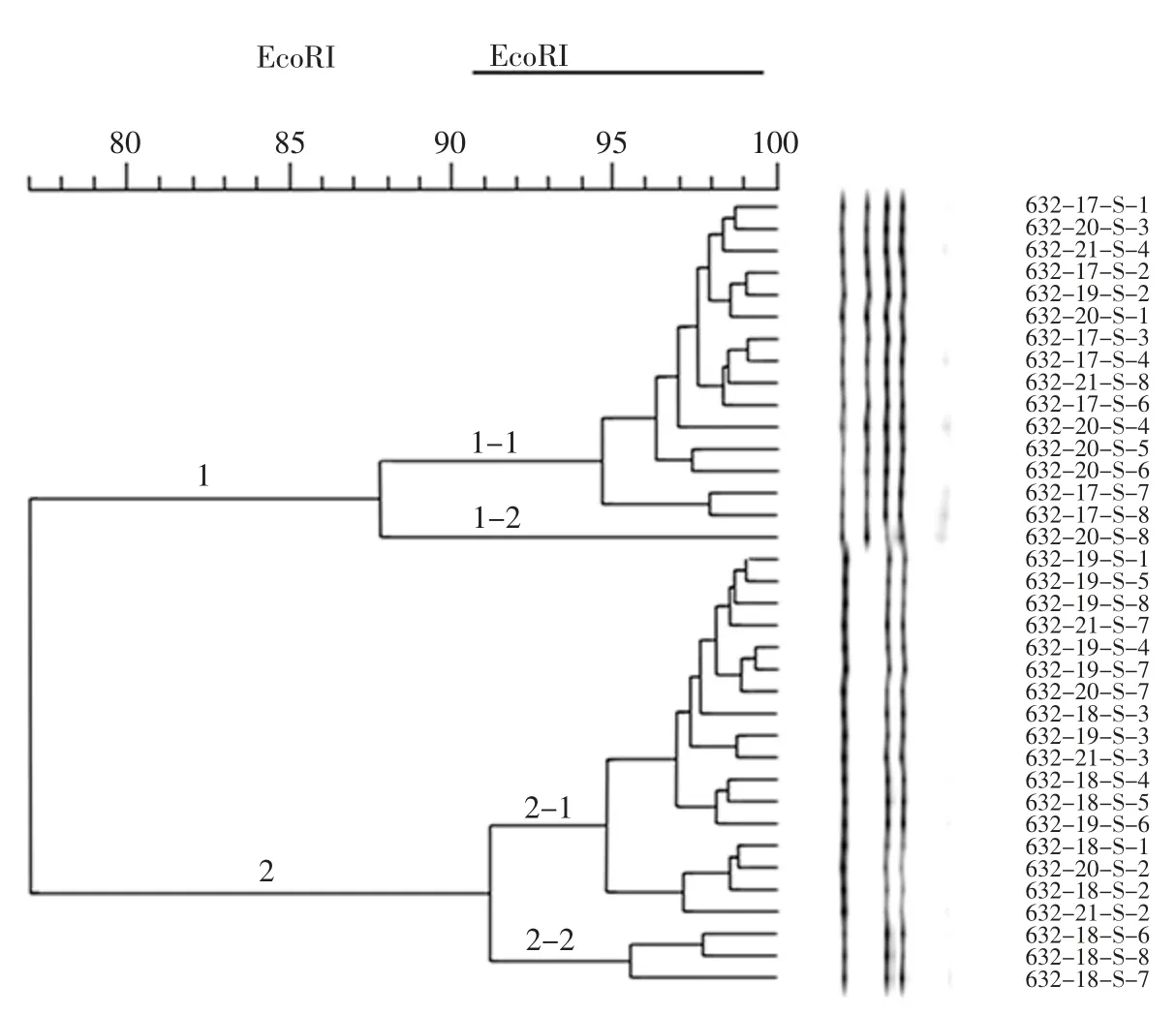
图1 36 株铜绿假单胞菌分离株核糖体分型结果Fig.1 Clustering of ribosome typing of 36 Pseudomonas aeruginosa
2.3 铜绿假单胞菌的MALDI-TOF MS分型
将从样品中分离得到的36 株铜绿假单胞菌用进行MALDI-TOF MS 分型,通过对蛋白质指纹图谱进行聚类分析,按照50%相似性作为判定水平,36 株菌可被分为2个大群,其中1 群包含16个菌株,2 群包含20个菌株,其中1 群又分为2个亚群,分别包含8个菌株,结果见图2。
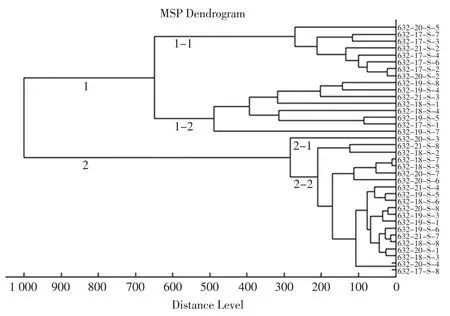
图2 36 株桶装水来源的铜绿假单胞菌MALDI-TOF MS 分型结果Fig.2 Clustering of typing analysis of 36 Pseudomonas aeruginosa by MALDI-TOF MS
2.4 两种分型结果的比较
2.4.1 比较来源于同一批次的不同样品中分离出的菌株的分型结果
来源于同批次样品的菌株632-19-S-1、632-19-S-3 和 632-19-S-5,核糖体分型和 MALDI-TOF MS 分型都被归为同一亚群。但在核糖体分型中632-19-S-1和632-19-S-5 更相似,而在MALDI-TOF MS 分型中632-19-S-1 和 632-19-S-3 更相似。
来源于同批次样品的菌株632-18-S-1、632-18-S-2、632-18-S-3 和632-18-S-4 在两种分型分析中也都归在了同一亚群。在核糖体分型中632-18-S-1 和632-18-S-4 更相似,632-18-S-2 和 632-18-S-3 更相似。而在 MALDI-TOF MS 分型中,632-18-S-1 和 632-18-S-2 更相似,632-18-S-3 和 632-18-S-4 更相似。
来源于同批次样品的菌株632-17-S-8、632-20-S-3 和632-20-S-4 在两种分型分析中也都归在了同一亚群。在核糖体分型中632-20-S-3 和632-20-S-4更为相似,而在MALDI-TOF MS 分型中632-17-S-8和632-20-S-4 更为相似。
来源于同批次样品的菌株632-19-S-7、632-19-S-8 和 632-20-S-2。在核糖体分型中,632-19-S-7 和一 632-19-S-8 归为 1个亚群,632-20-S-2 归为另一个亚群。在MALDI-TOF MS 分型中,3个菌株分为同一亚群,其中632-19-S-7 和632-19-S-8 更为相似。
2.4.2 比较来源同一生产厂家的不同批次样品中分离出来的菌株的分型结果
菌株 632-17-S-1、632-17-S-2、632-17-S-3、632-17-S-4 和 632-17-S-6、632-17-S-7 来自同一生产厂家不同批次。在核糖体分型中,4个菌株归为同一亚群。在MALDI-TOF MS 分型中,632-17-S-7 和其他3个菌株归在一个大群下的两个不同亚群。
菌株 632-18-S-5、632-18-S-6、632-18-S-7、632-18-S-8 和 632-21-S-3、632-21-S-4 来源于另一厂家的不同批次样品。在核糖体分型中,632-21-S-4与其他菌株归在不同大群,632-18-S-5 和632-21-S-3 与 632-18-S-6、632-18-S-7 和 632-18-S-8 归在同一大群的两个亚群。在MALDI-TOF MS 分型中,632-21-S-3 和其他菌株分在不同亚群。
可见,核糖体分型和MALDI-TOF MS 分型的结果不完全一致,可能是因为核糖体分型针对的是DNA 水平,与酶切和电泳情况有关,而MALDI-TOF MS 分型针对的是蛋白质水平,与菌株的生长状态有关。
3 讨论
在国家标准将铜绿假单胞菌列为包装饮用水的致病菌检测指标之一后,桶装饮用水中铜绿假单胞菌的污染情况日益受到重视。很多地区的桶装饮用水中铜绿假单胞菌的污染率在8%以上[10-13],此次调查中铜绿假单胞菌的检出率为22.0%,污染情况同样不容忽视。其中第3 和第4 季度的检出率明显高于第1 和第2 季度,与之前其他研究者的研究结论一致[10]。每批次检出的阳性样品数均小于5,说明生产中铜绿假单胞菌的污染具有不均一性和随机性。铜绿假单胞菌已成为桶装水的重大安全隐患。
铜绿假单胞菌的污染源很多。水源水污染、制水过程中的过滤、反渗透设施、贮水罐和管道等消毒不彻底和交叉污染、回收空桶及盖清洗消毒不到位和桶盖密封不严都有可能是铜绿假单胞菌污染的途径[14]。对铜绿假单胞菌的分型分析,可以进一步了解铜绿假单胞菌的污染程度和污染来源,实现污染溯源,便于污染的消除和预防,有利于桶装水生产企业的规范生产。脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)是目前公认的病原菌分子分型和溯源研究的“金标准”,但是其操作比较复杂,对技术人员要求较高[15]。而核糖体分型目前已实现自动化[16-17],MALDI-TOF MS分型的操作也相对简单[6],对于致病菌的分型和污染溯源具有重大意义。后期结合分型结果,建立地区铜绿假单胞菌数据库,可以为桶装水中铜绿假单胞菌的污染溯源积累数据,为后续桶装水中铜绿假单胞菌的防控提供技术支持。
