大豆11S球蛋白水解肽的制备及抗氧化研究
2019-05-31马福建高长城解迪刘亚男邹险峰
马福建,高长城,解迪,刘亚男,邹险峰
(长春大学 食品科学与工程学院,吉林 长春 130022)
豆粕是大豆提取豆油后的副产品,蛋白质含量高达45%以上[1],主要的蛋白质是沉降系数为7S 与11S的球蛋白,其中大豆11S 球蛋白含量占大豆蛋白总含量的40%以上,对大豆蛋白的功能特性有着重要影响[2]。大豆11S 球蛋白既可作为食品的组分,又可作为添加剂,具有比7S 球蛋白较好的胶凝特性,能提高和改善原有食品的质构特性及口感。大豆11S 球蛋白分子是由6个酸性亚基和6个碱性亚基构成的两个环状六角形结构,亚基之间通过二硫键结合。但由于11S 球蛋白具有紧密的分子结构,多数活性基团被包裹在球状结构的内部,很难表现其生理活性[3]。大豆11S 球蛋白经酶水解成大豆肽后,其氨基酸组成几乎没有变化,但由于肽链变短,在酸性条件下溶解度显著提高[4-6]。并且水解的同时,隐藏在蛋白质分子内部具有生物活性的氨基酸残基被释放出来,表现出如抗氧化活性、抗疲劳作用、促进矿物吸收、抑制胆固醇、免疫调节、抗高血压、促进脂肪代谢等活性[7-10]。有些活性肽甚至同时具备两种以上的功能,对人体心血管系统、神经系统、消化系统和免疫调节系统有很强的调节作用[11]。
大豆蛋白水解物最重要的生理活性之一是其抗氧化活性,可以清除自由基,螯合金属离子,并防止脂质过氧化。目前,有关大豆抗氧化活性肽的研究很多,大多是以大豆分离蛋白为原料进行酶水解制备抗氧化活性肽,但关于11S 蛋白组分酶解物抗氧化活性的研究分析比较少[12]。研究表明,人体肠道对11S 水解肽的吸收显著高于对11S 球蛋白或氨基酸的吸收[13]。11S蛋白经蛋白酶解之后抗氧化活性显著提高[14]。胰蛋白酶是特异性内切酶,与人体消化系统内酶相似,故水解产物可能更适于人体吸收,用胰蛋白酶对11S 球蛋白进行改性,能改善其某些功能特性[15]。
本研究以大豆11S 球蛋白为底物,水解度为指标,探讨大豆11S 球蛋白的胰蛋白酶水解条件,并研究大豆肽溶液对超氧阴离子自由基(O2-·)和羟自由基(·OH)的清除率,为酶解制备大豆肽以及筛选抗氧化活性较好的大豆肽提供重要的理论依据。
1 材料与方法
1.1 材料、试剂与仪器
豆粕:佳木斯冬梅大豆食品有限公司;胰蛋白酶(酶活力1.0×105U/g):南宁庞博生物工程有限公司;三氯乙酸、HCl、NaOH 等:北京化工厂。
FDU-2100 型冷冻干燥仪:日本EYELA 公司;LXJ-IIB 型离心机:上海安亭仪器厂;pHS-2 型精密酸度计:上海雷磁仪器厂;UV-1280 型紫外-可见分光光度仪:日本岛津公司;KDN-103F 型凯氏定氮仪、HYP-320 型消化炉:上海纤维仪器有限公司;HH-ZK1 型恒温水浴锅:巩义市予华仪器有限责任公司。
1.2 方法
1.2.1 大豆11S 球蛋白的分离
大豆11S 球蛋白的分离参照Nagano 法[16],具体流程如下:
豆粕→加水混合,料液比1/10(g/mL)→调节pH7.5→提取 1 h→离心分离 10 000×g,15 min→取上清液→添加亚硫酸钠0.98 g/L→调节pH6.4→4℃过夜→离心分离10 000×g,15 min→沉淀→冻干→大豆11S 蛋白粗提物
1.2.2 酶解工艺流程和酶解条件优化
大豆11S 球蛋白溶液(2 mg/mL)→95℃水浴10 min→调节pH 值→加胰蛋白酶水解→沸水浴10 min灭活→加三氯乙酸→离心→取上清液→抗氧化性检测
1.2.2.1 单因素试验
以水解度为指标在底物浓度为2 mg/mL 的条件下考察酶与底物比、pH 值、水解温度和水解时间对酶水解大豆11S 球蛋白水解度的影响。
1.2.2.2 响应面优化试验
在单因素试验基础上,以水解度为响应值,采用Box-Behnken 试验设计方案进一步优化试验结果。
1.2.3 水解度(degree of hydrolysis,DH)的测定
水解度测定采用三氯乙酸法(trichloroacetic acid,TCA)[17],具体步骤如下:
准确量取10 mL 酶解液,加入10 mL10%的三氯乙酸溶液,震荡10 min,5 000×g 离心10 min,取上清液,采用凯氏定氮法进行测定。
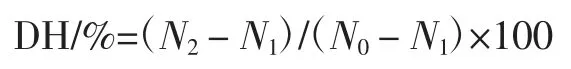
式中:N2为大豆11S 球蛋白酶解上清液中加10%TCA 后的可溶性氮,mg;N1为水解前大豆 11S 球蛋白上清液中加10% TCA 后的可溶性氮,mg;N0为大豆11S 球蛋白中含氮量,mg。
1.2.4 抗氧化性测定
大豆11S 球蛋白水解肽的超氧阴离子自由基(O2-·)清除率的测定采用邻苯三酚法[18]。大豆11S 球蛋白水解肽的羟自由基(·OH)清除率的测定采用罗丹明B-Feton 体系光度法[19]。
2 结果与分析
2.1 单因素试验
2.1.1 酶与底物比对水解的影响
选取底物浓度2 mg/mL,pH 值为8.0,温度50℃,水解时间 3 h。研究 1 000、2 000、4 000、6 000、8 000、10 000 U/g 的酶底比对水解度的影响,结果见图1。
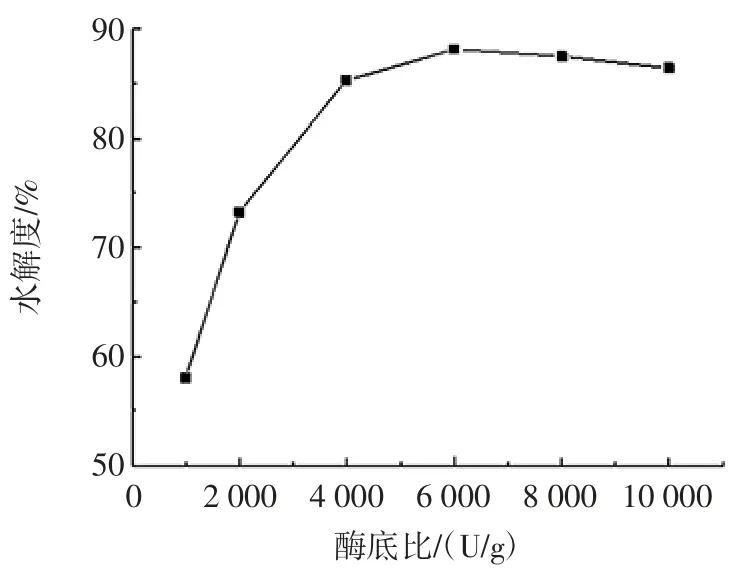
图1 酶与底物比对水解度的影响Fig.1 Effect of enzyme dosage on the degree of hydrolysis
由于反应体系酶用量较少,本试验将胰蛋白酶配制成一定浓度的酶液,加入反应体系。由图1可知,在一定底物浓度下,水解度随酶与底物比的增加而呈上升趋势,当酶与底物比达到6 000 U/g 时,水解度最大,继续增加酶与底物比,水解度基本不发生改变。这是由于酶与底物已达到饱和,水解因而不再增加。因此,本试验中酶水解大豆11S 球蛋白的最佳酶底比是6 000 U/g。
2.1.2 pH 值对水解的影响
底物浓度2 mg/mL,酶与底物比为6 000 U/g,温度50℃,水解时间 3 h,pH 值为 7.0、7.5、8.0、8.5、9.0 时对水解度的影响,结果见图2。

图2 pH 值对水解度的影响Fig.2 Effect of pH on hydrolysis degree
由图2可知,在pH 值为8 时,水解度达到最大值。这是因为酶分子上活性基团只有在一定的解离状态,才最适于与底物结合,pH 值高于或低于最适pH值时,活性基团的解离状态发生改变,酶和底物的结合力降低,因而酶反应速率降低。因此,本试验中胰蛋白酶水解大豆11S 球蛋白的最佳酶解pH 值为8。
2.1.3 温度对水解的影响
底物浓度2 mg/mL,酶与底物比为6 000 U/g,pH 值为 8.0,水解时间 3 h,研究温度为 30、40、50、60、70℃时对水解度的影响,结果见图3。

图3 水解温度对水解度的影响Fig.3 Effect of temperature on hydrolysis degree
由图3可知,大豆11S 球蛋白的水解度随着水解温度的升高逐渐增大,当温度为50℃时水解度最大,继续升温,水解度反而呈现下降的趋势。这是由于随着水解温度的升高,反应体系中底物与酶分子运动速度加剧,增大了有效碰撞的几率,分子热运动的动能增大,与活化能的能垒差减小,反应速度加快,但随着温度的进一步升高而使酶逐步变性,即通过酶活力的减少而降低酶的反应速度。因此,本试验中胰蛋白酶水解大豆11S 球蛋白的最适温度为50℃。
2.1.4 水解时间对水解的影响
底物浓度2 mg/mL,酶与底物比为6 000 U/g,pH值为 8.0,温度 50℃,以水解度为指标研究 1、2、3、4、5 h的水解时间对水解度的影响,结果见图4。
由图4可知,大豆11S 球蛋白的水解度随着酶解时间的增加而逐渐增大,反应时间在3 h 之后,水解趋于稳定,水解度增加不明显。这是由于随着反应的进行,胰蛋白酶的作用位点逐渐变少,水解度变化不大。因此,本试验中胰蛋白酶水解大豆11S 球蛋白的最适反应时间为3 h。
2.2 响应面试验结果与分析
在单因素试验的基础上,以水解度为响应值,选取酶与底物比、pH 值、温度、时间为影响因素,设计了四因素三水平的响应面分析试验,其中试验因素与水平的选取见表1,试验结果见表2,回归模型的方差分析见表3。
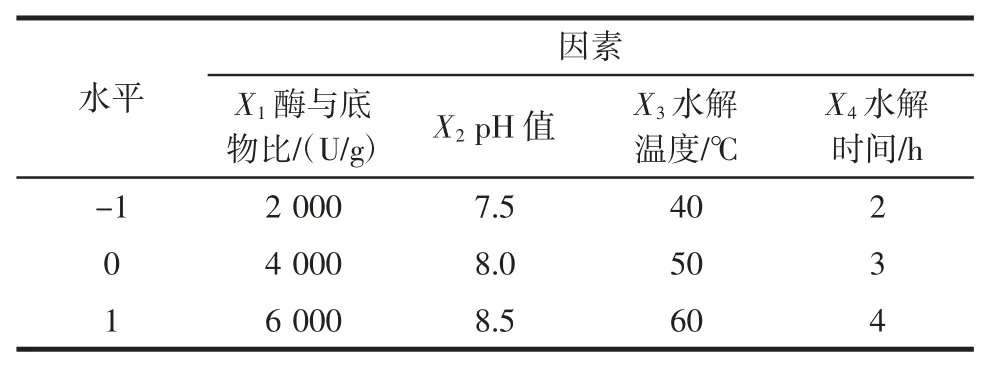
表1 响应面分析的因素和水平取值表Table 1 Factors and levels of response surface analysis
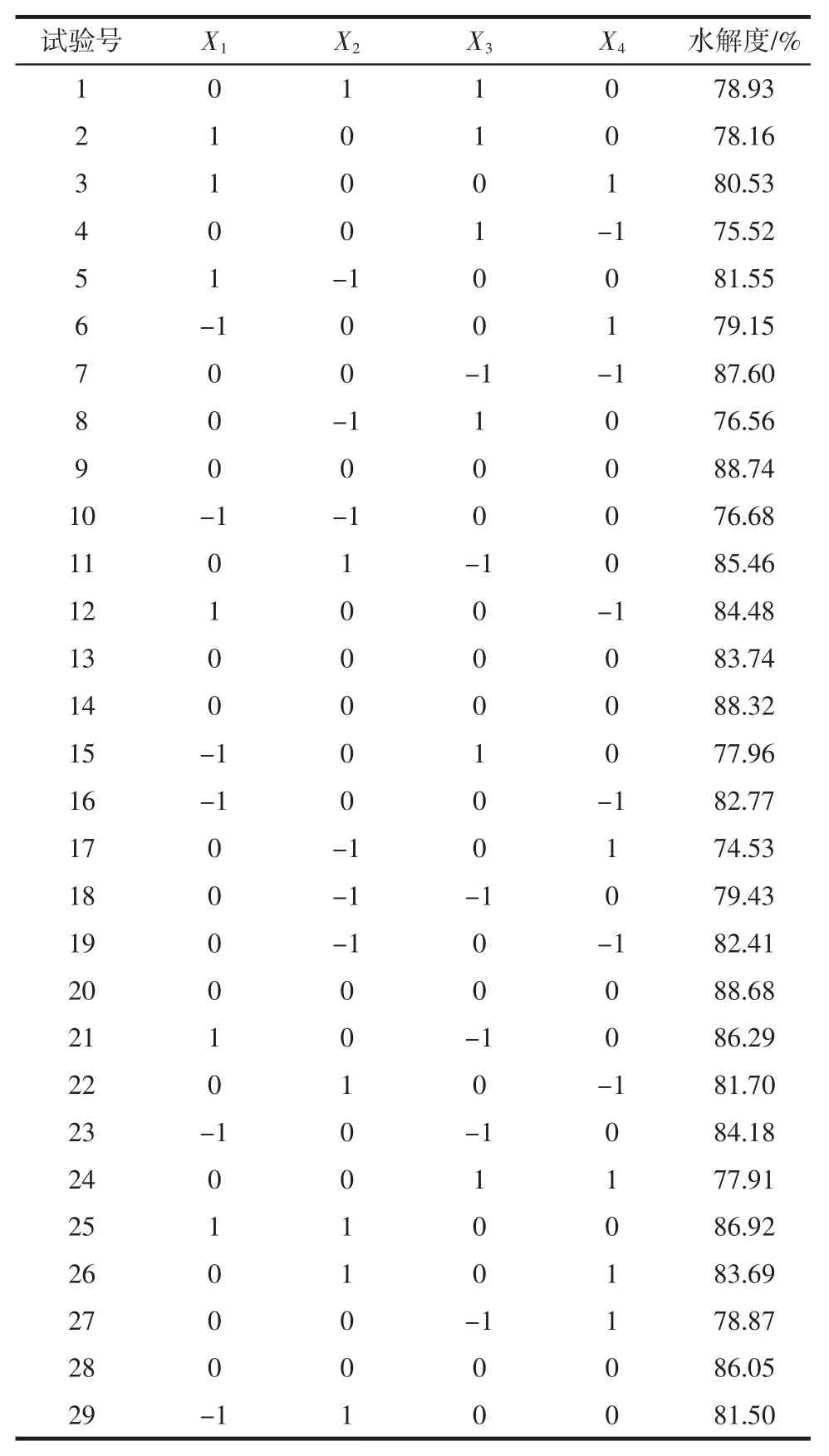
表2 试验设计结果Table 2 Test design results
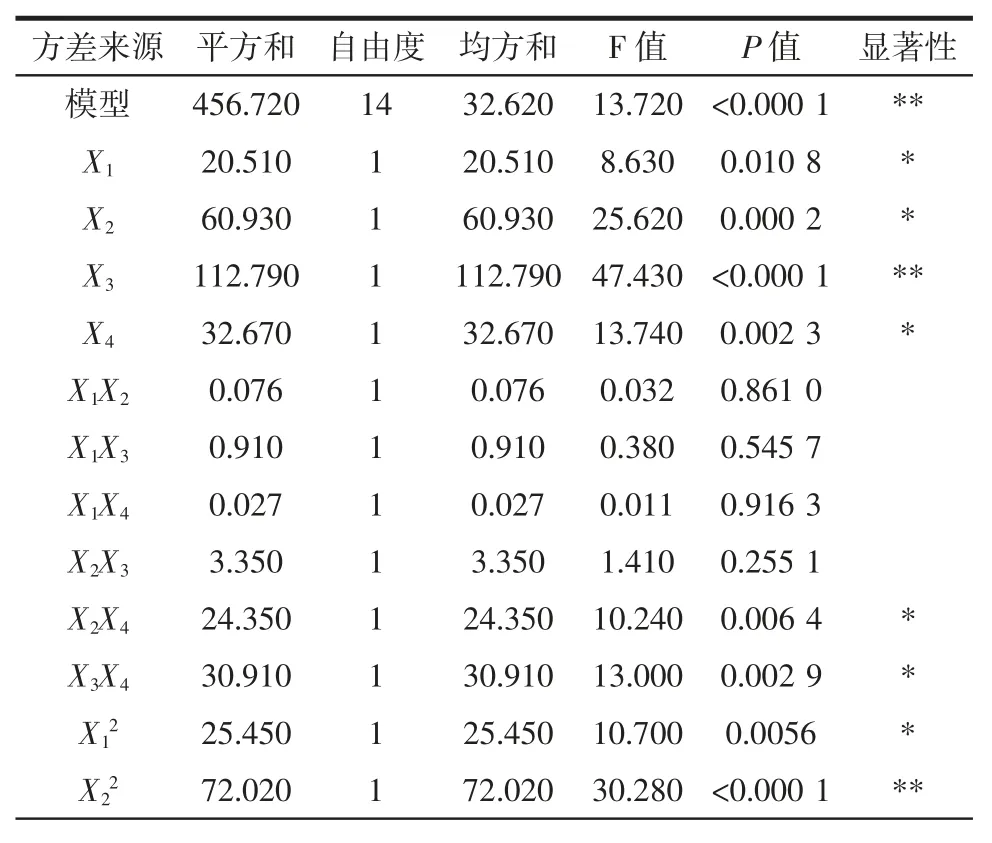
表3 方差分析表Table 3 Analysis of variance
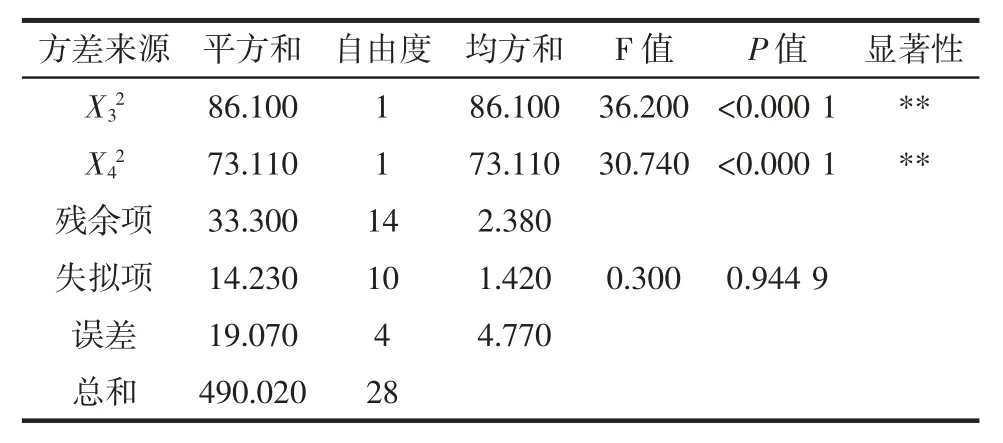
续表3 方差分析表Continue table 3 Analysis of variance
采用Design Expert 8.0.6 软件对表2 数据行分析得到的编码因子的回归方程为:Y=87.11+1.31X1+2.25X2-3.07X3-1.65X4+0.14X1X2-0.48X1X3-0.083X1X4-0.91X2X3+2.47X2X4+2.78X3X4-1.98X12-3.33X22-3.64X32-3.36X42
由方差分析可知,回归方程极显著,失拟性不显著,回归系数R2=0.932 1,说明模型拟合试验结果拟合度良好,试验值与预测值相关性很高,可用该模型对试验结果进行分析和预测[20]。由结果分析,该模型的一次项 X1、X2、X4显著,X3极显著;二次项 X22、X32、X42极显著,X12显著;交互项 X2X4、X3X4显著。由表 3可知对大豆11S 球蛋白水解度的影响因素大小顺序为:温度〉pH 值〉水解时间〉酶与底物比。
2.3 验证试验
通过对模型回归方程的优化求解,得到最佳水解条件为:酶与底物比 4 851.73 U/g、pH8.14、温度 43.58℃、时间2.59 h,此条件下理论预测最大水解度为89.03%。由于实际情况,取水解条件为:酶与底物比4 900 U/g、pH8.1、温度44℃、水解时间2.6 h 进行3 次验证试验取平均值得到水解度为89.25%,与预测值基本一致。
2.4 大豆肽的超氧阴离子自由基(O2-·)的清除率测定
不同浓度的大豆肽溶液对O2-·的清除效果如图5所示。
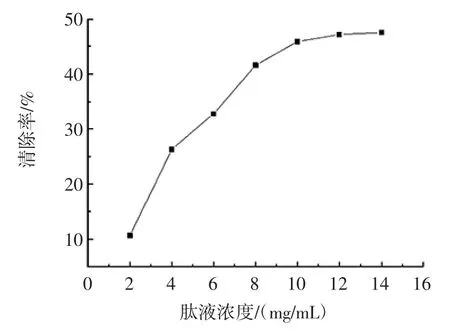
图5 大豆肽对超氧阴离子自由基的清除效果Fig.5 Scavenging effect of soybean peptides on superoxide anion free radicals
由图5可知,随着大豆肽溶液浓度的升高,对O2-·的清除率也随之增加,呈正相关关系,并且清除率随着肽液达到一定浓度之后变化不大,当肽液浓度为12 mg/mL 时清除率最高,达到46.86 %。说明大豆肽溶液具有较强的清除O2-·能力,表现为较好的抗氧化活性。
2.5 大豆肽的羟自由基(·OH)的清除率测定
不同浓度的大豆肽溶液对·OH 的清除效果如图6所示。
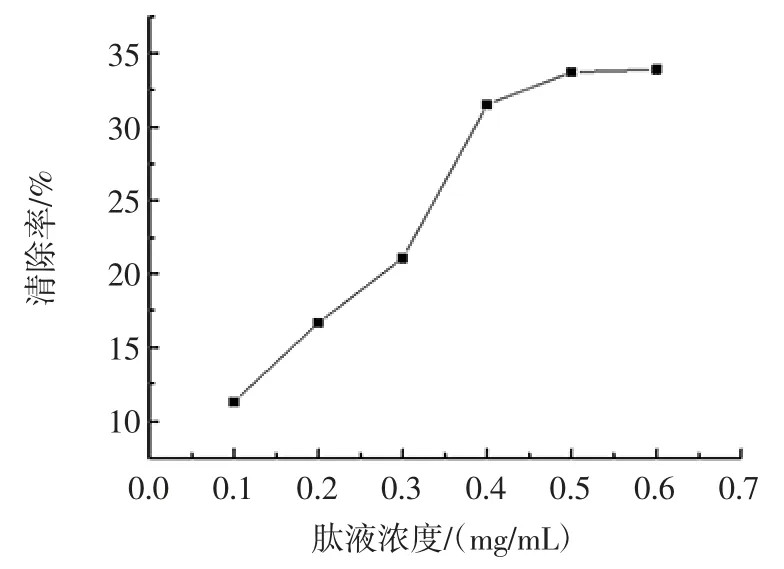
图6 大豆肽对羟基自由基的清除效果Fig.6 Scavenging effect of soybean peptide on hydroxyl radicals
由图6可知,随着大豆肽溶液浓度的升高,对·OH的清除率也随之增加,当浓度达到0.5 mg/mL 时对·OH的清除率最高,清除率最高可达33.73%。
蛋白质具有复杂的分子结构,多肽链弯曲折叠,表面包裹着亲水性外壳,具有抗氧化能力的氨基酸残基被折叠和压缩隐藏在大豆11S 球蛋白分子内部,当胰蛋白酶水解大豆11S 球蛋白后抗氧化活性的氨基酸残基暴露,表现出抗氧化能力增强。
3 结论
大豆11S 球蛋白中存在多个胰蛋白酶的专一性切割位点,本研究通过胰蛋白酶专一识别赖氨酸和精氨酸残基的肽链,获得多肽溶液,并研究对超氧阴离子自由基(O2-·)和羟基自由基(·OH)的清除效果。以水解度为指标考察,在底物浓度为2 mg/mL 时,酶与底物比、pH 值、温度和水解时间对胰蛋白酶水解大豆11S球蛋白单因素影响,在单因素试验的基础上,通过响应面法研究了胰蛋白酶水解大豆11S 球蛋白的水解条件:当酶和底物比 4 900 U/g、pH 值 8.1、温度 44℃、水解时间2.6 h,大豆11S 球蛋白水解度为89.25%。通过对其抗氧化能力的测定表明,大豆肽溶液具有良好的O2-·和·OH 的清除能力,清除率随着大豆肽添加量的增加而提高。当肽液浓度为12 mg/mL 时,对O2-·的清除率最高达到46.86%;当肽液浓度为0.5 mg/mL 时对·OH 的清除率最高,达到33.73%。
