植物乳杆菌对猕猴桃果酒品质影响的评价
2019-05-31葛东颖李华佳刘雪婷杨成聪陈欣蕾郭壮
葛东颖,李华佳,刘雪婷,杨成聪,陈欣蕾,郭壮,*
(1.湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.四川省农业科学院 农产品加工研究所,四川 成都 610066)
作为呼吸跃变型水果,猕猴桃采摘后不易保藏和运输,长时间贮藏易变软和腐败变质,因此对其进行深加工则显得尤为重要[1]。猕猴桃果酒作为猕猴桃深加工的产品,不仅具有浓郁醇厚的酒香,其VC的含量也相对较高,具有较好的保健作用[2]。但目前猕猴桃果酒的市场接受度却并不高,究其原因在于猕猴桃果酒的酸度过高,消费者难以接受[3]。多年来,国内外的众多研究者都致力于借助苹果酸-乳酸发酵(malolactic fermentation,MLF)来降低果酒中的酸度[4]。
在MLF 发酵过程中,酒类酒球菌(Oenococcus oeni)和植物乳杆菌(Lactobacillus plantarum)可以把口感尖锐的苹果酸转化为口感圆润的乳酸,从而实现了果酒酸度的降低[5]。然而目前商业化的O.oeni 生长缓慢且对于环境及营养的要求较高,生长周期较长,延缓了工业化生产周期,增加了污染的潜在可能性[6],L.plantarum 对环境的适应能力较强、生产速度快,使猕猴桃果酒的产业化生产成为了可能[7]。电子舌和电子鼻技术在食品品质的评价方面具有广泛的应用,不仅可以快速的对食品滋味和风味品质进行分析,而且具有不受主观因素影响的优点[8],两种技术相结合目前在红酒[9-10]、橄榄油[11]、樱桃番茄汁[12]和鱼肉[13]的品质评价中有着广泛的应用。
本研究以鄂西北传统发酵食品菌种资源库中39株L.plantarum(植物乳杆菌)为依托,将其与酵母菌混合发酵进行猕猴桃果酒制备,并使用电子舌和电子鼻相结合的手段对猕猴桃果酒的品质进行评价,同时结合高效液相色谱(high performance liquid chromatography,HPLC)技术对果酒中有机酸构成进行了分析,以期从中筛选出发酵性能优良的菌株用于后续猕猴桃果酒的生产。
1 材料与方法
1.1 材料与仪器
徐香猕猴桃:市售;39 株L.plantarum(植物乳杆菌):由湖北文理学院鄂西北传统发酵食品菌种资源库提供,其中1号~5号菌株编号为HBUAS52005、HBUAS52006、HBUAS52007、HBUAS52008 和 HBUAS52010,6~10号菌株编号为 HBUAS52015、HBUAS-52016、HBUAS52017、HBUAS52018 和 HBUAS52019,11号~15号菌株编号为 HBUAS52020、HBUAS52154、HBUAS52168、HBUAS52173和HBUAS52175,16号~20号菌株编号为 HBUAS52151、HBUAS52153、HBUAS52155、HBUAS52166 和 HBUAS52158,21号~25号菌株编号为HBUAS52340、HBUAS52336、HBUAS52337、HBUAS5 -2343 和 HBUAS52345,26号~30号菌株编号为HBUAS-52346、HBUAS52350、HBUAS52333、HBUAS5232 1 和HBUAS52323,31号~35号菌株编号为 HBUAS52324、HBUAS52328、HBUAS52352、HBUAS52339 和HBUAS-52322,36号~39号菌株编号为 HBUAS52325、HBUAS-52327、HBUAS52354 和 HBUAS52356;RW 葡萄酒·果酒专用酵母:安琪酵母股份有限公司;甲醇(色谱纯)、异丙醇(色谱纯)、磷酸二氢钾(优级纯)、奎宁酸(优级纯)、苹果酸(优级纯)、乳酸(优级纯)、柠檬酸(优级纯):国药集团化学试剂有限公司;氯化钠:分析纯,天津市化学试剂研究所有限公司;国药集团化学试剂有限公司;果胶酶(5 万 U/g)、偏重亚硫酸钾:食品级,烟台帝伯仕自酿机有限公司;参比溶液、阳离子溶液、预处理溶液、阴离子溶液、内部溶液:日本INSENT 公司。
SA 402B 电子舌(配备2个参比电极和5个味觉传感器):日本 Insent 公司;PEN3 电子鼻(配备 10个金属传感器):德国Airsense 公司;LC-20ADXR 高效液相色谱仪、InertSustainSwift C18 色谱柱(250 mm×4.6 mm,5 μm)、SPD-M20A 二极管阵列检测器:日本岛津公司;CR21N 高速离心机:日本日立公司;250B 数显生化培养箱:金坛市荣华仪器制造有限公司。
1.2 试验方法
1.2.1 猕猴桃果酒的制作
选择相同成熟度且无变质的猕猴桃去皮后破碎入罐,按添加0.10 mg/L 偏重亚硫酸钾和0.06%的果胶酶,搅拌均匀后使用白砂糖调节糖度至22°Brix,接种酵母6 h 后分装为40 罐,按照106CFU/mL 猕猴桃酒添加量分别接入 39 株 L.plantarum 于 22℃发酵 7 d 后18℃后发酵20 d,样品5 000 r/min 离心10 min 取上清液待用[14]。设置不添加L.plantarum 的样品为对照组。
1.2.2 基于电子舌猕猴桃果酒的滋味品质评价
参考王玉荣等[15]和郭壮等[16]对米酒滋味品质测定的条件并做适当优化。取40 mL 果酒样品和80 mL 蒸馏水混合均匀后10 000 r/min 离心10 min,取上清液抽滤待用。每个样品重复测定4 次,取后3 次数据为试验数据。
1.2.3 基于电子鼻猕猴桃果酒的风味品质评价
参考张振等[17]和徐晚秀等[18]对黄酒和白酒风味品质测定的条件并做适当优化。取10 mL 果酒样品于电子鼻样品瓶中,50℃保温30 min,室温静置10 min 后插入电子鼻探头进行测定,平行测定3 次。响应曲线在 60 s 后达到稳定,选取 69、70 s 和 71 s 的响应值,并计算其平均值为测试值。
1.2.4 基于HPLC 猕猴桃果酒中有机酸测定
参考王刚等[19]和杨成聪等[20]对猕猴桃果酒和米酒有机酸测定的条件并做适当优化,对猕猴桃果酒中奎宁酸、乳酸、苹果酸和柠檬酸的含量进行测定。准确吸取2 mL 果酒样品于10 mL 容量瓶中,加入0.2 mL 的0.1 mol/L 的磷酸溶液后用流动相定容,过0.22 μm 针孔滤膜待用。参数设置:流动相为0.01 mol/L 磷酸二氢钾溶液(pH 2.50),柱温 30℃,流速 1.0 mL/min,检测器为二极管阵列紫外-可见光检测器,检测波长215 nm。采用保留时间对果酒中4种有机酸进行定性,采用峰面积和外标法对4种有机酸进行定量计算。
1.2.5 统计学分析
使用主成分分析法(principal component analysis,PCA)和多元方差分析(multivariate analysis of variance,MANOVA)对猕猴桃果酒品质进行分析,采用Mann-Whitney 检验对不同分组猕猴桃果酒各指标的差异性进行分析。采用PAST 3 软件做PCA,其他分析均使用MATLAB 2016b 软件;使用 Origin 2017 绘图。
2 结果与分析
2.1 猕猴桃果酒滋味和风味品质评价
本研究首先使用电子舌技术对猕猴桃果酒8个滋味品质指标进行了测定,结果如图1所示。
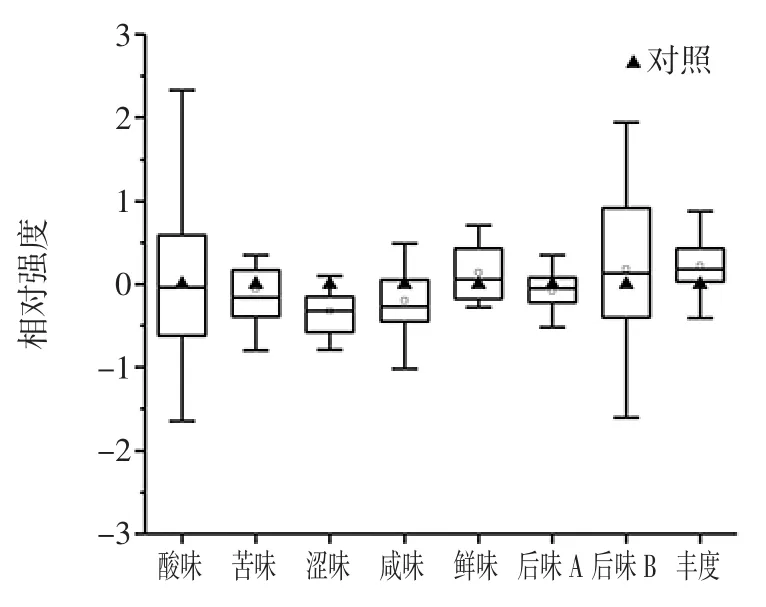
图1 猕猴桃果酒各滋味指标的箱形图(n=40)Fig.1 Box diagram of the taste indicators of kiwi fruit wine(n=40)
由图1可知,纳入研究的40个猕猴桃果酒在酸味和后味B(苦的回味)上具有较大的组间差异,极差值分别为5.05 和3.55,其次为苦味、咸味、丰度(鲜味的回味)和后味A(涩味的回味),极差值分别为2.69、2.22、1.63 和1.06,而在鲜味和涩味上的差异值较小,分别为0.99 和0.89。当不同样品在某一滋味指标上的差值大于1.0 时,其差异可以通过感官鉴评的方法予以区分出[21],由此可见,猕猴桃果酒的鲜味和涩味不会影响消费者对产品的喜好程度。
由图1 亦可知,添加L.plantarum 发酵后部分猕猴桃果酒较之对照组其酸味、苦味、涩味、咸味和后味A(涩味的回味)呈明显下降趋势,而部分猕猴桃果酒的丰度(鲜味的回味)呈现上升趋势。由此可见,添加L.plantarum可明显改善猕猴桃果酒的滋味品质,然而这与菌株自身的发酵特性有关,不同菌株之间差异较大,因而进行猕猴桃果酒用优良MLF 植物乳杆菌的筛选则显得尤为重要。本研究进一步采用电子鼻技术对不同处理猕猴桃果酒中典型物质类型进行了测定,结果如表1所示。
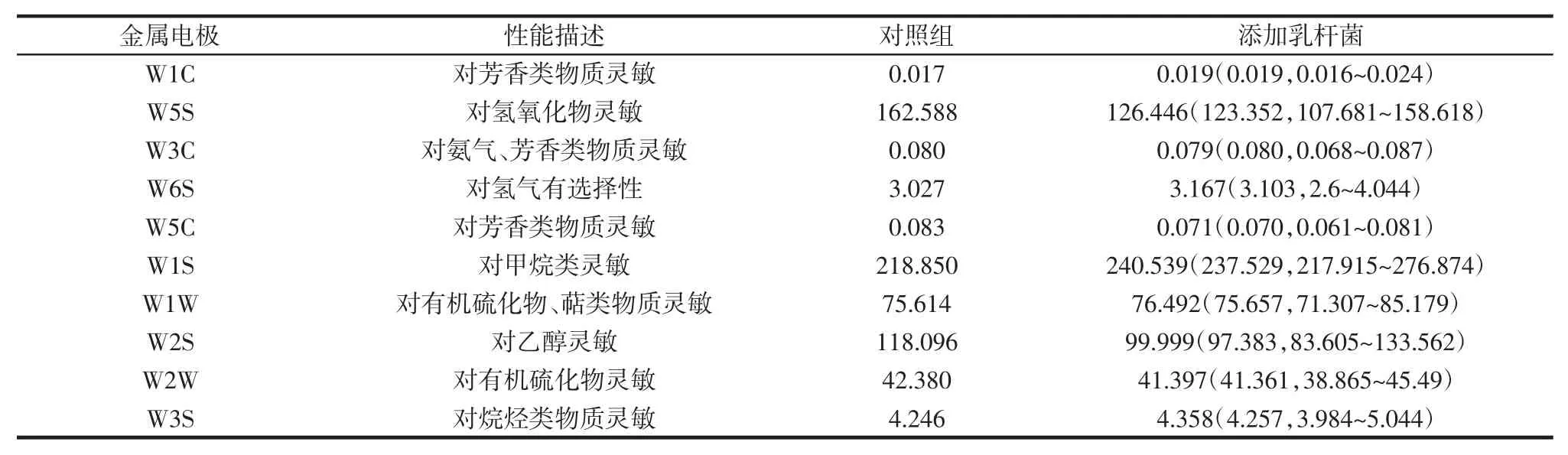
表1 猕猴桃果酒中风味指标的差异性分析(n=40)Table 1 Difference analysis of flavor indicators in kiwi fruit wine(n=40)
由表1可知,传感器 W1C、W6S、W1S、W1W 和W3S 对添加L.plantarum 发酵猕猴桃果酒的响应值明显偏低,而传感器W5S 和W5C 呈现出相反的趋势。由此可见,添加L.plantarum可明显提升猕猴桃果酒的香气成分,同时对部分不良气味具有明显的降低作用。
2.2 基于PCA猕猴桃果酒的差异性分析
以滋味和气味为评价指标,在构建18 行×40 列矩阵的基础上,本研究使用PCA 对猕猴桃果酒品质的区分度进行了评价,PCA 的方差贡献率如表2所示。
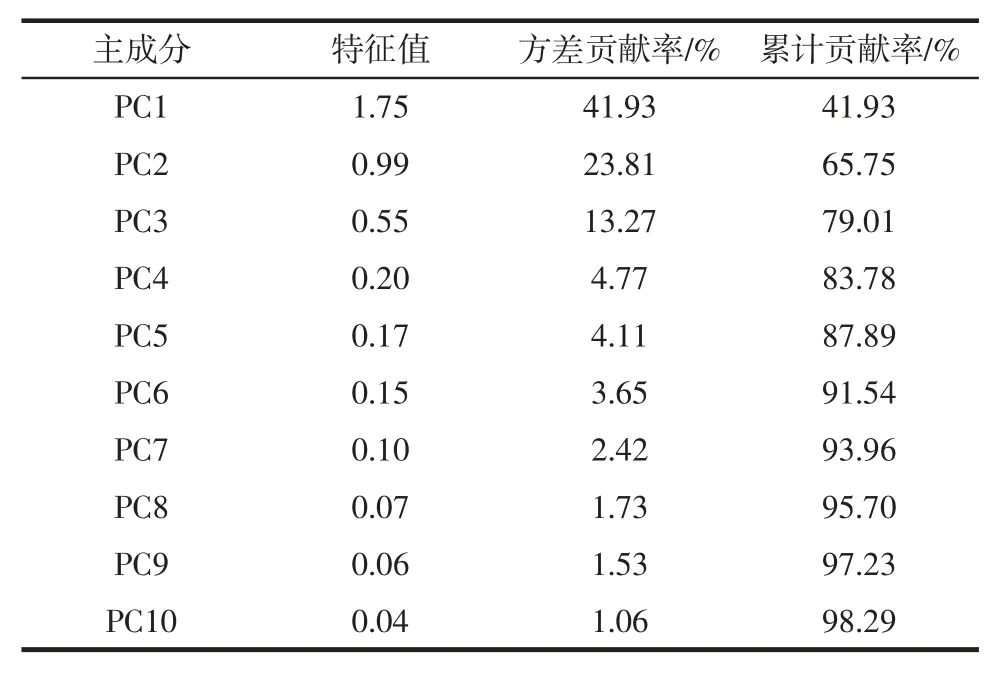
表2 主成分的方差贡献率Table 2 Variance contribution rate of principal components
由表2可知,仅PC1 的特征值大于1,前5个主成分的累计方差贡献率为87.89 %,分别为41.93 %、23.81%、13.27%、4.77%和4.11%。由此可知,18个评价指标降为了5个不相关的综合变量,说明了这5个综合变量代表了绝大部分的变量信息,达到了降维的目的。基于PCA 猕猴桃果酒因子载荷图如图2所示。
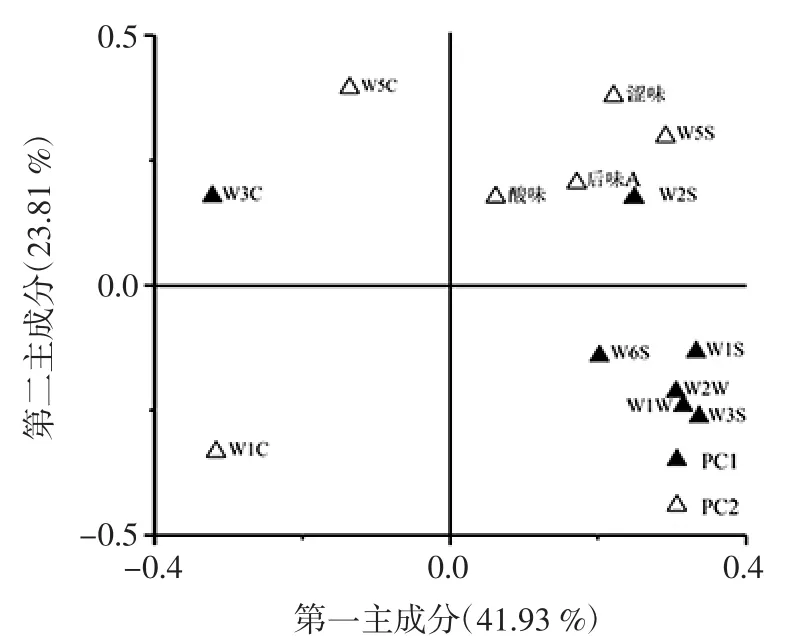
图2 基于PCA 猕猴桃果酒品质的因子载荷图Fig.2 Factor load map based on PCA kiwi fruit wine quality
由图2可知,第一主成分(PC1)主要是由W3C、W2S、W1S、W2W、W1W 和 W3S 6个指标构成,PC1中载荷量较高的正影响品质评价指标是W3S、W1S、W1W、W2W、W2S 和 W6S,其中 W3S 的载荷量最高为0.34,载荷量较高的负影响品质评价指标是W3C,其载荷量为0.32,即PC1 的差异性主要集中在烷烃类物质和芳香类物质上;第二主成分主要是由W5C、涩味、W5S、后味A(涩味的回味)、酸味和W1C 构成并占全部权重的23.81%,PC2中载荷量较高的正影响品质评价指标是W5C、涩味、后味A(涩味的回味)和酸味,其中W5C 的载荷量最高为0.40,载荷量较高的负影响品质评价指标为W1C,其载荷量为0.33,即PC2 的的差异性主要集中在涩味和芳香类物质上。基于PCA 分析猕猴桃果酒的因子得分图如图3所示。
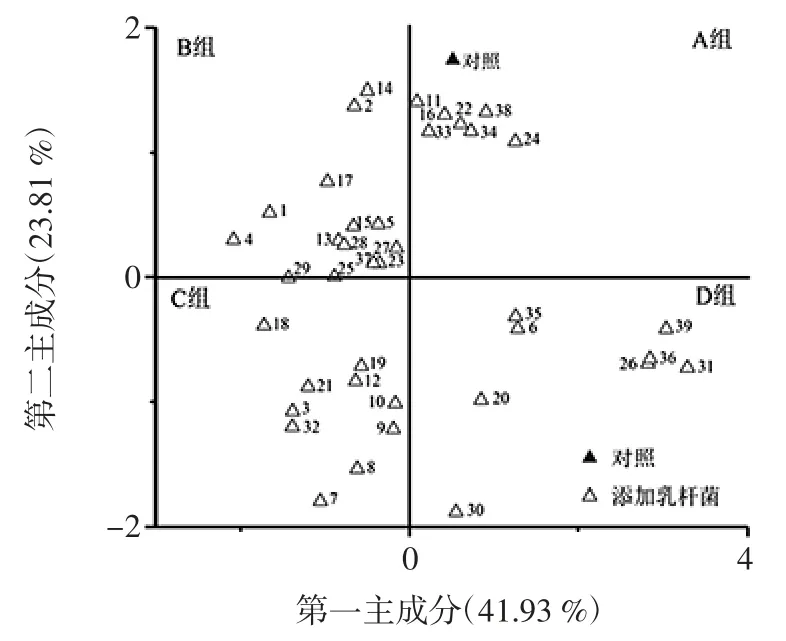
图3 基于PCA 猕猴桃果酒品质的因子得分图Fig.3 Factor score map based on PCA kiwi fruit wine quality
由图3可知,40个猕猴桃果酒样品在4个象限均有分布,其中分布于第一、二、三和四象限的样品数分别为8、14、10个和8个。结合因子载荷图可知,偏向X 轴正方向的猕猴桃果酒样品在烷烃类、甲烷类、有机硫化物和乙醇的相对含量较高,偏向X 轴负方向的猕猴桃果酒样品在芳香类物质含量较高;而偏向Y 轴正方向的猕猴桃果酒样品在涩味、酸味、后味A(涩味的回味)和氢氧化物等强度较大,偏向Y 轴负方向的猕猴桃果酒样品的芳香类物质含量较高。由此可知,位于第三象限的猕猴桃果酒品质最好,其次为第二、第四和第一象限,因而第三象限的10 株菌株,尤其是7号(菌种资源库中编号为 HBUAS52016)和8号L.plantarum(菌种资源库中编号为HBUAS52017)可以作为猕猴桃果酒用优良MLF 植物乳杆菌的潜在菌株进行后续筛选。
2.3 猕猴桃果酒有机酸的分析
本研究以PCA 结果为分组依据,将40个猕猴桃果酒样品分为 A、B、C组和 D组,同时结合 HPLC 对猕猴桃果酒中的4种有机酸进行分析,从而对造成不同品质猕猴桃果酒间差异的关键物质进行甄别,进而为后续猕猴桃果酒用L.plantarum 的筛选提供指导。不同分组猕猴桃果酒中有机酸含量的比较分析结果如表3所示。
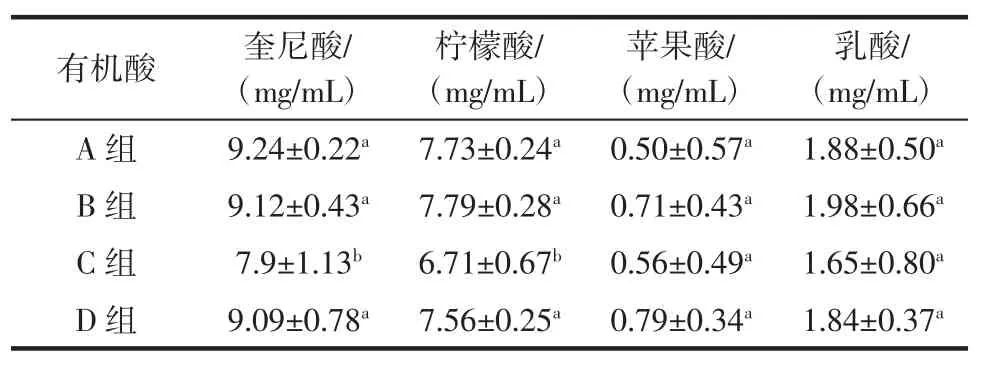
表3 猕猴桃果酒中4种有机酸的差异性分析Table 3 Difference analysis of four organic acids in kiwi fruit wine
由表3可知,猕猴桃果酒中奎尼酸的含量最高、其次是柠檬酸、乳酸和苹果酸。经Mann-Whitney 检验发现,C组猕猴桃果酒中奎尼酸和柠檬酸的含量显著低于其他组(P〈0.05),而苹果酸和乳酸的含量与其他组显著均不差异(P〉0.05)。由此可见,品质较佳的猕猴桃果酒其有机酸含量偏低,且添加L.plantarum可明显降低猕猴桃果酒中的有机酸含量。
3 结论
以鄂西北传统发酵食品菌种资源库中39 株L.plantarum 为依托,将其与酵母菌混合发酵进行猕猴桃果酒制备,并使用电子舌和电子鼻相结合的手段对猕猴桃果酒的品质进行了评价,结果发现部分L.plantarum 通过降低猕猴桃果酒的酸味、苦味和涩味及提升香气成分从而改善了猕猴桃果酒的品质,且L.plantarum HBUAS52016 和L.plantarum HBUAS52017可作为猕猴桃果酒用优良MLF 植物乳杆菌的潜在菌株进行后续筛选。
