阿托伐他汀诱导EPC-MVs增多对STEMI患者心肌细胞的保护作用研究Δ
2019-05-31林芸芸黄珊宋艳玲顾申红
林芸芸,黄珊,宋艳玲,顾申红#
(1.海南医学院第一附属医院全科医学科,海口570102;2.海南医学院第一附属医院心内科,海口 570102)
缺血性心血管疾病是世界范围内患者死亡的首要原因,急性心肌缺血性损伤可导致患者冠状动脉长期供血不足,从而致使其心肌细胞发生不可逆转的损伤[1]。有研究指出,急性心肌梗死患者常常合并内皮祖细胞(EPCs)减少及功能下降[2]。EPCs是一类在血液系统中循环并能分化为血管内皮细胞的前体细胞,其数量减少是血管内皮功能紊乱的独立危险因素[3]。相关研究表明,阿托伐他汀可升高冠心病患者体内高密度脂蛋白胆固醇(HDL-C)水平,后者是EPCs数量和功能的重要决定因素[3-4]。同时,由EPCs分泌的微囊泡(MVs)可抑制心肌细胞肥大和凋亡,并促进受损心肌细胞恢复[4-5]。近年来有研究证实,内皮祖细胞微囊泡(EPC-MVs)可介导重要的生物学调控功能(如血管的修复与再生、相关细胞内皮化等),而人源微RNA-126(hsa-miR-126)作为EPCs特异性表达的一种促血管内皮新生的微RNA(miRNA),极有可能参与了上述生物学调控的过程[6]。本研究通过观察阿托伐他汀对ST段抬高型心肌梗死(STEMI)患者EPCs数目以及MVs分泌功能的影响,以期为进一步明确他汀类药物的作用机制,为急性心肌缺血性损伤的防治提供有效治疗策略。
1 资料与方法
1.1 纳入、排除与脱落标准
纳入标准:(1)依据《2012年欧洲心脏病学会ST段抬高的急性心肌梗死管理指南》的诊断标准[7]确诊为STEMI;(2)年龄 45~75岁;(3)从未使用过他汀类药物。
排除标准:(1)恶性肿瘤患者;(2)严重的内科疾病患者;(3)严重的肝、肾、肺功能不全者;(4)慢性传染性疾病患者;(5)精神疾病患者;(6)存在药物过敏史者;(7)服药依从性差者;(8)孕产妇;(9)出现肌酸磷酸激酶升高(>7.5 U/dL)并伴有肌炎者[8]。
脱落标准:(1)失去联系无法获得长期随访信息者;(2)不配合随访调查,语言表达不明确者;(3)死亡者。
本研究方案经医院医学伦理委员会审核通过后,所有受试者均知晓本研究的内容及目的,并签署了知情同意书,严格遵照同意书精神进行本项研究。
1.2 研究对象
选取2015年2月-2018年2月我院心内科收治的STEMI患者182例,按照所服用阿托伐他汀的剂量分为A组(88例)和B组(94例)。
其中,A组中男性50例,女性38例;年龄52~75岁,平均(61.3±8.1)岁;有吸烟史者39例(占44.32%);高血压18例(占20.45%),高脂血症31例(占35.22%),糖尿病12例(占13.64%),糖尿病合并高血压18例(占20.45%),糖尿病合并高脂血症5例(占5.68%),高血压合并糖尿病3例(占3.41%),高血压合并糖尿病、高脂血症者1例(占1.14%)。B组中男性53例,女性41例;年龄50~75岁,平均(61.3±8.1)岁;有吸烟史者38例(占40.43%);高血压18例(占19.15%),高脂血症28例(占29.79%),糖尿病20例(占21.28%),糖尿病合并高血压21例(占22.34%),高血压合并糖尿病与高脂血症者7例(占7.45%)。两组患者上述一般资料比较,差异均无统计学意义(P>0.05)。此外,经冠状动脉造影分析,两组患者的冠状动脉血管病变数目、病变位置及病变类型等比较,差异均无统计学意义(P>0.05),具有可比性,详见表1(同一患者可能存在多处病变或多种病变类型,故其合计值>患者总数)。

表1 两组患者冠状动脉病变情况比较[例(%%)]Tab 1 Comparison of coronary artery lesion between 2 groups[case(%%)]
1.3 治疗方法
两组患者均接受经皮冠状动脉介入治疗(PCI),术后予注射用比伐芦定[江苏豪森药业集团有限公司,批准文号:国药准字H20140057,规格:0.25 g(按C98H138N24O33计)]0.75 mg/kg,静脉注射,随后以1.75 mg/(kg·h)静脉滴注至术后6 h,同时口服硫酸氢氯吡格雷片(法国Sanofi Clir SNC公司,注册证号:国药准字J20130083,规格:75 mg),维持剂量为75 mg/d,每日1次+阿托伐他汀钙片(辉瑞制药有限公司,批准文号:国药准字H20051408,规格:20 mg)行抗血小板治疗。其中,A组患者口服20 mg,每日1次;B组患者口服20 mg,每日2次。30 d为1个疗程,两组患者均连续治疗至少3个疗程。
1.4 考察指标
1.4.1 血脂水平的检测 分别于治疗前及治疗后第30、60、90天自前臂静脉抽取两组患者的外周静脉血2 mL,采用化学抽提法以VITROS 5600型全自动生化分析仪及配套试剂盒(美国Johnson&Johnson公司)检测血液中总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、HDLC的水平。严格按照相应试剂盒说明书操作。
1.4.2 EPCs的检测 分别于治疗后第30、60天,自前臂静脉抽取两组患者的外周静脉血20 mL,置于含3.8%肝素钠的真空采血管中,于4℃下以1 600 r/min离心30 min,分离外周血单核细胞。将上述单核细胞用磷酸盐缓冲液(PBS,pH 7.4)清洗2次,以1 000 r/min离心5 min,弃去上清液,于4℃下孵育30 min后,在避光条件下分别加入藻红蛋白(PE)标记的山羊抗小鼠CD133、异硫氰酸荧光素(FITC)标记的山羊抗兔CD34单克隆抗体(德国Miltenyi Biotec Macs公司,加入量均为1∶800),于4℃、2%多聚甲醛溶液中孵育30 min,用PBS清洗,以1 000 r/min离心5 min,弃去上清液,沉淀用PBS 400 μL重悬后,采用EPICS®XL-MCLTM流式细胞分析仪(美国BD公司)检测,并记录EPCs阳性细胞计数(CD133、CD34双染色即为EPCs阳性细胞)。
1.4.3 EPC-MVs的提取及其miRNA表达谱的检测 于治疗后第60天,取“1.4.2”项下EPCs约1×106个,加至含0.5%胎牛血清白蛋白(BSA)的RPMI 1640培养基(美国Gibco公司)中,于37℃、5%CO2条件下培养24 h后,于4℃下以2 500 r/min离心20 min,收集上清液,继续于4℃下以10 000 r/min离心1 h,弃去上清液,沉淀用含25 mmo/L 4-羟乙基哌嗪乙硫磺酸(HEPES)缓冲液(pH 7.3)的Medium 199培养基(美国Gibco公司)进行重悬,于4℃下以10 000 r/min离心1 h,沉淀用PBS 100 μL重悬,于-80℃冰箱中保存,备用。采用Affymetrix microRNA 3.0 Array基因芯片检测两组患者经阿托伐他汀治疗后外周血EPC-MVs miRNA的表达谱。该试验操作及结果判定均由上海其明信息技术有限公司完成。
1.4.4 差异miRNA表达的验证 根据“1.4.3”项下表达谱的检测结果,选择5个差异较大(两组患者每个特异性芯片富集miRNA的reads数的差异倍数大于1为“上调”,其值越大,差异越明显;差异倍数小于1为“下调”,其值越小,差异越明显)的基因,采用荧光定量聚合酶链反应技术(qRT-PCR)对其miRNA表达进行验证。取“1.4.2”项下EPCs约1×106个,采用Trizol试剂盒(美国Invitrogen公司)并参照其说明书方法提取细胞总RNA,采用miRNA首链cDNA合成试剂盒(美国Invitrogen公司)并参照其说明书逆转录得miRNA,以U6为内参,采用qRT-PCR法检测miRNA的表达量。反应体系及条件参照SYBR®Premix Ex TaqTMⅡ试剂盒(日本Takara公司)说明书,采用2-ΔΔCt法计算miRNA的相对表达量(Ct表示每个样品的荧光信号达到设定阈值时所经历的循环数)[9]。上述试验均重复3次。
1.4.5 差异表达最明显的miRNA靶基因分析 通过StarBase在线数据库(http://starbase.sysu.edu.cn/)检索差异表达最明显(即miRNA表达差异倍数最大)的靶基因,并通过DAVID生物信息学资源数据库(https://david.ncifcrf.gov/)对其进行KEGG通路富集分析。
1.4.6 差异表达最明显的miRNA对心肌HCM-a细胞增殖的影响 采用CCK-8法检测差异表达最明显miRNA对心肌HCM-a细胞的影响。该miRNA特异性干扰物(siRNA)、模拟物(mimics)和阴性对照物(NC)均由北京欧林格生物技术有限公司合成,转染试剂为Lipo-fectamine 2000(美国Invitrigen公司)。取心肌HCM-a细胞(美国ATCC公司)适量,接种至6孔板中,待细胞融合至60%时进行转染试验。将细胞随机分为空白组、NC组、siRNA组和mimics组,每组设置3个复孔。在转染前,先将siRNA、mimics、NC和转染试剂分别加至OPTIMEMⅠ无血清培养基(美国Gibco公司)100 μL中,室温孵育5 min后,将含转染试剂的培养基(100 μL)分别与含siRNA、mimics、NC的培养基(100 μL)混合(1∶1,V/V),使siRNA、mimics、NC终浓度均为1×10-7mol/L,即得相应转染混合液。室温孵育20 min后,将上述转染混合液转染至相应组别的心肌HCM-a细胞中,并加入含10%BSA的RPMI 1640培养基(即完全培养基,下同)1.8 mL(终体积为2 mL),空白组不作处理。转染6 h后,更换新鲜的完全培养基,继续转染12 h,收集细胞,用胰蛋白酶(美国Solarbio公司)2 mL消化,随后加入完全培养基配制单细胞悬液,取一部分以2×105个/孔接种于6孔板中,按“1.4.4”项下方法检测mRNA的相对表达量,以评价转染效果;取另一部分以5 000个/孔接种于至96孔板中,于37℃、5%CO2条件下培养过夜,按照CCK-8试剂盒(日本DojinDo公司)说明书步骤处理48 h后,以SpectraMax M2型多功能酶标仪(美国Molecular Devices公司)于450 nm波长处检测各孔的光密度(OD)值(OD值越高,表示增殖能力越强)。上述试验重复3次。
1.5 安全性评价
记录两组患者治疗过程中不良反应的发生情况。
1.6 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计数资料以例数或率表示,组间比较采用χ2检验或精确概率检验;计量资料以x±s表示,组间比较采用LSD-t或重复测定方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 脱落情况
A组有8例患者脱落,B组有6例患者脱落,脱落原因均为失联,总体脱落率为7.69%。最终有168例患者完成本研究,其中A组80例、B组88例。
2.2 两组患者血脂水平比较
治疗前,两组患者TC、LDL-C、HDL-C水平比较,差异均无统计学意义(P>0.05);治疗后第60、90天,两组患者的HDL-C水平均显著增高,且B组显著高于同时间点A组,差异均有统计学意义(P<0.05);而治疗前后两组患者TC、LDL-C水平,治疗后第30天HDL-C水平组间比较,差异均无统计学意义(P>0.05),详见表2。

表2 两组患者治疗前后血脂水平比较(x±s,mmol/L)Tab 2 Comparison of blood lipid levels between 2 groups before and after treatment(x±s,mmol/L)
2.3 两组患者外周血EPCs阳性细胞数比较
治疗后第30天,两组患者外周血EPCs阳性细胞数比较,差异无统计学意义(P>0.05)。治疗后第60天,B组患者外周血EPCs阳性细胞数显著增多,且显著多于同时间点A组,差异均有统计学意义(P<0.05);而A组患者外周血EPCs阳性细胞数与治疗后第30天比较,差异无统计学意义(P>0.05),详见表3。

表3 两组患者外周血EPCs阳性细胞数比较(x±s,个)Tab 3 Comparison of the number of EPCs positive cells in peripheral blood between 2 groups(x±s,case)
2.4 EPC-MVs中差异表达的miRNA
与A组比较,B组患者EPC-MVs中表达差异超过1.5倍(两组患者reads数的比值,包括增加和减小)的miRNA共有16个,其中包括7个上调表达miRNA(hsamiR-1228-5p、hsa-miR-126、hsa-miR-1275、hsa-miR-3176、hsa-miR-4521、hsa-miR-544b、hsa-miR-7974),9个下调表达 miRNA(hsa-let-7b-3p、hsa-miR-105-5p、hsamiR-122-5p、hsa-miR-200c-3p、hsa-miR-3180、hsa-miR-375、hsa-miR-494-5p、hsa-miR-7641、hsa-miR-7704),差异均有统计学意义(P<0.05)。其中,差异表达最明显的是hsa-miR-126,B组是A组的20.91倍,详见表4(表中结果表示每个特异性芯片富集miRNA的reads数)。
由表4可见,差异表达排前5位的分别为hsa-miR-126(上调)、hsa-miR-1275(上调)、hsa-miR-7704(下调)、hsa-miR-105-5p(下调)、hsa-miR-3180(下调),其qRTPCR引物序列见表5,qRT-PCR扩增结果见表6。由表6可见,B组患者hsa-miR-126、hsa-miR-1275的相对表达量均显著升高,hsa-miR-7704、hsa-miR-105-5p、hsa-miR-3180的相对表达量均显著降低,差异均有统计学意义(P<0.05),与芯片检测结果一致。
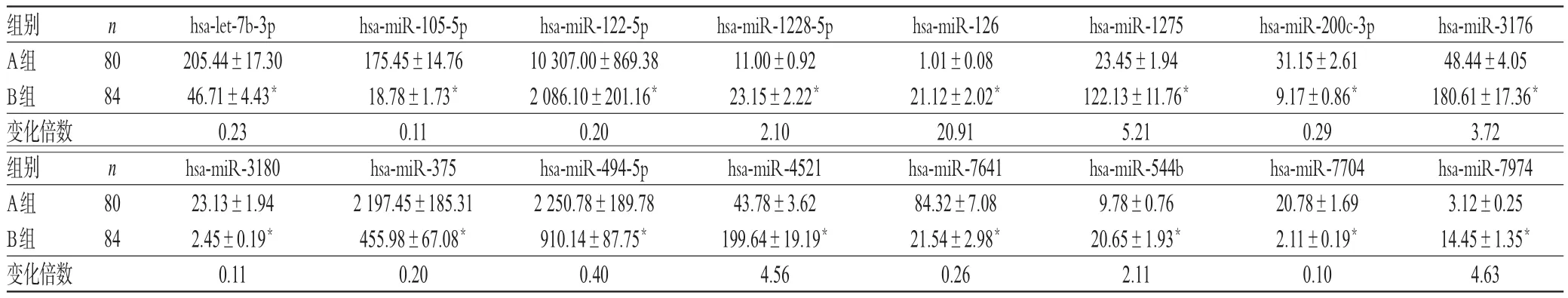
表4 两组患者EPC-MVs中miRNAs表达谱的检测结果(x±s)Tab 4 Results of expression profile of miRNAs in EPC-MVs in 2 groups(x±s)
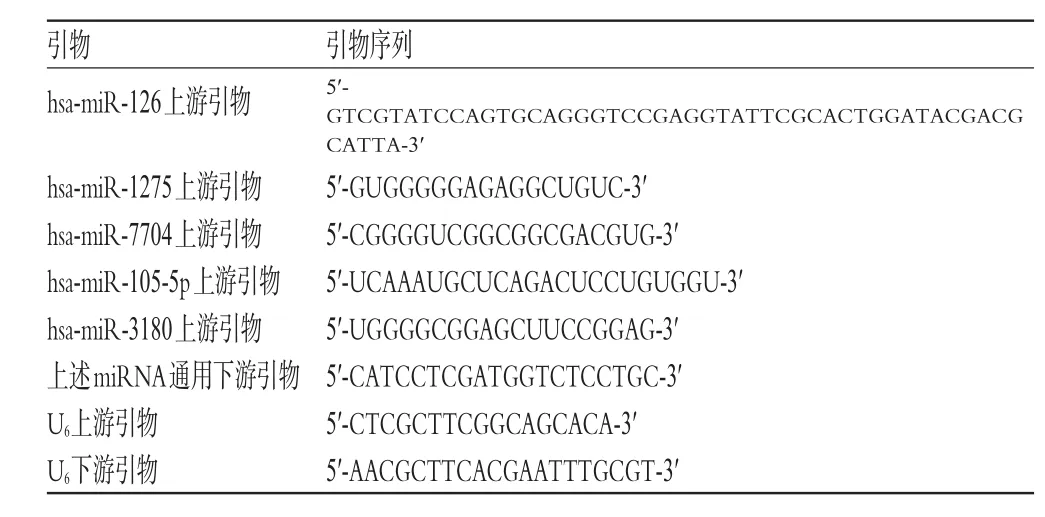
表5 qRT-PCR引物序列Tab 5 qRT-PCR primer sequences

表6 两组患者EPC-MVs中差异表达排前5位的miRNAs的相对表达量比较(x±s)Tab 6 Comparison of relative expression of top 5 differentially expressed miRNAs in EPC-MVs between 2 groups(x±s)
2.5 表达差异最明显miRNA的靶基因预测及KEGG通路富集分析
由“2.4”项下结果可知,两组患者hsa-miR-126表达差异最为明显,其靶基因预测与KEGG通路富集分析结果显示,hsa-miR-126的靶基因包括Ang-1、PDGF、p38MAPK、Smad2/3、HIF-1、TGF-β等,参与调节的信号通路主要包括血管生成信号通路、慢性骨髓性白血病相关通路、肾上皮细胞癌相关通路、Wnt信号通路以及ErbB信号通路,详见表7。
2.6 hsa-miR-126对心肌HCM-a细胞增殖的影响
利用hsa-miR-126的siRNA、mimics(引物序列见表8;其中,mimics为双链结构,有上、下游两个引物)分别转染成人心肌HCM-a细胞。qRT-PCR结果显示经转染后,与空白组比较,siRNA组细胞miRNA的相对表达量显著降低,mimics组细胞miRNA的相对表达量显著升高,差异均有统计学意义(P<0.05);而NC组细胞miRNA的相对表达量与空白组比较,差异无统计学意义(P>0.05)。CCK-8试验结果显示,与空白组比较,siRNA组细胞的OD值显著降低,mimics组细胞的OD值显著升高,差异均有统计学意义(P<0.05);而NC组细胞的OD值与空白组比较,差异无统计学意义(P>0.05),详见表9。

表7 hsa-miR-126靶基因及KEGG通路富集分析结果Tab 7 Analysis results of target gene and KEGG pathway enrichment of hsa-miR-126
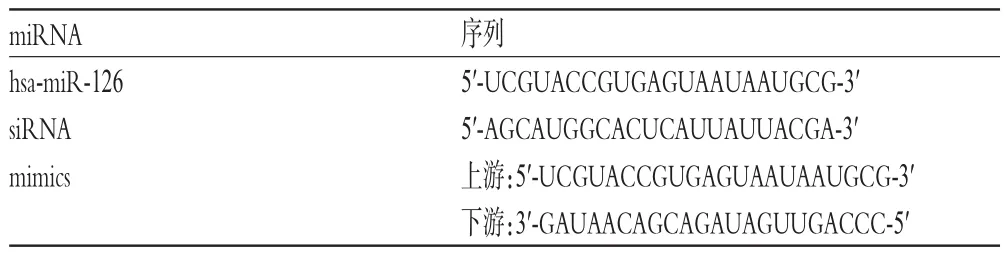
表8 hsa-miR-126及其siRNA、mimics引物序列Tab 8 Primer sequences of hsa-miR-126 and its si-RNAand mimics

表9 hsa-miR-126的转染及CCK-8试验结果(x±s,n=3)Tab 9 Results of hsa-miR-126 transfection and CCK-8 test(x±s,n=3)
2.7 两组患者治疗前后不良反应发生情况
两组患者主要的不良反应为腹泻、恶心呕吐、皮疹、血脂异常和转氨酶轻度升高等。两组患者各不良反应的发生率比较,差异均无统计学意义(P>0.05),详见表10。
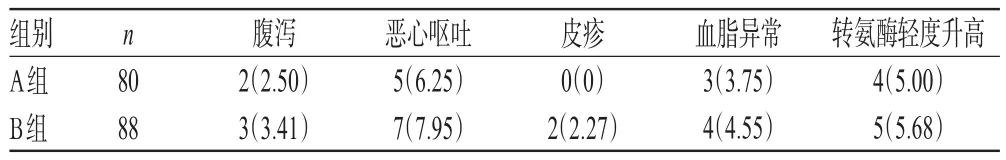
表10 两组患者不良反应发生率比较[例(%%)]Tab 10 Comparison of the incidence of ADR between 2 groups[case(%%)]
3 讨论
冠心病是冠状动脉血管发生动脉粥样硬化病变而引起的血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏疾病[10]。血管内皮功能障碍是动脉粥样硬化的始动环节,是其常见的病理基础之一[11]。EPCs是血管内皮修复的主要执行者,在此修复过程中,其可分泌细胞因子,诱导新血管再生,加速血管内皮化,并保护心肌细胞免受损伤或恢复受损心肌细胞的活力[7,12]。EPCs是体现血管内皮功能状态及健康程度的生物标志物,其数量的减少被认为与不良心血管事件、支架内新生内膜不良增生及血管内皮功能障碍等有关[7,13-14]。由此可见,探讨急性STEMI患者PCI术后长期服用阿托伐他汀对体内EPCs的增殖及MVs分泌功能的影响是研究如何有效保护心肌细胞免受损伤的重要途径之一[7]。
他汀类药物是临床常用药物,可显著降升高HDL-C水平,而后者是EPCs数量和功能的重要决定因素之一[3]。此外有研究指出,他汀类药物可通过诱导EPCs的分化来促进动物缺血心肌细胞的恢复[15-16]。为此,本研究探讨了不同剂量阿托伐他汀对STEMI患者血脂水平和ECPs数量的影响。结果显示,在接受阿托伐他汀治疗后第60、90天,两组患者HDL-C水平均较治疗前显著升高,且B组显著高于同时间点A组;治疗后第60天,B组患者外周血EPCs阳性细胞数较同组治疗后第30天显著升高,且显著多于同时间点A组。这提示不同剂量的阿托伐他汀均可明显提高患者体内HDL-C水平,且大剂量阿托伐他汀可有助于提高患者外周血中EPCs的数量。但本研究并未发现阿托伐他汀对TC、LDL-C水平的影响,可能与本研究样本量较小、研究时间较短等因素有关。
血浆miRNAs的稳定性、组织特异性以及其在疾病状态下的差异表达使其有可能成为新的生物学标记物[17]。在心血管研究领域,越来越多的miRNAs被证实与急性心肌梗死的发生、发展有关[7,18]。同时有研究指出,MVs可抑制心肌细胞肥大和凋亡,并促进受损心肌细胞恢复;EPC-MVs可介导血管修复与再生、细胞内皮化等生物学调控过程,而hsa-miR可能参与了上述过程[4-6]。为此,本研究借助基因芯片技术对两组患者miRNAs的表达情况进行了检测和分析。芯片结果显示,与A组比较,B组患者EPC-MVs中表达差异超过1.5倍的miRNA共有16个,包括7个上调、9个下调表达miRNA,其中表达差异前5位的分别为hsa-miR-126(上调)、hsa-miR-1275(上调)、hsa-miR-7704(下调)、hsa-miR-105-5p(下调)、hsa-miR-3180(下调)。qRT-PCR结果显示,B组患者hsa-miR-126、hsa-miR-1275的相对表达量均显著升高,hsa-miR-7704、hsa-miR-105-5p、hsa-miR-3180的相对表达量均显著降低,与基因芯片检测结果一致。
在这5个差异表达的miRNAs中,hsa-miR-126的表达差异最明显(B组是A组的20.91倍)。hsa-miR-126是来源于内皮细胞的miRNA[19]。有研究指出,冠心病患者血浆hsa-miR-126的表达水平有所降低,且该表达水平与心力衰竭患者的年龄和纽约心脏病协会(NYHA)心功能分级呈负相关[18],表明hsa-miR-126表达的下调可作为心血管疾病患者的独立危险因素[20]。本研究对hsamiR-126的靶基因及KEGG富集通路进行了预测和分析,并借助CCK-8试验评价了其对心肌HCM-a细胞增殖的影响。预测结果显示,hsa-miR-126参与调节的信号通路主要包括血管生成信号通路、慢性骨髓性白血病相关通路、肾上皮细胞癌相关通路、Wnt信号通路以及ErbB信号通路等,靶基因涉及Ang-1、PDGF、p38MAPK、Smad2/3等。qRT-PCR结果显示,经转染后,siRNA组细胞miRNA的相对表达量较空白组显著降低,mimics组细胞miRNA的相对表达量较空白组显著升高,提示转染改变了hsa-miR-126的表达。CCK-8试验结果显示,siRNA组细胞的OD值显著降低,mimics组细胞的OD值显著升高,提示hsa-miR-126对心肌HCM-a细胞的增殖具有一定的促进作用。
安全性评价结果显示,在治疗过程中,两组患者腹泻、恶心呕吐、皮疹、血脂异常和转氨酶轻度升高的发生率比较,差异均无统计学意义。这提示增加阿托伐他汀的剂量并不会对其安全性造成影响。
综上所述,不同剂量的阿托伐他汀均可调节患者体内HDL-C水平,大剂量阿托伐他汀可显著提高EPCs的数量,且不会影响用药的安全性。两组患者EPC-MVs中的差异表达miRNA共有16个,其中7个上调、9个下调,表达差异最明显的为hsa-miR-126(上调)。hsa-miR-126可通过Ang-1、PDGF、p38MAPK、Smad2/3等靶基因来调控血管生成信号通路、慢性骨髓性白血病相关通路等信号通路,从而发挥对心肌细胞增殖的促进作用。但本研究尚未进一步确证hsa-miR-126参与调控的靶基因和信号通路,也并未考观察患者的长期疗效和复发情况,加之样本量和研究时间有限,故上述结论尚有待大样本、多中心临床研究予以证实。
