阿普斯特治疗中重度斑块状银屑病有效性和安全性的Meta分析Δ
2019-05-31高珊钟建桥钟志容李世琴张富勇王述蓉
高珊,钟建桥,钟志容,李世琴,张富勇,王述蓉
(1.西南医科大学药学院,四川泸州646000;2.西南医科大学附属医院皮肤科,四川泸州 646000;3.德阳市人民医院药学部,四川德阳 618000;4.西南医科大学附属医院药学部,四川泸州 646000)
银屑病(Psoriasis)是一种由于机体免疫功能紊乱引起的慢性系统性炎症性疾病[1]。全世界的发病率约为1%~3%[2],其中斑块状银屑病最为常见[3]。银屑病的发病机制尚未明确,有研究认为其是在基因与环境的相互作用下,由细胞免疫介导的一种炎症反应性疾病[4],其中,特异性的磷酸二酯酶4(PDE-4)可调节多种促炎、抗炎介质的代谢,为银屑病的治疗提供了新的途径[4]。PDE是细胞内环磷酸腺苷(cAMP)的主要调节因子,PDE-4是免疫细胞中主要的PDE亚型,可通过提高cAMP水平来降低促炎介质[如肿瘤坏死因子α(TNF-α)、白细胞介素23(IL-23)]和其他炎性介质[IL-2、干扰素 γ(IFN-γ)、白三烯、一氧化氮合成酶]的表达,同时增加抗炎介质(如IL-10)的产生[5]。
阿普斯特(Apremilast)是一种口服的PDE-4抑制剂,可通过抑制PDE-4的活性来抑制炎症反应,已广泛用于银屑病的治疗[6]。目前尚缺乏阿普斯特用于中重度斑块状银屑病有效性和全性的循证医学证据,这在一定程度上限制了其临床应用[7]。为此,本研究采用Meta分析的方法系统评价了阿普斯特治疗中重度斑块状银屑病的有效性和安全性,旨在为临床合理用药提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的随机对照试验(RCT),语种不限。
1.1.2 研究对象 年龄≥18岁;临床确诊为中重度斑块状银屑病,均符合《临床诊疗指南:皮肤病与性病分册》[8]中的诊断标准。
1.1.3 干预措施 试验组患者给予阿普斯特或阿普斯特联合其他药物;对照组患者给予安慰剂。
1.1.4 结局指标 ①银屑病皮损面积和严重程度指数(PASI)下降75%(PASI 75%)例数;②PASI 90%例数;③疾病严重度静态测量(sPGA)0或1例数;④不良反应;⑤严重不良反应;⑥不良反应导致退出情况。
1.1.5 排除标准 ①非RCT试验;②重复发表的文献;③未提供相关结局指标的文献;④综述、动物实验;⑤无法提取数据的文献。
1.2 文献检索策略
计算机检索PubMed、Embase、Cochrane图书馆、维普、中国知网、中国生物医学文献数据库。中文检索词为“阿普斯特”“中重度”“斑块”“银屑病”“随机对照试验”;英文检索词为“Apremilast”“Moderate”“Severe”“Plaque”“Psoriasis”“Randomized controlled trial”;同时手工检索纳入研究的参考文献。检索时限均为各数据库建库起至2018年11月。
1.3 文献筛选、资料提取和质量评价
由两位研究者独立按照纳入与排除标准筛选文献,并交叉核对,若遇分歧则由第三位研究者协助判定。提取资料包括第一作者、发表年份、例数、年龄、干预措施、病程、疗程、结局指标等。根据Cochrane系统评价员手册5.1.0提供的偏倚风险评估工具对纳入的研究进行质量评价,具体包括:随机方法是否正确;是否采用盲法;是否分配隐藏;结局数据是否完整;是否选择性报告研究结果;是否存在其他偏倚来源[9]。
1.4 统计学方法
采用Rev Man 5.3统计软件进行Meta分析。计数资料采用比值比(OR)及其95%置信区间(CI)表示。采用χ2检验和I2检验各研究间的统计学异质性。若各研究间无统计学异质性(P>0.1,I2≤50%),采用固定效应模型进行分析;反之,则采用随机效应模型进行分析。对出现的异质性分析其可能的来源,并进行亚组分析。采用倒漏斗图进行发表偏倚分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果与纳入研究基本信息
初检得到相关文献385篇,通过阅读摘要和标题后得到文献123篇,进一步阅读全文后,最终纳入7篇[10-16]文献,共计2 332例患者,其中试验组1 497例,对照组835例。文献筛选流程见图1;纳入研究基本信息见表1(表中,“a”表示试验1组,“b”表示试验2组)。
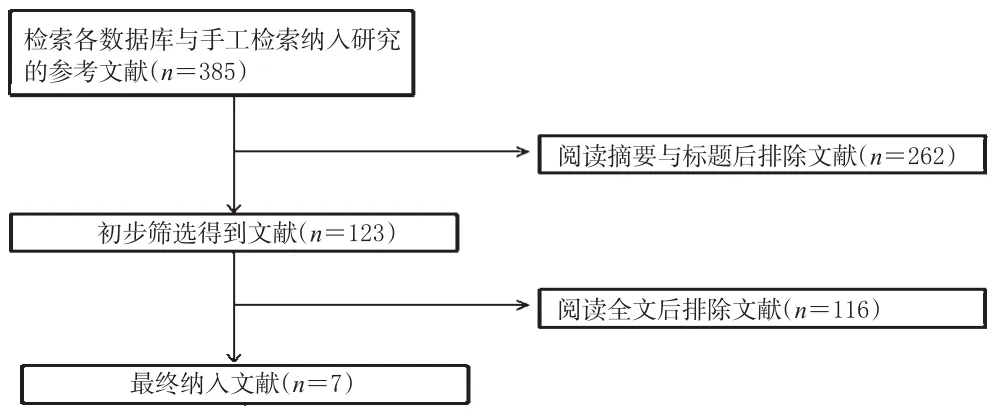
图1 文献筛选流程Fig 1 Literature screening procedure
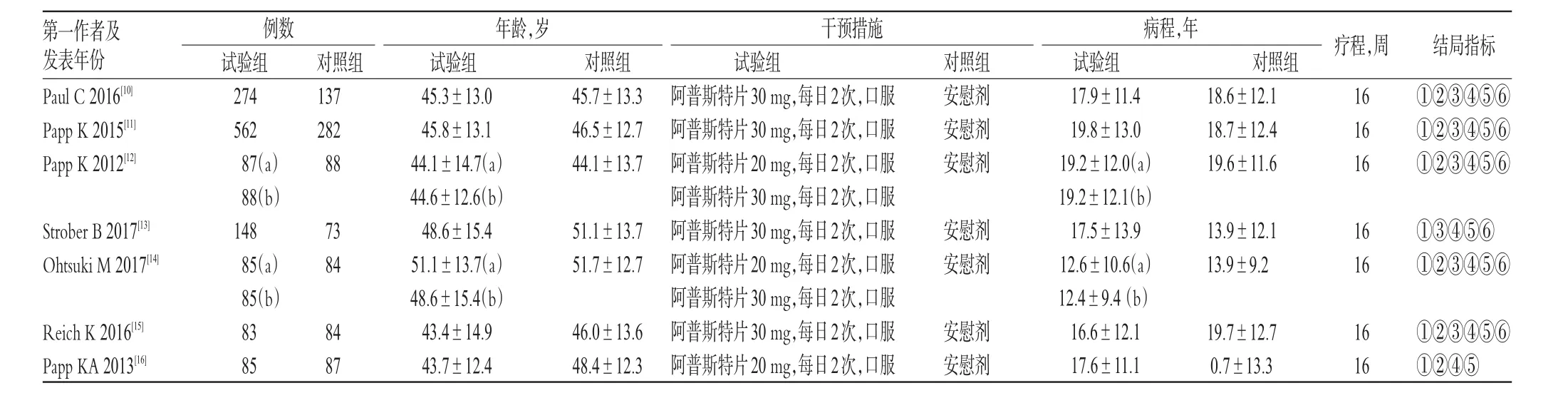
表1 纳入研究基本信息Tab 1 Basic information of included studies
2.2 纳入研究质量评价结果
7项研究[10-16]均为RCT,均为英文文献;4项研究[12-15]描述了具体的随机方法,3项研究[10-11,16]仅描述了采用随机方法;7项研究[10-16]均为双盲,均不清楚是否分配隐藏、选择性报道研究结果、其他偏倚来源,详见图2、图3。
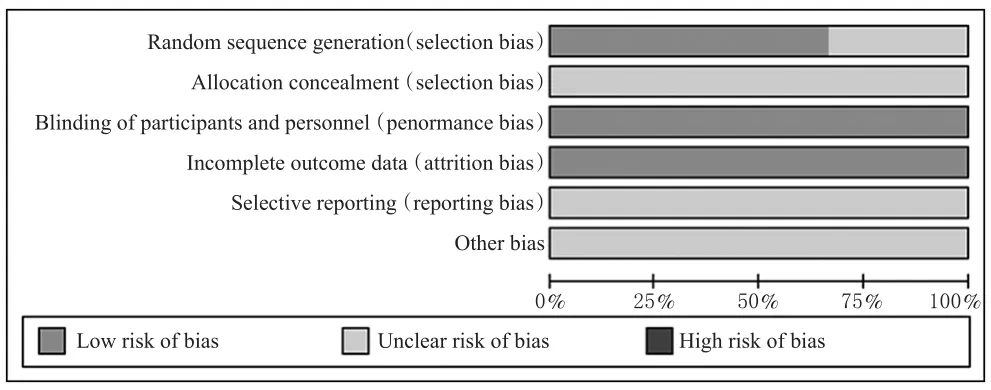
图2 偏倚风险条形图Fig 2 Bar chart of bias risk

图3 偏倚风险图Fig 3 Bias risk chart
2.3 Meta分析结果
2.3.1 PASI 75%例数 7项研究[10-16]均报道了PASI 75%例数,各研究间无统计学异质性(P=0.25,I2=22%),采用固定效应模型进行分析,详见图4。Meta分析结果显示,试验组患者PASI 75%例数显著多于对照组,差异有统计学意义[OR=6.44,95%CI(4.90,8.45),P<0.000 01]。根据试验组用药剂量的不同对比对照组进行亚组分析——①20 mg:3项研究[12,14,16]报道了PASI 75%例数,各研究间无统计学异质性(P=0.33,I2=10%),采用固定效应模型进行分析,详见图5。Meta分析结果显示,试验组患者PASI 75%例数显著多于对照组,差异有统计学意义[OR=4.72,95%CI(2.77,8.05),P<0.000 01]。②30 mg:6项研究[10-15]报道了PASI 75%例数,各研究间无统计学异质性(P=0.27,I2=22%),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,试验组患者PASI 75%例数显著多于对照组,差异有统计学意义[OR=7.05,95%CI(5.13,9.69),P<0.000 01]。
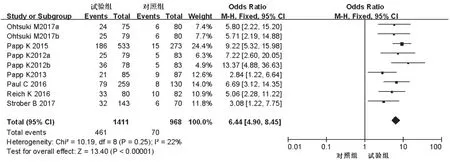
图4 两组患者PASI 75%%例数的Meta分析森林图Fig 4 Forest plot of Meta-analysis for case number of PASI 75%%in 2 groups
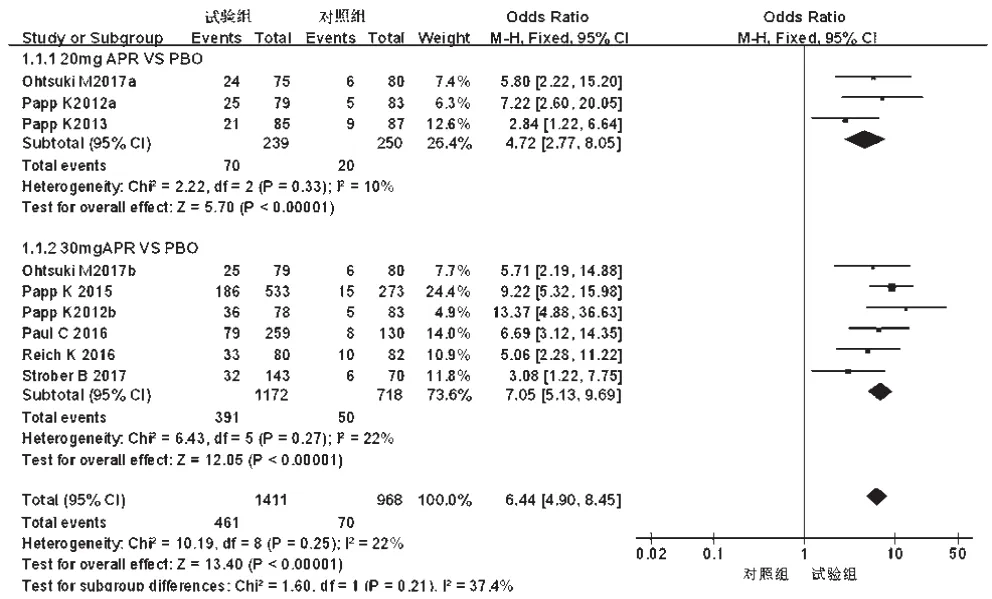
图5 不同剂量亚组PASI 75%%例数的Meta分析森林图Fig 5 Forest plot of Meta-analysis for case number of PASI 75%%in different dose subgroups
2.3.2 PASI 90%例数 6项研究[10-12,14-16]报道了PASI 90%例数,各研究间无统计学异质性(P=0.43,I2=0),采用固定效应模型进行分析,详见图6。Meta分析结果显示,试验组患者PASI 90%例数显著多于对照组,差异有统计学意义[OR=8.13,95%CI(4.65,14.22),P<0.000 01]。根据试验组用药剂量的不同对比对照组进行亚组分析——①20 mg:3 项研究[12,14,16]报道了 PASI 90%例数,各研究间无统计学异质性(P=0.50,I2=0),采用固定效应模型进行分析,详见图7。Meta分析结果显示,试验组患者PASI 90%例数显著多于对照组,差异有统计学意义[OR=4.27,95%CI(1.80,10.09),P=0.001]。②30 mg:5项研究[10-12,14-15]PASI 90%例数,各研究间无统计学异质性(P=0.51,I2=0),采用固定效应模型进行分析,详见图7。Meta分析结果显示,试验组患者PASI 90%例数显著多于对照组,差异有统计学意义[OR=11.11,95%CI(5.27,23.43),P<0.000 01]。
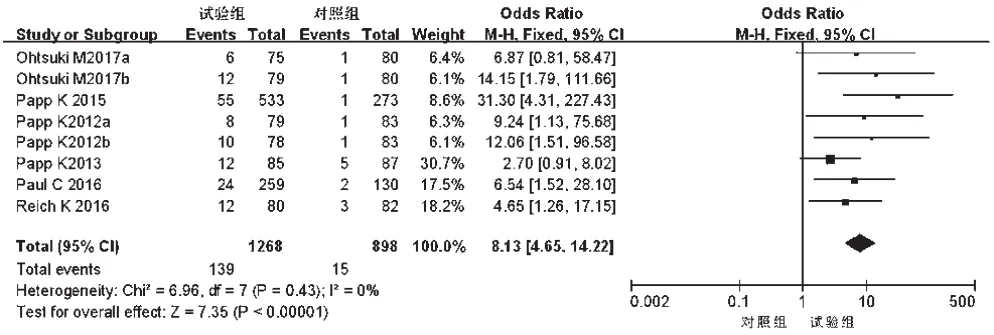
图6 两组患者PASI 90%%例数的Meta分析森林图Fig 6 Forest plot of Meta-analysis for case number of PASI 90%%in 2 groups
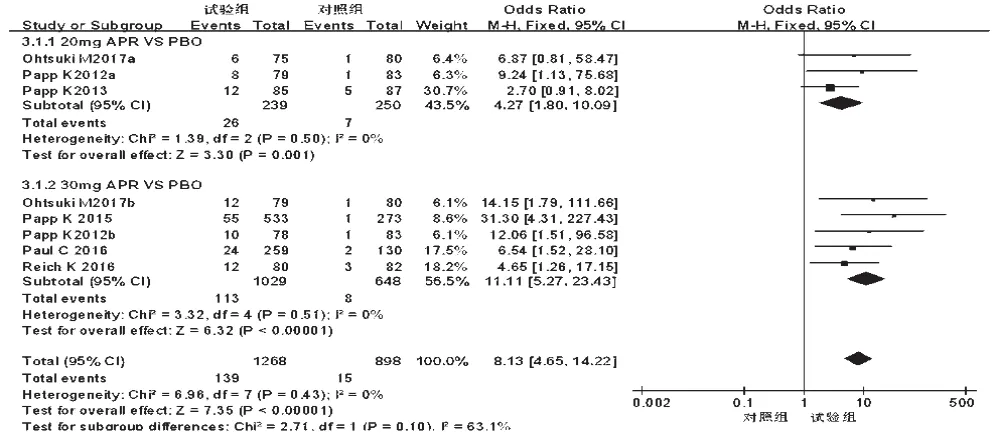
图7 不同剂量亚组PASI 90%%例数的Meta分析森林图Fig 7 Forest plot of Meta-analysis for case number of PASI 90%%in different dose subgroups
2.3.3 sPGA 0或1例数 6项研究[10-15]报道了sPGA 0或1例数,各研究间无统计学异质性(P=0.82,I2=0),采用固定效应模型进行分析,详见图8。Meta分析结果显示,试验组患者sPGA 0或1例数显著多于对照组,差异有统计学意义[OR=3.89,95%CI(3.00,5.05),P<0.000 01]。根据试验组用药剂量的不同对比对照组进行亚组分析——①20 mg:2项研究[12,14]报道了sPGA 0或1例数,各研究间无统计学异质性(P=0.52,I2=0),采用固定效应模型进行分析,详见图9。Meta分析结果显示,试验组患者sPGA 0或1例数显著多于对照组,差异有统计学意义[OR=2.82,95%CI(1.51,5.26),P=0.001]。②30 mg:6项研究[10-15]报道了sPGA 0或1例数,各研究间无统计学异质性(P=0.84,I2=0),采用固定效应模型进行分析,详见图9。Meta分析结果显示,试验组患者sPGA 0或1例数显著多于对照组,差异有统计学意义[OR=4.13,95%CI(3.10,5.50),P<0.000 01]。
2.3.4 不良反应 7项研究[10-16]均报道了不良反应发生率,各研究间无统计学异质性(P=0.06,I2=46%),采用随机效应模型进行分析,详见图10。Meta分析结果显示,试验组患者不良反应发生率显著高于对照组,差异有统计学意义[OR=1.87,95%CI(1.44,2.43),P<0.000 01]。根据试验组用药剂量的不同对比对照组进行亚组分析——①20 mg:3项研究[12,14,16]报道了不良反应发生率,各研究间有统计学异质性(P=0.02,I2=73%),采用随机效应模型进行分析,详见图11。Meta分析结果显示,两组患者不良反应发生率比较,差异无统计学意义[OR=1.69,95%CI(0.80,3.57),P=0.17];②30 mg:6项研究[10-15]报道了不良反应发生率,各研究间无统计学异质性(P=0.24,I2=26%),采用固定效应模型进行分析,详见图11。Meta分析结果显示,试验组患者不良反应发生率显著高于对照组,差异有统计学意义[OR=1.94,95%CI(1.51,2.49),P<0.000 01]。
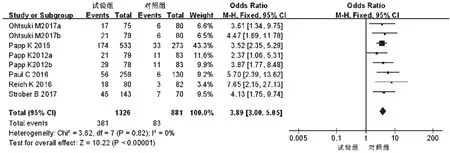
图8 两组患者sPGA 0或1例数的Meta分析森林图Fig 8 Forest plot of Meta-analysis for case number of sPGA0 or 1 in 2 groups

图9 不同剂量亚组sPGA 0或1例数的Meta分析森林图Fig 9 Forest plot of Meta-analysis for case number of sPGA0 or 1 in different dose subgroups
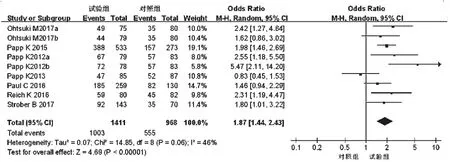
图10 两组患者不良反应发生率的Meta分析森林图Fig 10 Forest plot of Meta-analysis of the incidence of ADR in 2 groups
2.3.5 严重不良反应 7项研究[10-16]均报道了严重不良反应发生率,各研究间无统计学异质性(P=0.56,I2=0),采用固定效应模型进行分析,详见图12。Meta分析结果显示,两组患者严重不良反应发生率比较,差异无统计学意义[OR=1.27,95%CI(0.77,2.07),P=0.35]。根据试验组用药剂量的不同对比对照组进行亚组分析——①20 mg:3项研究[12,14,16]报道了严重不良反应发生率,各研究间无统计学异质性(P=0.13,I2=50%),采用固定效应模型进行分析,详见图13。Meta分析结果显示,两组患者严重不良反应发生率比较,差异无统计学意义[OR=1.21,95%CI(0.42,3.48),P=0.72]。②30 mg:6项研究[10-15]报道了严重不良反应发生率,各研究间无统计学异质性(P=0.77,I2=0),采用固定效应模型进行分析,详见图13。Meta分析结果显示,两组患者严重不良反应发生率比较,差异无统计学意义[OR=1.28,95%CI(0.73,2.24),P=0.38]。
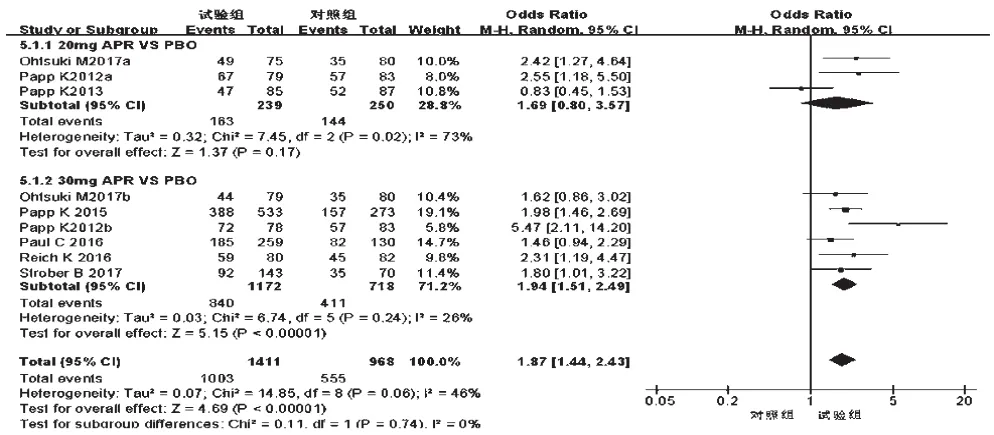
图11 不同剂量亚组不良反应发生率的Meta分析森林图Fig 11 Forest plot of Meta-analysis of the incidence of ADR in different dose subgroups
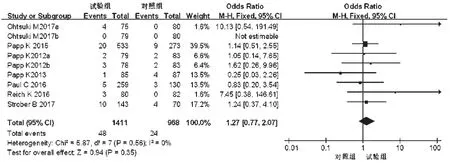
图12 两组患者严重不良反应发生率的Meta分析森林图Fig 12 Forest plot of Meta-analysis of the incidence of seriousADR in 2 groups
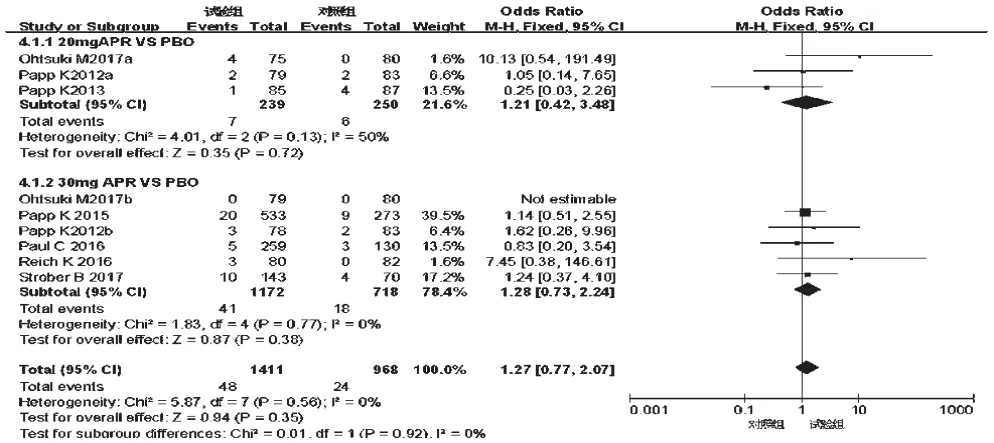
图13 不同剂量亚组严重不良反应发生率的Meta分析森林图Fig 13 Forest plot of Meta-analysis of the incidence of seriousADR in different dose subgroups
2.3.6 不良反应导致退出情况 6项研究[10-15]报道了不良反应导致退出情况,各研究间无统计学异质性(P=0.98,I2=0),采用固定效应模型进行分析,详见图14。Meta分析结果显示,两组患者不良反应导致退出例数比较,差异无统计学意义[OR=1.48,95%CI(1.00,2.20),P=0.05]。根据试验组用药剂量的不同对比对照组进行亚组分析——①20 mg:2项研究[12,14]报道了严重不良反应导致退出情况,各研究间无统计学异质性(P=0.91,I2=0),采用固定效应模型进行分析,详见图15。Meta分析结果显示,两组患者不良反应导致退出例数比较,差异无统计学意义[OR=1.61,95%CI(0.68,3.82),P=0.28]。②30 mg:6项研究[10-15]报道了不良反应导致退出情况,各研究间无统计学异质性(P=0.90,I2=0),采用固定效应模型进行Meta分析,详见图15。Meta分析结果显示,两组患者不良反应导致退出例数比较,差异无统计学意义[OR=1.45,95%CI(0.93,2.26),P=0.10]。
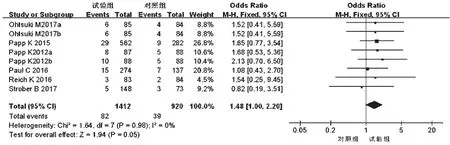
图14 两组患者不良反应导致退出例数的Meta分析森林图Fig 14 Forest plot of Meta-analysis for case number of ADR leading to drug withdrawal in 2 groups
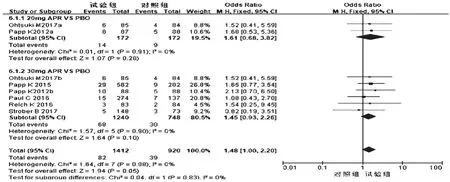
图15 不同剂量亚组不良反应导致退出例数的Meta分析森林图Fig 15 Forest plot of Meta-analysis for case number of ADR leading to drug withdrawal in different dose subgroups
2.4 发表偏倚分析
以PASI 75%例数和PASI 90%例数为指标绘制倒漏斗图,详见图16、图17。由图16、图17可知,各散点均分布在倒漏斗图范围内,倒漏斗图呈一定的偏态分布,提示本研究存在发表偏倚的可能性较大。
3 讨论
银屑病是一种与免疫系统、自身基因、多种环境因素有关的炎症反应,涉及单核细胞、树突状细胞和T细胞,这些细胞共同造成角质形成细胞的异常增殖[17]。该症的传统治疗药物有糖皮质激素、甲氨蝶呤、环孢素、非类固醇类抗炎药等[18]。当传统药物治疗效果欠佳时,寻找新的治疗方案对于提高银屑病患者的生活质量具有重要意义。PDE-4抑制剂可通过降解cAMP来抑制促炎因子IL-2、IFN-γ和TNF-α以及外周单核细胞和T细胞产生,已用于银屑病的治疗[5]。阿普斯特为口服的PDE-4抑制剂,可减轻银屑病斑块的组织病变程度,减少表皮的厚度[15]。
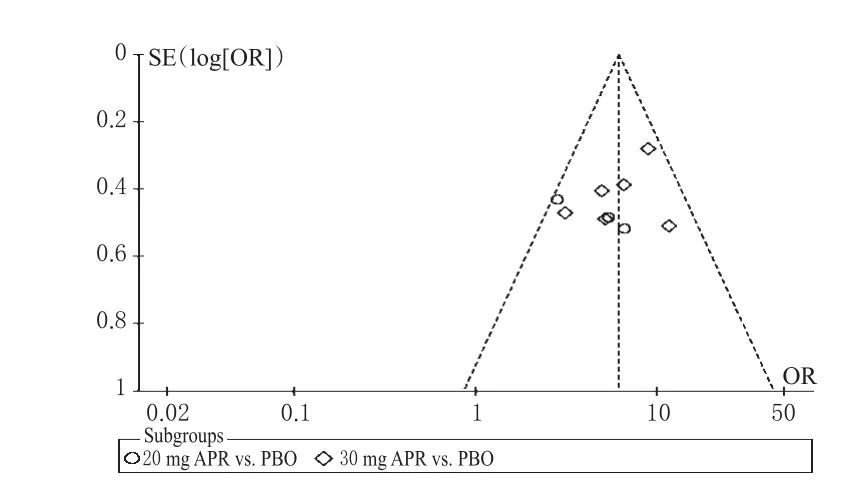
图16 PASI 75%%例数的倒漏斗图Fig 16 Inverted funnel plot of case numberof PASI 75%%
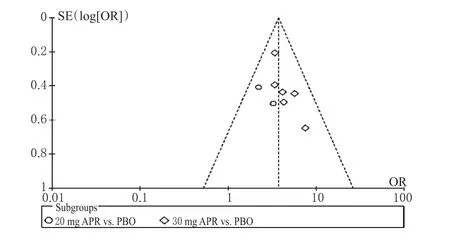
图17 PASI 90%%例数的倒漏斗图Fig 17 Inverted funnel plot of case numberof PASI 90%%
本研究结果显示,试验组患者PASI 75%、PASI 90%和sPGA 0或1例数均显著高于对照组,且随着用药剂量的增加,达到PASI 75%例数也随之增加,提示阿普斯特治疗中重度斑块状银屑病的效果较好,且呈剂量依赖性。阿普斯特的不良反应主要为头痛、鼻咽炎、腹泻、恶心,但均为轻中度。本研究结果还显示,试验组患者使用20 mg阿普斯特时的不良反应发生率与对照组相当,30 mg时的不良反应发生率显著高于对照组,这提示随着用药剂量的增加,其不良反应发生率也随之增加。此外,虽然两组患者严重不良反应发生率和不良反应导致退出例数比较差异均无统计学意义,但在使用阿普斯特时仍要注意不良反应的发生。有研究发现,阿普斯特可增加部分患者的自杀风险[19]。因此在使用前,应评估患者的精神状态,若使用时如果出现新的精神症状、自杀企图、自杀意念或精神疾病恶化,应立即停药。
综上所述,阿普斯特治疗中重度斑块状银屑病的疗效较好,且呈剂量依赖性;该药可提高患者的生活质量,但可能会增加其不良反应发生的风险。本研究的局限性为:本研究纳入的样本量较小,结局指标较少,可能会对研究结果产生影响,故此结论尚有待大样本、高质量的RCT进一步验证。
