番石榴叶总黄酮对2型糖尿病模型小鼠肝糖异生ERRγ/CREBH信号通路相关因子的影响Δ
2019-05-31王宏傅予王蕾江茜刘洪斌
王宏,傅予,王蕾,江茜,刘洪斌
(天津市医药科学研究所,天津300020)
番石榴叶为桃金娘科植物番石榴(Psidium guajavaL.)的叶,具有生津止渴、甘平养胃、涩敛固阴的功效[1]。据文献报道,番石榴叶提取物具有降糖的作用[2-3]。本课题组前期研究结果显示,番石榴叶总黄酮(GLTF)的降糖机制与抑制肝糖异生有关[4]。雌激素相关受体(ERRs)因与雌激素受体在DNA结合域和配体结合域上具有68%的同源性而得名,包括ERRα、ERRβ、ERRγ等3种亚型[5]。研究证明,ERRγ是肝糖异生过程的重要转录调节子[6-7]。过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC1α)是一种核受体辅助激活因子,其作为ERRγ的共激活因子,能调控多条代谢途径中基因的表达;在空腹状态下,PGC1α在肝脏中的表达明显增多且在糖异生过程中发挥了关键调控作用[8]。环磷酸腺苷应答元件结合蛋白H(CREBH)是一种肝脏特有的内质网结合转录因子,在调节肝糖异生方面起着重要作用[9-10]。CREB调节转录辅激活因子2(TORC2)作为CREB的辅激活因子,其去磷酸化入核是激活CREB的基础[11]。鉴于ERRγ和CREBH对肝糖异生的重要调控作用[6-7,10],本研究利用高糖高脂饲料喂养联合多次腹腔注射小剂量链脲佐菌素(STZ)的方法复制2型糖尿病(T2DM)小鼠模型,并通过考察GLTF对小鼠肝脏中ERRγ/CREBH信号通路中上述相关因子表达的影响来探讨其降糖作用的具体机制,旨在为其应用于临床降血糖治疗提供更科学的依据。
1 材料
1.1 仪器
悦准Ⅰ型710血糖仪(江苏鱼跃医疗设备股份有限公司);GFM-96M γ型放射免疫计数器(合肥众诚机电技术开发有限责任公司);Ci-L型光学显微镜(日本Nikon公司);TS-8型转移脱色摇床、QL-902型涡旋振荡仪(海门市其林贝尔仪器制造公司);5418R型低温高速离心机(德国Eppendorf公司);Mini-PROTEAN Tetra型电泳仪、DYCZ-20C型垂直电泳槽、DYCP-40C型转移槽(北京六一仪器厂);7500型荧光定量聚合酶链式反应(PCR)仪(美国ABI公司);ME203E型电子分析天平(上海梅特勒-托利多仪器有限公司);VILBER Fusion FX7型成像系统(法国Vilber Lourmat公司)。
1.2 药品与试剂
GLTF浸膏[由天津市医药科学研究所制剂中心制备,每3.5 kg原药材制得700 g浸膏[12];所用番石榴叶(天津市三潭医院提供,批号:13220042)经天津中医药大学中药学院马琳教授鉴定为桃金娘科番石榴属植物番石榴(P.guajavaL.)的干燥叶];盐酸二甲双胍片(中美上海施贵宝制药有限公司,批号:AAL7649,规格:0.5 g/片);消渴降糖胶囊(洛阳天生药业有限责任公司,批号:160902,规格:0.3 g/粒);STZ试剂(美国Sigma-Aldrich公司,批号:S0130,规格:500 mg);胰岛素定量检测试剂盒(北京北方生物技术研究所);兔ERRγ多克隆抗体、兔CREBH多克隆抗体、鼠磷酸甘油醛脱氢酶(GAPDH)单克隆抗体、辣根过氧化物酶标记羊抗兔IgG二抗(北京博奥森生物技术有限公司);PVDF膜(美国Millipore公司);超纯RNA提取试剂、反转录试剂盒、实时PCR试剂盒、5×RNA Loading buffer(日本Takara公司);其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 引物
PGC1α、TORC2和GAPDH引物均由天津宏升尔特生物科技有限公司设计、合成,其序列见表1。
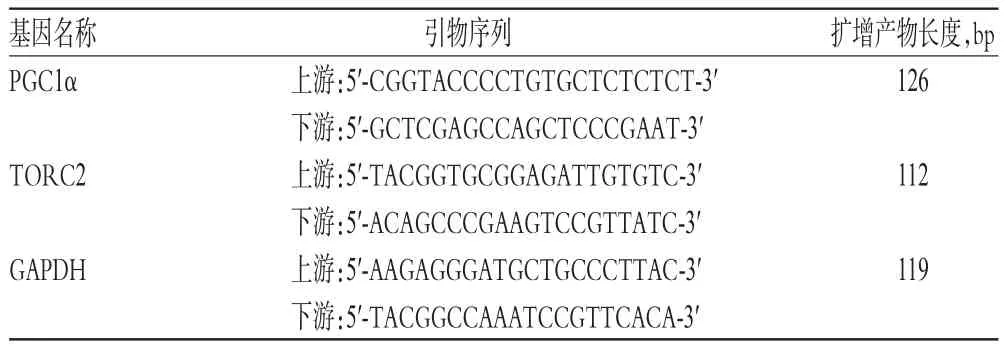
表1 引物序列Tab 1 Primer sequence
1.4 动物
SPF级健康雄性ICR小鼠90只,体质量为16~18 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006。小鼠按6只/笼饲养于温度20~25℃、湿度40%~70%的屏障环境中。所用基础饲料和高糖高脂饲料均购自北京科澳协力饲料有限公司,其中高糖高脂饲料为基础饲料加20%蔗糖、15%猪油、2%胆固醇和0.3%胆盐。
2 方法
2.1 分组、造模与给药
所有小鼠给予基础饲料适应性喂养1周后,按体质量随机选取12只小鼠为正常组,其余小鼠纳入造模组。正常组小鼠继续给予基础饲料;造模组小鼠改用高糖高脂饲料继续喂养4周,然后禁食不禁水24 h,腹腔注射STZ溶液(100 mg/kg,以柠檬酸缓冲液为溶剂配制)qd,共注射2~3次。期间小鼠断尾取血检测血糖水平,以空腹血糖>11.1 mmol/L视为T2DM模型成功建立[13],停止注射。
取造模成功、状态良好的小鼠60只,按空腹血糖值随机分为模型组、二甲双胍组(即Met组,0.17 g/kg;剂量根据临床人用剂量以体表面积法换算而得)、消渴降糖胶囊组(即XKJT组,0.75 g/kg;剂量换算方法同Met组)和GLTF低、高剂量组(即GLTF-L组、GLTF-H组,剂量分别为0.047、0.094 g/kg,以浸膏质量计;剂量根据预实验结果设定),每组12只。各组药物溶液均以水为溶剂配制,现配现用,用前摇匀。除正常组和模型组小鼠灌胃等体积水外,其余各组小鼠均灌胃相应药物溶液,给药体积均为10 mL/kg,qd,连续21 d。给药期间除正常组外,其余小鼠继续给予高糖高脂饲料。
2.2 小鼠空腹血糖和胰岛素水平检测
末次给药后第2天,各组小鼠于禁食不禁水5 h后,断尾取血检测空腹血糖水平;然后摘取其眼球取血,采用放射免疫法检测空腹血清胰岛素水平,并按公式计算胰岛素敏感指数(ISI):ISI=lg[1/(空腹血糖×空腹血清胰岛素水平)]。
2.3 小鼠肝和胰腺组织的病理学检查
小鼠取眼球后处死,剖取其胰腺和一叶肝脏组织,置于10%甲醛溶液中固定48 h以上,脱水,石蜡包埋,切片(厚度为4 μm),然后进行苏木精-伊红(HE)染色,在显微镜下观察两者组织病理学变化。
2.4 小鼠肝组织中ERRγ、CREBH蛋白表达水平检测
采用免疫印迹法进行检测。正常组、模型组和GLTF各剂量组各取6只小鼠的部分肝组织切成小块,加入蛋白裂解液裂解细胞,提取总蛋白,以考马斯亮蓝法进行蛋白定量。所得蛋白进行SDS-PAGE凝胶分离后,以半干法转移到PVDF膜上,用5%脱脂奶粉室温封闭1 h,分别加入ERRγ抗体(1∶500)、CREBH抗体(1∶500)、内参GAPDH抗体(1∶1 000),于4℃摇床孵育过夜;次日用1×TBST洗膜10 min×3次,然后加入二抗(1∶3 000),于室温下避光摇床孵育60 min;1×TBST洗膜10 min×3次后,曝光及洗片。采用成像系统进行检测,采用Image J 1.42q软件分析灰度值,以ERRγ、CREBH蛋白条带与GAPDH条带的灰度值之比以表示目标蛋白的表达水平。
2.5 小鼠肝组织中PGC1α和TORC2 mRNA表达水平检测
采用实时定量PCR法进行检测。正常组、模型组和GLTF各剂量组各取6只小鼠的部分肝组织,采用超纯RNA提取试剂提取总RNA,并采用反转录试剂盒制得cDNA。采用荧光定量PCR仪进行PCR反应。反应体系:Mix 12.5 μL,上、下游引物终浓度均为10 μmol/L,cDNA 2 μL,用ddH2O补足至20 μL。反应条件:95 ℃变性30 s;95℃退火30 s,60℃延伸34 s,共40个循环。采用2-ΔΔCt法[14],以GAPDH为内参,检测各组小鼠PGC1α、TORC2的mRNA表达水平。
2.6 统计学方法
采用SPSS17.0软件对数据进行统计分析。计量资料以x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 各组小鼠的空腹血糖、血清胰岛素水平及ISI值
与正常组比较,模型组小鼠的空腹血糖、血清胰岛素水平均显著升高,ISI值显著降低,差异均有统计学意义(P<0.01);与模型组比较,各给药组小鼠的空腹血糖和血清胰岛素水平均显著降低,ISI均显著升高,差异均有统计学意义(P<0.05或P<0.01)。各组小鼠的空腹血糖、血清胰岛素水平及ISI值见表2。
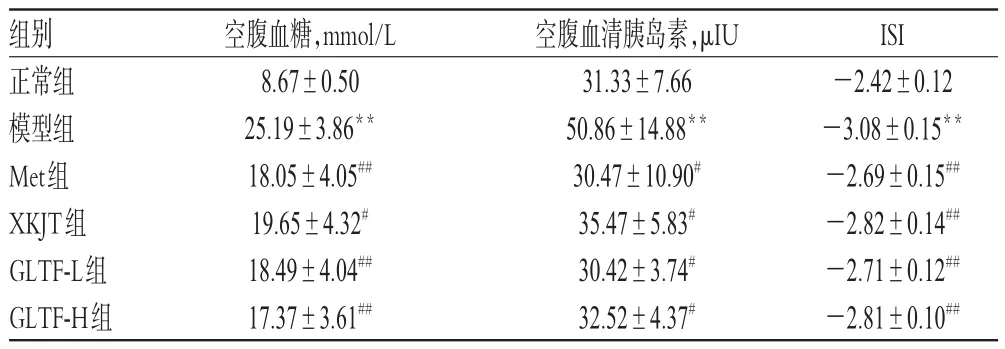
表2 各组小鼠的空腹血糖、血清胰岛素水平及ISI值(x±s,n=12)Tab 2 Fasting glucose,serum insulin and ISI value of mice in each group(x±s,n=12)
3.2 各组小鼠肝脏和胰腺组织病理学变化
3.2.1 肝组织 正常组小鼠肝小叶结构完整,肝细胞未见变性或坏死,汇管区血管及胆管未见异常,间质未见结缔组织增生,肝中央小静脉、肝小动/静脉及胆管系统均未见明显变化;模型组小鼠肝小叶结构轮廓不清,肝细胞重度肿胀、增大并呈浊状改变,可见大量空泡;各给药组小鼠肝小叶结构和肝细胞肿胀及空白变性程度均较模型组有所减轻,其中GLTF-H组改善效果较为明显。各组小鼠肝组织病理学显微图见图1。3.2.2 胰腺组织 正常组小鼠胰腺各小叶胰岛细胞未见明显变化;模型组小鼠胰岛数目减少、体积变小,胰岛细胞呈轻度空泡病变;各给药组小鼠胰腺胰岛数较模型组均有所增加,体积均有所增大。各组小鼠胰腺组织病理学显微图见图2。
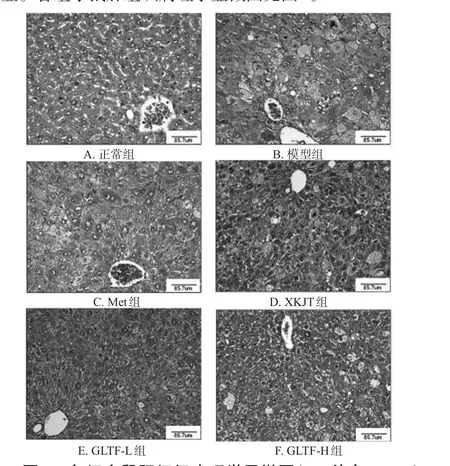
图1 各组小鼠肝组织病理学显微图(HE染色,×100)Fig 1 Pathological micrographs of liver tissue of mice in each group(HE staining,×100)
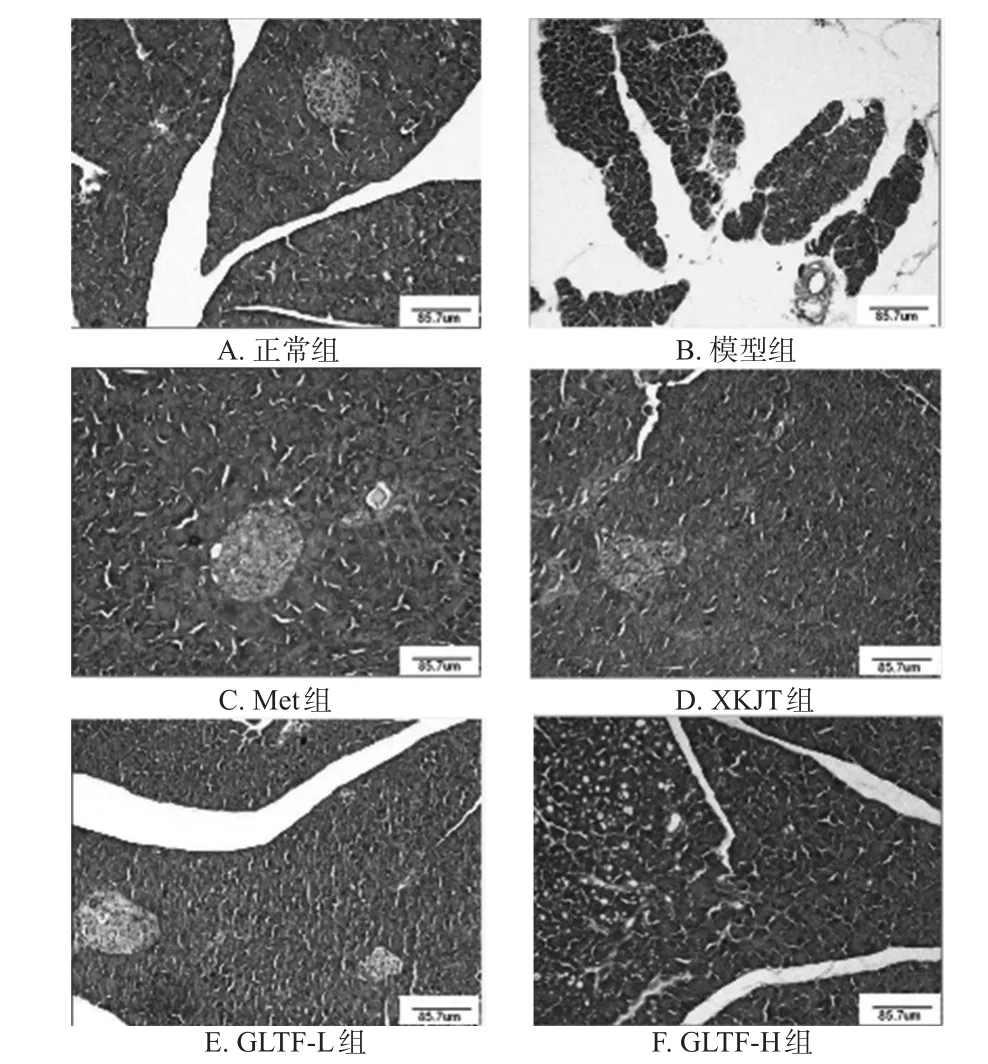
图2 各组小鼠胰腺组织病理学显微图(HE染色,×100)Fig 2 Pathological micrographs of pancreatic tissue of mice in each group(HE staining,×100)
3.3 各组小鼠肝组织中ERRγ和CREBH的蛋白表达水平
与正常组比较,模型组小鼠肝组织中ERRγ、CREBH的蛋白表达水平均显著升高,差异均有统计学意义(P<0.01);与模型组比较,GLTF各剂量组小鼠肝组织中ERRγ、CREBH的蛋白表达水平均显著降低,差异均有统计学意义(P<0.05或P<0.01)。各组小鼠肝组织中ERRγ、CREBH的蛋白电泳图见图3,蛋白表达水平见图4。
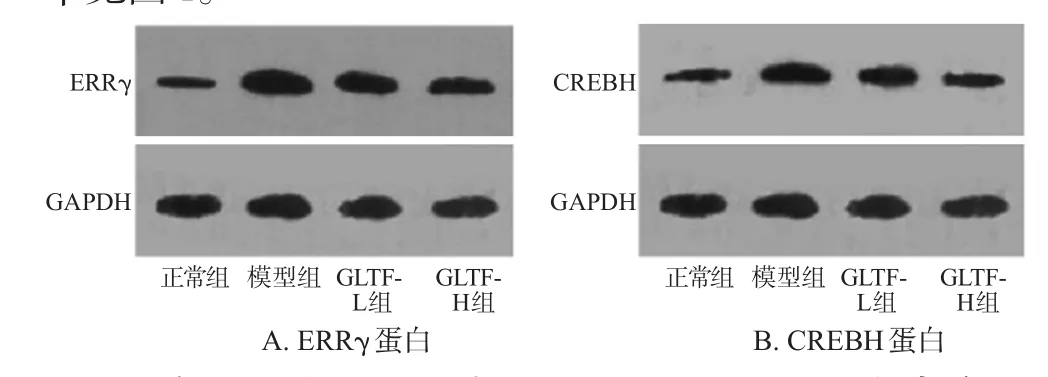
图3 各组小鼠肝组织中ERRγ和CREBH蛋白电泳图Fig 3 Electrophoregrams of ERRγ and CREBH protein in liver tissue of mice in each group
3.4 各组小鼠肝组织中PGC1α、TORC2的mRNA表达水平
与正常组比较,模型组小鼠肝组织中PGC1α、TORC2的mRNA表达水平均显著升高,差异均有统计学意义(P<0.01);与模型组比较,GLTF各剂量组小鼠肝组织中PGC1α、TORC2的mRNA水平均显著降低,差异均有统计学意义(P<0.05或P<0.01)。各组小鼠PGC1α、TORC2的mRNA表达水平见图5。
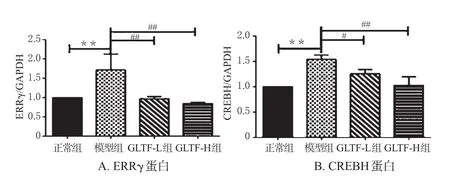
图4 各组小鼠肝组织中ERRγ和CREBH的蛋白表达水平(x±s,n=6)Fig 4 Protein expression levels of ERRγ and CREBH in liver tissue of mice in each group(x±s,n=6)
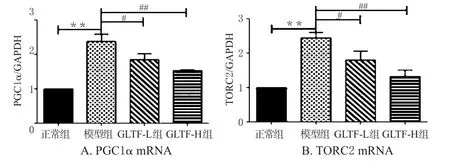
图5 各组小鼠肝组织中PGC1α和TORC2的mRNA表达水平(x±s,n=6)Fig 5 mRNA expression levels of PGC1α and TORC2 in liver tissue of mice in each group(x±s,n=6)
4 讨论
T2DM患者占糖尿病总发病人数的95%以上,且易发生心脑血管疾病等严重并发症[15-16]。因此,有效控制T2DM患者的血糖水平具有重要意义。肝糖异生异常导致的葡萄糖生成及输出增多是糖尿病发病的重要病理因素。有效抑制肝脏过度糖异生,探求肝脏糖异生的分子机制以及寻找抑制肝脏过度糖异生的有效靶点,将成为治疗糖尿病的重要途径[17]。本课题组前期研究发现,GLTF能显著降低肝糖异生限速酶磷酸烯醇式丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G-6-Pase)的mRNA表达水平[4],提示其降糖作用与抑制肝糖异生有关。本研究在前期工作的基础上,探讨了GLTF通过ERRγ/CREBH信号通路调控肝糖异生的具体机制。
二甲双胍是临床用于治疗T2DM的经典药物,降糖效果显著,且其降糖机制与抑制肝脏糖异生有关[18-19];消渴降糖胶囊是以番石榴叶为主要成分之一的中成药,临床上降糖效果明确[20],与GLTF有一定同源性。因此本研究选择这两种药品作为阳性对照药。
当机体发生糖尿病时,肝细胞处于内质网应激状态,ERRγ被激活,并在共激活因子PGC1α的参与下,通过雌激素受体反应元件结合到CREBH启动子上[21],CREBH再通过TORC2依赖模式被激活[22],最终调控肝糖异生的两个限速酶——PEPCK和G-6-Pase[9]——进而决定肝糖异生的速度和量。本研究结果显示,与正常组比较,模型组小鼠空腹血糖和胰岛素水平均显著升高,ISI值显著降低;肝组织病变明显、可见大量空泡;胰岛数目减少、体积变小,胰岛细胞呈轻度空泡病变。与模型组比较,GLTF各剂量组小鼠上述指标和病理学变化均明显改善,表明GLTF能显著改善T2DM模型小鼠的血糖、胰岛素水平,对肝细胞和胰岛细胞均有一定保护作用。免疫印迹法和实时定量PCR法检测结果显示,与正常组比较,模型小鼠肝组织中ERRγ、CREBH的蛋白表达水平及PGC1α、TORC2的mRNA表达水平均显著升高,提示T2DM模型小鼠肝脏ERRγ/CREBH信号通路被激活。与模型组比较,GLTF各剂量组小鼠肝组织中上述因子的蛋白或mRNA表达水平均显著降低,提示GLTF可能通过抑制ERRγ/CREBH信号通路来抑制肝脏糖异生,从而发挥降糖作用。
综上所述,GLTF能降低T2DM模型小鼠的空腹血糖及胰岛素水平、提高ISI值,并能减轻肝组织病变程度,恢复胰腺组织中胰岛数目和体积;能下调肝组织中ERRγ、CREBH的蛋白表达及PGC1α、TORC2的mRNA表达。这提示GLTF对T2DM模型小鼠的降糖作用机制可能与抑制肝脏ERRγ/CREBH信号通路有关。
