替唑尼特对脂多糖诱导RAW264.7细胞氧化应激及炎症因子的影响
2019-05-31首姣琴程晓蕾王霄旸薛飞群刘迎春费陈忠张丽芳张可煜
首姣琴,程晓蕾,王霄旸,薛飞群,王 米,刘迎春,费陈忠,张丽芳,张可煜,李 娟
(1.湘潭大学化学学院,湘潭411100;2.中国农业科学院上海兽医研究所 农业农村部兽用化学药物及制剂学重点实验室,上海 200241)
硝唑尼特(NTZ)是一种硝基噻唑酰胺化合物,其化学名为2-乙酰氧基-(5-硝基-2-噻唑)苯甲酰胺。1984年首次报道用于抗人体无钩绦虫和微小膜壳绦虫[1]。2002年11月被美国FDA批准为第一个专门用来治疗隐孢子虫感染的药物,并以商品名为Alinia投放市场[2]。硝唑尼特是一种前药,该药进入血浆后迅速被代谢成具有活性的替唑尼特(TIZ)[3]。多年来,研究发现硝唑尼特和/或替唑尼特能有效防治许多肠道寄生虫,如鞭毛虫[4]、内阿米巴[5]、利什曼原虫[6],且对多种细菌和病毒感染也有效,如幽门螺旋杆菌、难辨梭状芽胞杆菌[7]、乙型肝炎病毒、丙型肝炎病毒等;甚至还发现硝唑尼特对某些肿瘤细胞的抑制作用[8]。由此可见,硝唑尼特/替唑尼特生物学功能众多。
细胞内活性氧自由基(ROS)是一类包含有氧自由基和H2O2的总称,是细胞进行有氧呼吸和代谢的副产物,其产生的主要场所是线粒体[9]。巨噬细胞以模式识别方式结合、捕获、吞噬和杀伤细菌等病原体后,巨噬细胞内ROS迅速增加,以产生强氧化性物质参与杀伤病原体[10-11]。细胞中的抗氧化物质和酶系统也维持正常的细胞内环境,使其保持正常的功能。如果机体ROS产生和抗氧化失去平衡,就会引起各种退行性的疾病,如衰老、化学损伤、动脉粥样硬化、癌症、糖尿病以及各种炎症性疾病[12]。硝唑尼特/替唑尼特对多种病原体具有很好的疗效,但对细胞氧化应激和炎症因子的影响研究尚未见报道。鉴于此,本研究用LPS刺激大鼠单核巨噬细胞系(RAW264.7细胞),观察替唑尼特对LPS诱导氧化应激和炎性因子分泌的影响,旨在进一步发掘替唑尼特可能的抗氧化、抗炎作用,为其应用于感染性疾病的治疗提供更多依据。
1 材料与方法
1.1 受试物与细胞系 替唑尼特,由上海兽医研究所兽用抗感染药物创新团队合成,含量>98%。替唑尼特(100 mmol/L)用二甲基亚砜(DMSO)溶解并使用有机相滤器(0.22 μm)过滤除菌,-20℃分装避光保存,临用前用DMEM培养基稀释至工作浓度;LPS溶解于PBS溶液中配制成储备液(1 mg/mL),临用前用DMEM培养基稀释至工作浓度(1 μg/mL)。小鼠单核巨噬细胞系RAW264.7细胞来源于中国科学院上海生科院细胞资源中心。
1.2 试剂 二甲基亚砜(DMSO)购于Sigma公司;DMEM培养、胎牛血清购于Gibco公司;丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、总谷胱甘肽(T-GSH)/氧化型谷胱甘肽(GSSG)测定试剂盒,均购于南京建成生物工程研究所;ROS、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)检测试剂盒、BCA蛋白浓度检测试剂盒和RIPA裂解液均购自碧云天生物技术研究所;IL-6 ELISA检测试剂盒,购自R & D公司;COX-2 和β-actin抗体购于CST公司;HRP标记羊抗鼠(兔)IgG购于Abcam公司。其他试剂全部为分析纯。
1.3 MTT法检测细胞活性 将生长良好的细胞以1×105个/mL密度接种于96孔板,每孔100 μL,置于37℃、5% CO2培养箱中培养过夜,加入脂多糖和不同浓度的替唑尼特,每组设5个重复孔,继续培养20 h后,吸弃原培养液,每孔加入MTT,继续培养4 h,弃培养基并向每孔中加入150 μL DMSO,置于摇床上震荡混匀,使结晶完全溶解,读取OD570,计算细胞活性。
1.4 细胞内ROS水平检测 细胞以3×105个/mL的密度均匀接种于放置有盖玻片的6孔板中,细胞贴壁12 h后随机分为溶剂对照组(V组,含0.1 %的DMSO)、脂多糖模型组(LPS组,含LPS 1 μg/mL)和替唑尼特处理组(含1 μg/mL LPS和25、50、75、100 μmol/L替唑尼特)培养6 h。按照1∶1000的比例用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。去除细胞培养液,加入适当体积稀释好的DCFH-DA,每孔不少于1 mL。37℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA后将盖玻片置于荧光显微镜下观察,任选三个视野拍照,并用Image J图像分析软件包分析平均荧光强度。
1.5 细胞内MDA检测 利用MDA与硫代巴比妥酸反应产生红色产物的原理,检测细胞中MDA的含量。细胞经1.4项相同处理培养24 h后,以1×107个细胞加入100 μL RIPA裂解液的比例冰上裂解细胞10 min,随后4℃、12 000×g离心10 min,收集细胞上清液,采用BCA蛋白定量法测定蛋白浓度。严格按照MDA检测试剂盒的说明书步骤检测细胞裂解液中MDA的含量,用紫外分光光度计在532 nm检测吸光度,根据标准品浓度计算各样品中MDA含量并用各样品的蛋白浓度进行标准化。
1.6 GSH含量的检测 按照1.5项所述方法收集细胞裂解液,收集样本后必须尽快用试剂四处理防止谷胱甘肽代谢,经试剂四处理后的样本置于-20℃保存。利用DTNB的循环反应,按照试剂盒说明书在酶标仪(405 nm)读取吸光度值计算出还原型谷胱甘肽的含量。还原型谷胱甘肽(GSH)含量=T-GSH含量-2×GSSG含量。
1.7 抗氧化酶SOD、CAT和GSH-Px的检测 按照1.5项所述方法收集细胞裂解液,用BCA法定量蛋白,尽量当天检测,如需过夜于-80℃保存。严格按照试剂盒说明书黄嘌呤氧化酶还原法(450 nm)检测SOD活性,钼酸铵终止法(520 nm)检测CAT活性,二硫代二硝基苯甲酸法(412 nm)检测GSH-Px活性。
1.8 ELISA检测IL-6 细胞平铺在24孔平底细胞培养板中(2×105个/孔),待细胞生长至汇集度约80%,加入LPS和替唑尼特并孵育24 h。将细胞培养液10 000×g离心5 min并收集上清。参照ELISA试剂盒操作手册,进行细胞因子的含量测定,读取波长为450 nm的吸光度值并计算测定培养液中IL-6的含量。
1.9 细胞内COX-2蛋白表达检测 按照1.5项所述方法收集细胞上清,向所收集的液体中按1∶4加入5×上样缓冲液,100℃变性5 min,瞬时离心后样本于-80℃保存待用。取等量总蛋白于10% SDS-PAGE电泳,湿转至PVDF膜上,然后室温条件下摇床上封闭2 h。COX-2多克隆抗体4 ℃下孵育过夜后,TBST缓冲液漂洗3次,每次10 min,二抗孵育1 h,TBST缓冲液漂洗3次,每次10 min。ECL显色系统显色。软件Image J分析条带及其灰度值。
1.10 统计学分析 数据以±S表示,应用统计学软件SPSS 22.0进行单因素方差分析。
2 结果
2.1 LPS和替唑尼特对细胞活性的影响 为了建立有效的实验模型,分析LPS和替唑尼特作用下的RAW264.7细胞其活性,以排除药物的细胞毒性对模型的干扰。结果如图1所示,细胞活性随着替唑尼特药物浓度的升高而呈现降低趋势。经50 μmol/L至150 μmol/L的替唑尼特作用后,细胞存活率保持在100%左右,与对照组无显著差异。而200 μmol/L及以上浓度的细胞活性却出现下降,并与溶剂对照组成显著差异,250 μmol/L浓度下细胞的存活率甚至只有77%±5%。因此,以下研究采用150 μmol/L以下替唑尼特药物浓度进行。
2.2 替唑尼特抑制细胞ROS生成 LPS刺激巨噬细胞和替唑尼特处理RAW264.7细胞6 h后,细胞内ROS引起的荧光亮度及与空白对照组的比值结果见图2。从图2可知,RAW264.7细胞在未受刺激时空白对照组(V组)会产生一定量的ROS,而LPS刺激6 h后, 胞内ROS水平显著升高(P<0.01),约升高8.0倍。而替唑尼特处理后则可以呈剂量依赖性地抑制LPS刺激巨噬细胞产生的ROS(P<0.01),50 μmol/L和75 μmol/L作用后分别比LPS刺激组降低了1.3倍和4.5倍。
2.3 替唑尼特减少MDA含量、提高还原型GSH含量 由图3可知,LPS刺激组较对照组的MDA含量显著升高(P<0.01),还原型GSH含量显著降低(P<0.01),提示LPS可引起RAW264.7细胞氧化应激水平升高,抗氧化能力下降。与LPS模型组相比,替唑尼特在较低浓度25 μmol/L时MDA含量和还原型GSH含量均无显著性变化(P>0.05)。相对于LPS组,替唑尼特在75 μmol/L和100 μmol/L时MDA含量分别降低了0.2倍和0.3倍,还原型GSH含量都升高约0.4倍,差异具有显著性统计学意义(P<0.01)。说明替唑尼特可以通过降低氧化产物含量和提高还原型物质的含量缓解LPS诱导的RAW264.7细胞氧化应激损伤。

图1 替唑尼特和LPS共同作用对RAW264.7细胞活性的影响Fig. 1 Effects of tizoxanide and LPS on RAW264.7 cells
2.4 替唑尼特拮抗LPS抑制SOD、CAT、GSH-Px酶活性 如图4所示,LPS刺激组SOD、CAT和GSH-Px酶活性显著低于空白组(P<0.01),经25 μmol/L替唑尼特处理后这三种酶活性均升高,差异不具有统计学意义(P>0.05)。当细胞经50 μmol/L及以上浓度的替唑尼特处理后,细胞内SOD、CAT和GSH-Px酶活性较LPS模型组均以浓度依赖的方式显著升高(P<0.01)。说明替唑尼特可以提高RAW264.7细胞中多种抗氧化酶的活性,提高细胞的抗氧化能力。
2.5 替唑尼特抑制LPS诱导的IL-6分泌 替唑尼特对LPS诱导的RAW264.7细胞分泌IL-6量的影响见图5。如图5所示,LPS刺激后RAW264.7细胞的IL-6分泌量显著性地升高,而替唑尼特处理后,各剂量组均能显著降低IL-6的分泌量。然而经过检测也发现替唑尼特处理后对IL-8的分泌无显著影响。

图2 替唑尼特抑制LPS刺激细胞产生ROSFig. 2 Tizoxanide inhibits LPS induced cells to produce ROS
2.6 替唑尼特抑制LPS诱导的COX-2的表达 替唑尼特对LPS诱导的RAW264.7细胞COX-2的表达量的影响见图6。如图6所示,LPS刺激后RAW264.7细胞的COX-2表达量显著升高,而替唑尼特处理4 h后,COX-2蛋白表达量显著降低,且呈剂量相关性。

图3 替唑尼特对LPS刺激RAW264.7细胞诱导的MDA和GSH产量的影响Fig. 3 Effects of TIZ on LPS induced MDA and GSH production in RAW264.7 cells
3 讨论

LPS是革兰阴性菌细胞膜外膜的主要组成成份,LPS可以诱导ROS的产生和炎性反应因子的释放[13]。巨噬细胞是参与机体固有免疫的主要效应细胞,胞质内富含溶酶体酶,具有很强的吞噬、杀菌和清除各种引起机体发生炎症反应的受损组织和细胞的能力[14]。所以,保障巨噬细胞功能的正常是机体炎症反应得以消除的关键。研究表明,在感染的情况下,巨噬细胞通过ROS和释放炎症介质导致组织损伤[12]。本研究证实了替唑尼特能显著减少重要的细胞炎症因子IL-6的释放,同时进一步的研究发现替唑尼特能显著性地降低COX-2的表达量。IL-6参与炎症反应和发热反应,而COX-2是前列腺素合成所必须的酶,其功能是合成前列腺素,产生的前列腺素是疼痛和炎症反应的主要因素[15]。因此,筛选能抑制炎症状态下IL-6的释放和COX-2被激活的药物是有效的抗炎药物筛选的重要途径之一。替唑尼特能有效抑制IL-6的释放和COX-2被LPS所激活,说明替唑尼特具有应用于与炎症及相关治疗的潜力。

图4 替唑尼特对LPS刺激RAW264.7细胞诱导的SOD(A)、CAT(B)和 GSH-Px(C)的影响Fig. 4 Effects of TIZ on LPS induced SOD(A), CAT(B)and GSH-Px(C) production in RAW264.7 cells
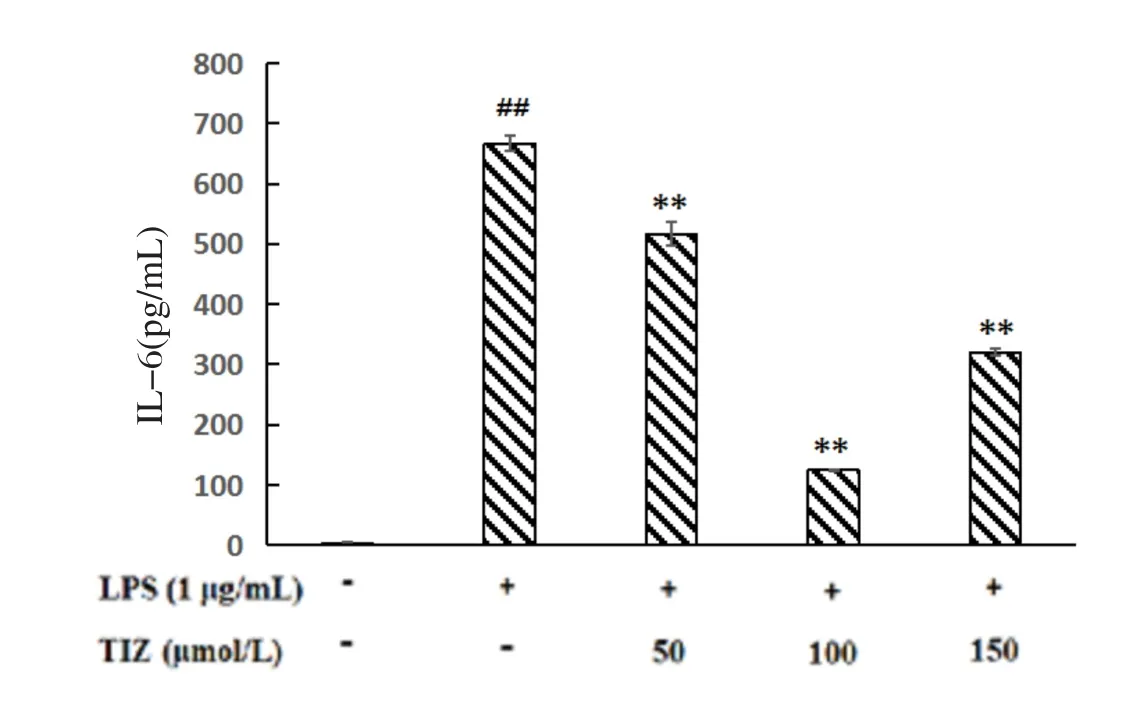
图5 替唑尼特对LPS诱导的RAW264.7细胞分泌IL-6量的影响Fig. 5 Effects of TIZ on LPS induced IL-6 in RAW264.7 cells

图6 替唑尼特对LPS诱导的RAW264.7细胞COX-2的表达量的影响Fig. 6 Effects of TIZ on LPS induced COX-2 expression in RAW264.7 cells
机体在正常代谢过程中产生的少量的自由基,可被自身抗氧化系统中的抗氧化物(如SOD、CAT和GSH等)及时清除以维持体内的代谢平衡。当活性氧不能被及时清除或抑制时,能够使细胞膜上脂质过氧化,产生MDA进而损伤细胞。MDA的量可间接反映机体抗氧化酶的功能[16]。SOD是抗氧化酶防御系统的重要成员,可专一性催化超氧阴离子生成H2O2和O2。H2O2可进一步被CAT和GSH-Px催化分解成H2O,从而阻止超氧阴离子转化为活性更高的-OH。SOD、CAT和GSH-Px间接反应了机体内源性的抗氧化能力,且三者之间相互协调,共同维护着自由基的代谢平衡[17-18]。本研究用LPS刺激巨噬细胞产生了明显的细胞氧化损伤作用,在LPS刺激下ROS、MDA都显著升高,SOD、CAT、GSH-Px都显著降低,证明氧化应激模型是成功的。给予替唑尼特处理的细胞可以显著性地抑制LPS诱导的细胞内ROS生成和MDA含量升高,表明替唑尼特可以通过有效压制LPS诱导的氧化效应从而拮抗LPS引起巨噬细胞损伤。
综上所述,替唑尼特能通过抑制炎性细胞因子的释放、抑制各种氧化因子的产生以及增强细胞抗氧化系统的能力而拮抗LPS诱导的大鼠腹腔巨噬细胞氧化损伤和炎性细胞因子分泌,保护细胞、抵抗炎症的发展。这为进一步挖掘替唑尼特的抗炎作用及其阐明其机制奠定了基础。
