小单胞菌属次级代谢产物及其生物活性研究进展
2019-05-30杨星鹏张志斌
杨星鹏,张志斌*,朱 笃,2*
1江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,南昌 330022;2江西科技师范大学生命科学学院,江西省生物加工过程重点实验室,南昌 330013
放线菌所产抗生素是天然活性产物的主要来源,在已报道的10 000多个天然活性化合物中有75% 产自链霉菌属,其余大约25%来自稀有放线菌[1],从小单胞菌属发现天然活性物质占38.1%,位居稀有放线菌的首位[2]。小单孢菌是革兰氏阳性稀有放线菌[3],截至2016年已报道了61个种和7个亚种[4],其所产次级代谢产物种类多样,不仅能产生如链霉菌产生的氨基糖苷类、大环内酯类等化学结构类型的抗生素,还能产生抗肿瘤等高细胞毒活性的烯二炔类独特化学结构的生物活性物质[5-8]。已从小单胞菌中分离到的许多著名抗生素如庆大霉素(Gentamicins)[9]、西索米星(Sisomicin)[10]和罗沙米星(Rosamicin)[11]等已被作为药物广泛使用。因此,利用小单孢菌并从中寻找和发现新的抗生素和其他生物活性资源对于拓宽我国天然化合物药源问题具有重要意义。
近年来随着产物分离技术和药物筛选技术的不断提高,一些结构新颖且活性良好的化合物相继从小单胞菌代谢产物中分离得到,它们表现出抑菌、抗肿瘤、免疫抑制剂等方面的生物活性[12,13]。虽然已有对小单孢菌在新型抗菌药物及抗肿瘤抗生素方面的研究,但有关小单孢菌活性代谢产物研究综述报导不多[14]。为了更全面的了解小单胞菌属代谢产物研究概况,更好地开发和利用小单胞菌天然产物资源,本文对2015年以来从小单胞菌中分离得到的次级代谢产物结构特征及其生物活性进行了综述。
1 化合物结构类型
1.1 大环内酯类
大环内酯类化合物是一类具有大内酯环的化合物,该类化合物具有很好的抑菌、抗肿瘤和抗寄生虫等生物活性,在抗生素药物方面有重要应用[15,16]。近几年从小单胞菌中分离到22个大环内酯类化合物,其中14个新化合物,从小单孢菌中发现新大环内酯类化合物比例较高。
Chun等[17]从海洋MicromonosporaharpaliSCSIO GJ089代谢产物中分离到大环内酯类化合物22-dehydroxymethyl-kijanolide(1)、 8-hydroxy-22-dehydroxymethyl-kijanolid(2)、Microsporanates A-F(3-8)、Tetrocarcin P(9)、Tetrocarcin A(10),B(11)和 AC6H(12),并通过核磁共振(NMR)和质谱(MS)技术鉴定了它们的结构,其中1-9为新化合物。Gong等[18]从另一株海洋MicromonosporacarbonaceaLS276的代谢产物中也分离到化合物10、12,以及5个新的大环内酯类化合物Tetrocarcin Q(13)、Tetrocarcin N(14)、Tetrocarcin H(15)、Arisostatin A(16)和Tetrocarcin F1(17)。上述研究结果表明,从海洋来源的小单孢菌中分离代谢产物具有出新率高的特点。
Maklamicin (18)是由Micromonosporasp.NBRC 110955产生的一个抗生素,其生物合成和聚酮合酶有关,Daduang等[19]在研究聚酮合酶作用相关的基因makC2时发现一个新化合物29-Deoxymaklamicin(19)。后续实验证明化合物19是18生物合成途径中的中间体,两者结构的区别是化合物19的29号位上的CH2OH变成了甲基。
2017年,Ochoa等[20]从鼠海豚(Harborporpoise)肠道附生菌MicromonosporaauratinigraRLFI1036F的代谢产物中分离到大环内酯类化合物phocoenamicin(20)。2018年,Perez-Bonilla等[21]从加那利群岛海洋沉积物来源的Micromonosporasp.CA-214671中也分离到化合物20,以及两个新大环内酯类化合物Phocoenamicin B(21)和C(22)。
1.2 大环酰胺类
大环酰胺化合物结构上都具有酰胺键,而且结构与多肽相似,因其有很好的生物活性,在生物医药领域受到关注和重视。大环内酰胺类化合物在真菌、链霉菌次级代谢产物中分布广泛,而从小单孢菌中分离报道不多,本文总结了近几年从小单胞菌中分离的大环内酰胺类化合物,在已报道的9个化合物中经鉴定有8个为新化合物。
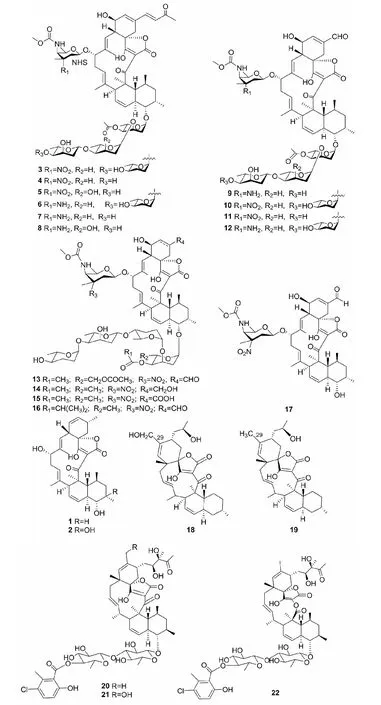
图1 化合物1~22的化学结构Fig.1 The chemical structures of compounds 1-22
2015年,Christopher等[22]从海洋Micromonosporasp.RL09-050-HVF-A中分离得到3个新的大环酰胺类化合物Lobosamides A-C(23~25)。Hoshino等[23]将MicromonosporawenchangensisHEK-797和细菌TsukamurellapulmonisTPB0596共培养,从中分离得到1个新的大环酰胺类化合物Dracolactams B(26)。Nie等[24]通过Sephadex LH-20和HR-TOF-MS等方法从Micromonosporasp.FIM05328代谢产物中分离到新大环酰胺类化合物FW05328-1(27),并确定了其结构。Williams等[25]将海洋Micromonosporasp.RJA4480进行固态培养,并用乙酸乙酯萃取附有菌体的固体琼脂培养基,从中分离得到4个新化合物Sporalactam B (28)、Sporalactam A(29)、Rifamycin 1(30)和Rifamycin 2(31)。通过改变培养策略来拓宽次级代谢产物种类并提高产量是微生物培养的重要手段,上述利用共培养、固态发酵培养小单孢菌的方法也能为后期从发酵产物中分离新化合物提供好的思路。
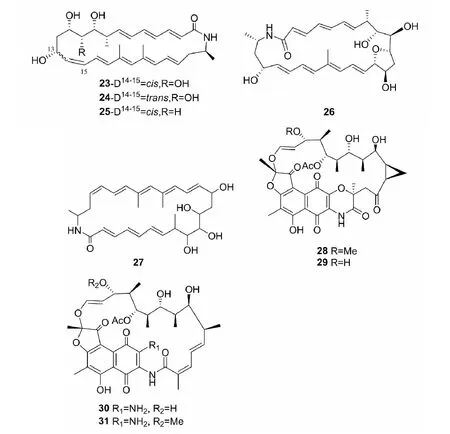
图2 化合物23~31的化学结构Fig.2 The chemical structures of compounds 23-31
1.3 醌类
醌类化合物是天然产物中一类比较重要的活性成分,随着人们对微生物次级代谢产物研究的深入,从海洋小单孢菌代谢产物中分离得到一些结构新颖的醌类化合物主要为蒽醌类及其衍生物,它们表现出较好的抑菌、抗氧化、抗肿瘤、细胞毒性等生物活性。
Mullowney等[26]从越南东海Cát bà半岛的海洋沉积物中分离得到Micromonosporasp.G039,从其代谢物中获得3个醌类化合物lagumycin B(32),dehydrorabelomycin(33)和 WS-5995 A(34),其中化合物32的结构首次得到表征。Jiang等[27]从海洋Micromonospora.echinosporaSCSIO 04089中分离到含苯并芴结构的新化合物Nenestatin A (35),该化合物具有和非典型角环素单体lomaiviticins相似的碳骨架,在体外验证表达该化合物的生物合成基因簇时分离到其生物合成中间体homo-dehydrorabelomycin E(36)。
Yan等[28]从公共放线杆菌基因组数据库中挖掘二炔类生物合成基因簇时,从MicromonosporayangpuensisDSM 45577中分离得到一个带烯二炔结构的蒽醌类化合物yangpumicin A(YPM A,37)和蒽醌类化合物YPM B-E(38~41)。Adnani等[29]将来自两种不同的海洋生物的Micromonosporasp.WMMB-235和Rhodococcussp.WMMA-185共培养,从其代谢产物中分离到复杂结构的新的醌类化合物keyicin(42)。烯二炔类抗生素具有很强的抗肿瘤活性,而且作用机制新颖,能发展成新型高效的抗肿瘤药物[30-32],天然来源的烯二炔类化合物至今发现不多,从小单胞菌中发现的尤为稀少。
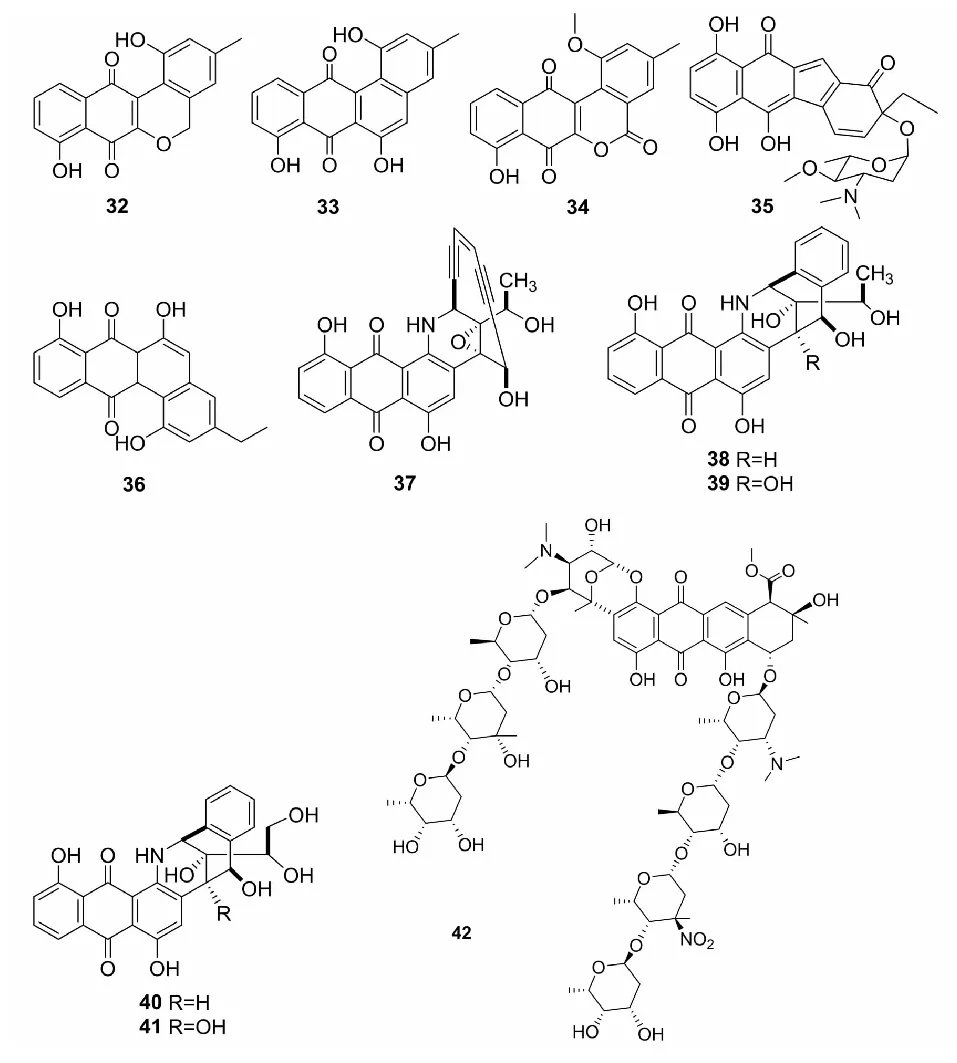
图3 化合物32~42的化学结构Fig.3 The chemical structures of compounds 32-42
1.4 肽类
多肽化合物具有多种多样的生理活性和药用价值,是抗生素研究中的一个相对较新的领域,在小单胞菌中发现较多的是杂环肽类化合物。Yasushi等[33]将Micromonosporasp.ATCC 39149进行液态发酵,直接对整个发酵液进行HPLC和LC-ESI-MS分析,从中分离得到新的多肽ketomemicin A(43)。2016年Xu等[34]从中国云南的土壤样品中分离得到Micromonosporasp.CPCC 202787 ,并在菌体的乙酸乙酯萃取相中发现10个多肽化合物44~53,其中化合物44和45为新化合物。
1.5 生物碱类
生物碱是一类重要的含氮杂环化合物,具有复杂多样的化学结构和非常广泛的生物活性,如抗菌、抗寄生虫、抗肿瘤或细胞毒性[35]。自然界中生物碱主要来源于植物,在微生物中也有大量产生,目前从不同来源的放线菌中分离到越来越多具有独特化学结构和生物学活性的生物碱。Hoshino等[23]将分离自湖泊沉积物的M.wenchangensisHEK-797和细菌T.pulmonisTPB0596共培养,获得一个新的生物碱类化合物Dracolactams A(54),证明共培养条件下一些沉默基因被激活可能产生新的代谢产物。Boonsnongcheep等[36]从葛根根瘤内生Micromonosporasp.PC1052分离到生物碱类化合物S-adenosyl-N-acetylhomocysteine(55),化合物55首次从小单胞菌中分离得到,此前该化合物作为化学合成的产物已有报道。
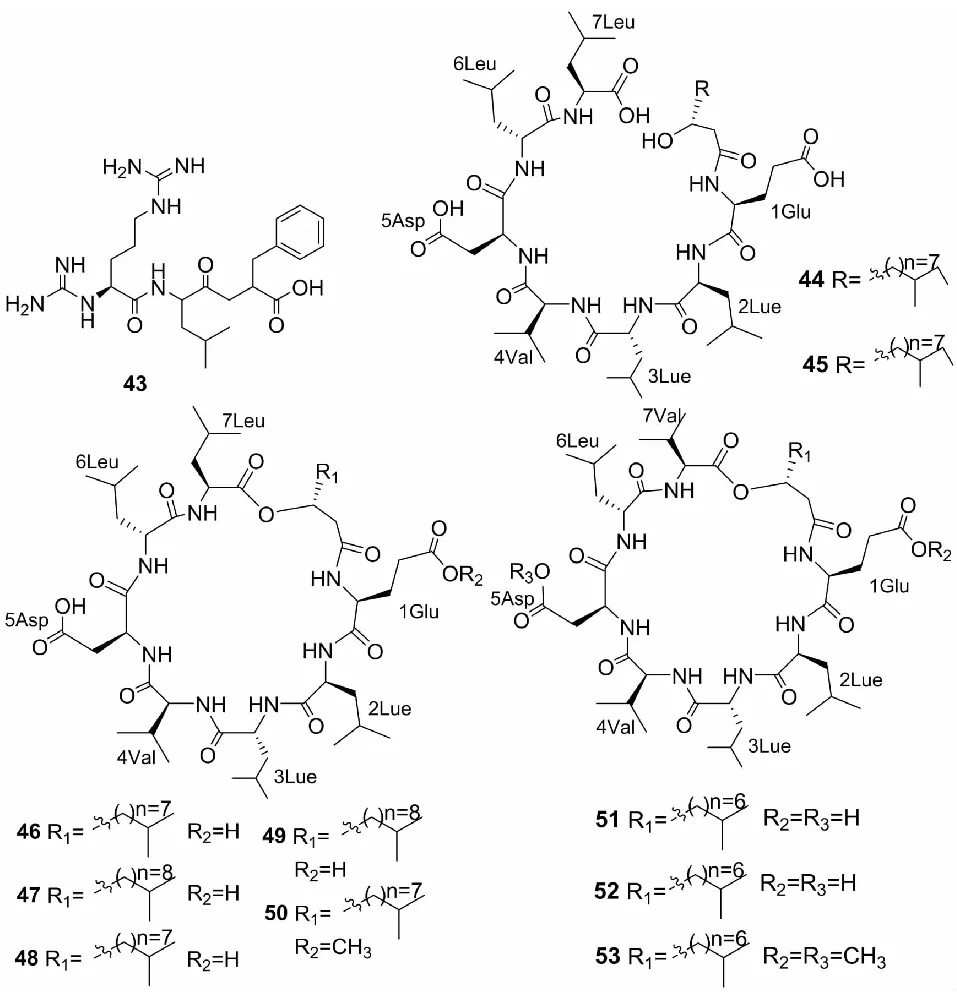
图4 化合物44~53的化学结构Fig.4 The chemical structures of compounds 44-53
Mullowney等[26]从海洋Micromonosporasp.G039除了发现三个醌类化合物lagumycin B (32),dehydrorabelomycin(33)和 WS-5995 A(34)外,还发现了一个具有非特异性的细胞毒性生物碱phenanthroviridone(56)。Talukdar等[37]利用氯仿萃取从土壤中分离的MicromonosporaauratinigraHK-10的发酵液,并从油性粗提物中分离获得一个新的醌类化合物2-methylheptylisonicotinate(57)。Nie等[24]使用1D,2D NMR和HR-TOF-MS对海洋Micromonosporasp.FIM05328的主要代谢产物进行了鉴定,发现了一个生物碱类化合物aurodox(58)。Dashti等[38]从来源于地中海海绵的Micromonosporasp.RV43经GlcNAc诱导后分离到一个新的生物碱类化合物3-formylindole(59)。Vizcaíno等[39]从来自2000米深的海洋沉积物的MicromonosporamatsumotoenseM-412中分离到一个生物碱类化合物,经HRMS(高分辨质谱)和1D、2D NMR确定结构鉴定后发现是保洛霉素家族化合物,并命名为paulomycin G(60)。Zhang等[40]从中国南海分离得到MicromonosporarosariaSCSIO N160,通过对发酵液丙酮萃取,树脂吸附等几个分离纯化步骤之后,获得3个新的生物碱类化合物Pyrazolofluostatins A-C(61~63)。
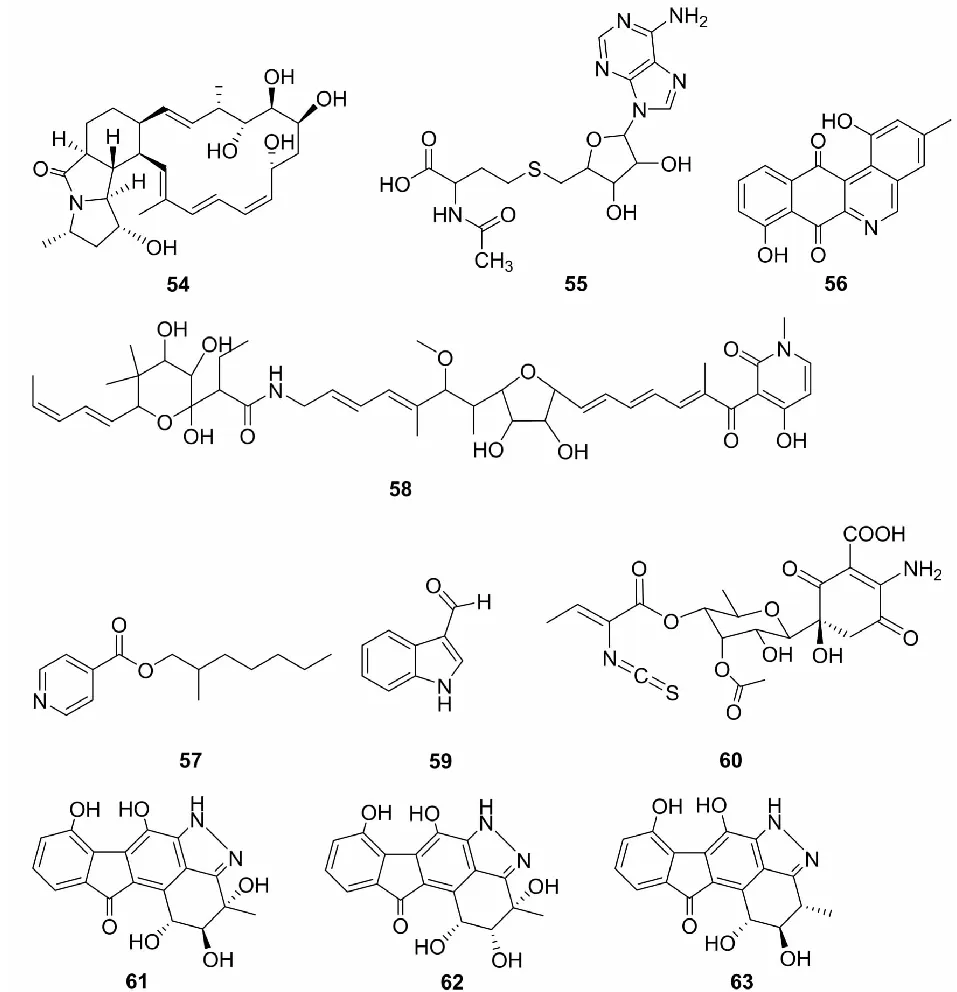
图5 化合物54~63的化学结构Fig.5 The chemical structures of compounds 54-63
1.6 萜类
萜类化合物通常是指由异戊二烯单位组成的分子式为(C6H5)n的碳氢化合物,种类丰富,是天然产物中最大的家族[41]。萜类化合物广泛分布在植物中,从小单胞菌中发现的萜类化合物相对较少。Mullowney等[26]在筛选抑制人肿瘤细胞系NCI-60 SKOV3的放线菌时,筛选到高活性菌株Micromonosporasp.G039并从其发酵液中分离到1个新的化合物isopimara-2-one-3-ol-8,15-diene(64)。Zhang等[42]从来自于海洋海鞘Symplegmabrakenhielmi的Micromonosporasp.WMMC-218中分离到2个新的双萜类化合物Micromonohalimane A (65)和B(66)。

图6 化合物64~66的化学结构Fig.6 The chemical structures of compounds 64-66
1.7 其它类型化合物
近几年,国内外对小单孢菌活性产物的研究报道日益增多,除以上报道的化合物结构类型外,还包括脂肪酸类、酚酸类等,它们也具有一定的生物活性。Gao等[43]从海洋来源的Micromonosporasp.HS-HM-036中分离得到一种萘丙酸类似物(67)。来源于海绵的Micromonosporasp.RV43在不添加GlcNAc的情况下分离得到glutaric acid(68)、4-hydroxyphenyl acetic acid(69)、4-hydroxybenzoic acid(70)、4-hydroxybenzaldehyde(71)、3-hydroxybutyrate的不同类似物(72~77),添加GlcNAc后产生了新化合物guaymasol(78)[38]。
Appadurai等[44]从来自海洋沉积物中的Micromonosporasp.ICN36中分离出一种具有高效抗MRSA活性的化合物,其结构暂未见报道。Diogo等[45]对MicromonosporaechinosporaDSMZ 43816培养物中的挥发性成分进行GC/MS分析,发现了一类新的长链脂肪腈族化合物。

图7 化合物67~78 的化学结构Fig.7 The chemical structures of compounds 67-78
2 生物活性
2.1 抗菌活性
近几年来,诸多学者对小单胞菌所产次级代谢产物的抑菌活性进行了研究,发现许多化合物对大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、白色念珠菌(Candidaalbicans)等常规指示菌有较好的抑制活性,同时还发现一些能作用于结核分枝杆菌(Mycobacteriumtuberculosis)和金黄色葡萄球菌(Staphylococcusaureus)的化合物。
Gui等[17]从M.harpaliSCSIOGJ089分离得到9个大环内酯类活性化合物(3~12),它们对苏云金杆菌 BT01 和枯草芽孢杆菌 BS01 具有较好的抗菌活性,其MIC值为0.016~8.0 μg/mL,其中化合物3和10活性最强,对BT01和BS01的MIC值分别为0.016 μg/mL和0.03 μg/mL。Gong等[18]从M.carbonaceaLS276中分离到6个活性化合物(10,12~16),化合物10、12~16对枯草芽孢杆菌的MICs 值分别为<0.048 μM、0.5 μM、12.5 μM、1.562 μM、50 μM 和0.048 μM。Mercedes等[21]报道3个大环内酯类活性化合物(20~22),化合物20、21和22质量分别为4、2、4 μg时抑制枯草芽孢杆菌的抑菌圈达7 mm,同时发现化合物20对结核分枝杆菌(Mycobacterium.tuberculosis)和耐万古霉素的屎肠球菌(EnterococcifaeciumMB5571)也有抑制作用,其MIC值范围在16~32 μg/mL和32~64 μg/mL之间。此外,大环酰胺类化合物28能很好地抑制结核分枝杆菌,其MIC90值为0.06 μM,有开发成新的抗结核药物的潜能[25]。
Zhang等[40]发现生物碱类化合物61~63对大肠杆菌、金黄色葡萄球菌、苏云金芽孢杆菌、枯草芽孢杆菌和白色念珠菌都有不同程度的抑制活性。Diogo等[45]对M.echinosporaDSMZ 43816培养物中的挥发性成分进行GC/MS分析,发现了一类新的长链脂肪腈族化合物并研究了其生物合成途径,生物活性检测表明其中某些化合物对Bacillussubtilis,Micrococcusluteus和 multiresistantStaphylococcusaureus(MIC=2.0~4.0 mg/mL)有一定的抑制活性。
随着新的抗菌药物的不断出现和临床应用,细菌的耐药性已成为抗感染治疗面临的一个严重问题。从小单胞菌中分离到一些新的大环酰胺类化合物、醌类化合物和萜类化合物,它们对耐甲氧西林金黄色葡萄球菌(MRSA)和甲氧西林敏感金黄色葡萄球菌(MSS)具有一定的抑制活性。化合物18是Micromonosporasp.NBRC 110955产的一个抗生素,能有效抑制金黄色葡萄球菌生长,MIC值为13 μg/mL,Daduang等在研究化合物18的合成过程发现一个合成途径中的中间体化合物19,但是化合物19对金黄色葡萄球菌的MIC值为1.6 μg/mL,远低于化合物18,化合物18对藤黄微球菌、枯草芽胞杆菌、蜡样芽胞杆菌和粪肠球菌同样有很强的抑制作用,MIC值在0.2~13 μg/mL之间[19,46]。化合物20~22对MRSA都有抑制作用,其中化合物20抑制作用最强,MIC值为1.0 μM,化合物21和22分别为4~8 μg/mL和32~64 μg/mL[21,22]。化合物28~31对多种不同病原菌(包括MRSA)都有很强的抑制作用。化合物28和29对MRSA的MIC90分别为7.0和1.8 μM,化合物30和31中的3-氨基取代基(R1)显著增强了利福霉素支架的体外抗菌活性,对MRSA的MIC90值为0.000 8和0.000 9 μM,对E.coil、M.tuberculosis的MIC90值在0.000 1~1.8 μM之间[25]。该类化合物具有很好抗菌活性,有望成为新药开发的前体化合物。化合物42[29]能抑制MSSA,MICS值为2.5 μM,对枯草芽孢杆菌的MICS值为9.9 μM,化合物42同时具有抑制分枝杆菌和红球菌的活性。Talukdar等[37]发现具有广谱抑制活性的化合物2-methylheptylisonicotinate (57),该化合物对金黄色葡萄球菌、枯草芽胞杆菌、普通变形杆菌(Proteusvulgaris)、大肠杆菌、铜绿假单胞菌(Pseudomonasaeruginosa)和脓肿分枝杆菌(Mycobacteriumabscessus)的MIC值分别为70、40、80、60、60和50 μg/mL。化合物66[42]对MRSA有抑制作用,其MIC为40 μg/mL,化合物65对MRSA的MIC>200 μg/mL。化合物67[43]对枯草杆菌和铜绿假单胞菌的最小抑菌浓度分别为0.016 mg/mL和8 mg/mL。
2.2 抗肿瘤活性
天然化合物及其衍生物是抗肿瘤化合物的重要来源之一。具有细胞毒性的化合物能作用于细胞的基本结构或者生理过程,从而影响细胞的生存,在癌症和肿瘤治疗方面有重要的意义。细胞毒性实验结果表明,小单孢菌的次级代谢产物具有比较明显的抗肿瘤活性。Nie等[24]分离的新大环酰胺类化合物27显示较好的细胞毒活性,对人肿瘤细胞系KYSE30、KYSE180和EC109有较好的抗增殖效果,其IC50值分别为15.92、30.77、0.000 20 μM。Mullowney等[26]以小鼠卵巢表面上皮(MOSE)和小鼠输卵管上皮(MOE)为代表的卵巢癌前体细胞系,对化合物32、33、34和56进行了选择性细胞毒性评价,化合物32对两种细胞系的LC50分别为9.80 μM(MOSE)和10.8 μM(MOE),化合物33和56为非特异性的细胞毒性,对多种癌细胞都有较强的抑制作用,化合物34对Kuramochi卵巢癌细胞的LC50为18.6 μM。Pang等[34]对化合物44~53进行了细胞毒性检测,结果表明化合物44~53对Sup T1细胞具有相对较低的细胞毒性。化合物37[28]是1个带烯二炔结构的蒽醌类化合物,其对黑色素瘤(SKMEL-5)、乳腺癌(MDA-MB-231 和SKBR-3)、中枢神经系统(SF-295)和非小细胞肺癌(NCI-H226)均表现出很高的抑制活性(IC50s=0.26~2.9 μM),该研究结果与报道的烯二炔类化合物具有高细胞毒性和抗肿瘤活性是一致的。
Nie等[24]从海洋Micromonosporasp.FIM05328代谢产物中分离到有抑制肿瘤细胞增殖效果的化合物58,该化合物对人肿瘤细胞系KYSE30,KYSE180和EC109的IC50值为22.52 μM、83.76 μM和20.56 μM,对细菌和真菌没有抑菌活性。化合物60[39]对人胰腺癌(MiaPaca-2)、乳腺癌(MCF-7)和肝细胞癌(HepG2)具有较强的细胞毒活性,IC50值分别为2.70±0.25 μM、1.58±0.12 μM和4.30±0.42 μM。化合物67[43]对人肺腺癌细胞株A549具有细胞毒性,IC50值为46.54 μg/mL。化合物79[44]在体外试验中对HCT 15结肠癌细胞具有一定的杀伤活性,IC50值为8.28 μg/mL。
2.3 抗HIV活性
艾滋病(HIV)是一种免疫缺陷病,到目前为止仍然无法治愈,能对HIV病毒起到抑制作用的天然产物为数不多,仅包括多糖、萜类、生物碱、多肽等化合物中的少数几种,和已报道的成千上万种天然活性化合物相比是少之又少。最近有研究人员从小单胞菌中就发现一些能抑制HIV病毒的多肽类化合物,如化合物44和45对HIV-1的抑制作用较弱,IC50分别为58.0 μM和57.3 μM,而化合物46~53相对较强,IC50为5.3~22.3 μM[34]。以上研究表明多肽类化合物在抗HIV方面显示较好的应用前景。
2.4 其他生物活性
小单胞菌次级代谢产物除了具有抗菌活性、抗肿瘤活性和抗HIV活性外,还具有抗寄生虫活性和抗氧化活性等。研究人员发现化合物23和24对布氏锥虫(Trypanosomabrucei)有明显的抑制作用,其IC50分别为0.8 μM和6.1 μM[22]。化合物61[40]具有一定的抗氧化活性(EC50=48.6 μM)。本研究未报道其它代谢产物的抗寄生虫和抗氧化等活性,在后续的研究工作中可以利用发酵调控的手段来提高代谢产物的产量,从而发掘其新的生物学功能。
3 结论与展望
小单孢菌分布广泛,从陆地到海洋、从土壤到动植物,都有分离到小单孢菌的报道,通过本文统计,小单孢菌主要来源海洋(15个)、其次为土壤(2个),分别占63%和8%(图8A)。小单孢菌属也是产新型抗生素和其他活性化合物的重要来源,本论文从小单胞菌属中分离到79个次级代谢产物,新化合物(48个)占化合物总数的61%。从化学物结构类型看,大环内酯类相对较多(22个),占化合物总数的28%,其后依次为醌类(11个)、肽类(11个)、生物碱(10个)和大环酰胺(9个),分别占化合物总数的14%、14%、13%和11%(图8B)。已报道的化合物中有52个具有生物活性,具有抑菌活性的最多(31个),其次是抗肿瘤活性(19个)、抗HIV(10个)等,所占比率依次为67%、24%和13%(图8C)。以上数据分析结果表明,小单胞菌是挖掘活性天然产物的重要菌源,所产次级代谢产物化学结构新颖、出新率高,生物活性研究具有其独特的优势,为寻找新的药用先导化合物提供了宝贵的资源。
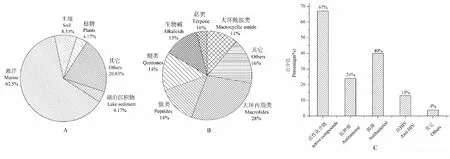
图8 小单胞菌来源(A)、产物结构分类(B)和产物活性分类(C)Fig.8 Origin categories(A) of Micromonospora、Structure types(B) and Bioactive categories(C) of Micromonospora natural products
因此在充分利用现有小单胞菌资源的同时,我们可以从以下3个方面对小单胞菌及其次级代谢产物进行更全面的研究:(1)加大对研究相对较少的特殊生境小单胞菌的分离筛选,如海洋沉积物、动植物内生环境、极热极冷环境,以获得更为丰富的小单胞菌资源,为天然产物的分离和开发奠定基础;(2)小单胞菌具有很强的产天然活性产物的潜力,但是在实验室的培养条件下,很多天然产物的基因合成簇表达率低,甚至沉默。随着生物信息学和分子生物学的深入研究,我们可以对菌株的基因进行深度地挖掘并研究其代谢通路,充分发挥小单胞菌代谢产物的合成潜力,以尽可能地获得更多的天然代谢产物;(3)从小单胞菌中分离出来的天然产物,有许多都是结构十分相似的同类物质,但活性却各有不同。因此,可以结合化学合成和结构修饰的方法,对现有天然化合物进行结构改造,开展构效关系研究,以从中发现药物先导物或者药物,为人类健康与医药的发展做出贡献。
