芳姜黄酮对人皮肤鳞状细胞癌A431细胞迁移、侵袭及凋亡的影响和机制研究
2019-05-30王麒淞荣冬芸
王 叶,王麒淞,骆 衡,荣冬芸,曹 煜
1贵州医科大学临床医学院;2贵州医科大学 药用植物与利用国家重点实验室;3贵州医科大学中药天然产物化学重点实验室;4贵州医科大学附属医院皮肤科,贵阳 550004
人皮肤鳞状细胞癌(Skin squamous cell carcinoma,SSCC)是一种起源于表皮或皮肤附属器角质细胞的恶性上皮性肿瘤,是最常见的皮肤恶性肿瘤之一[1]。皮肤鳞状细胞癌发展快,对组织破坏力强,具有很强的侵袭力和迁移力,转移率高达16%。目前临床上针对皮肤鳞癌最常见的治疗方式是手术切除治疗,但术后复发、转移并不少见[2]。对于已经转移或晚期患者,化疗药物在达到正常治疗量时,对人体正常细胞和器官有着巨大毒性,且如今化疗期间易出现多药耐药问题[3]。因此,新型药物的研发对于SSCC的治疗具有重大意义。芳姜黄酮(Ar-Turmerone)已经被国内外研究学者证实对乳腺癌细胞、血液肿瘤细胞具有一定的抑制作用,并进行了相关机制研究[4,5],但对于皮肤鳞状细胞癌相关研究罕见报道。本研究以皮肤鳞状细胞癌A431细胞为对象,观察芳姜黄酮对A431细胞增殖抑制、凋亡、体外迁移、侵袭的作用,并探讨芳姜黄酮是否通过Notch1/ Hes1/ PTEN通路影响皮肤鳞状细胞癌A431的凋亡,为皮肤鳞状细胞癌的新药研发提供相关的实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞
人皮肤鳞状细胞癌A431细胞购自武汉普诺赛生命科技有限公司。
1.1.2 药品与试剂
芳姜黄酮(美国Gayman Chemical),DMEM高糖培养基,PBS,青链霉素双抗(美国HyClone),四季青胎牛血清,胰酶(美国gibco),CCK-8试剂(日本同仁),吉姆萨染色试剂盒(中国Solarbio),Transwell小室(美国Corning),Matrigel胶(美国BD公司),Annexin V-FICT/PI 细胞凋亡检测试剂盒,RNA提取试剂盒,全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(中国江苏碧云天生物科技研究所),逆转录试剂盒、real-time PCR试剂盒(日本TaKa-Ra公司),β-Actin、Notch1、Hes1、PTEN抗体(英国Abcam公司),Lipofectamine2000(美国Invitrogen Life Technologies公司)。
1.1.3 主要仪器
多功能酶标仪SYNERGY-H4(美国Bio Tek),DO3 THINK倒置显微镜,流式细胞仪(美国Becton-Dick-inson)StepOnePlus Real-Time PCR仪、E-Gel Imager凝胶成像系统(美国Life Technologies)。
1.2 方法
1.2.1 细胞培养
A431细胞在培养瓶中贴壁生长,用含10%胎牛血清的完全培养基,于37 ℃,含5% CO2的细胞培养箱中培养,每隔3~4天传代一次,取处于对数生长期的细胞用于实验。
1.2.2 增殖抑制率测定
CCK-8法检测细胞增殖抑制率。将细胞消化离心后将浓度稀释成1×105个/mL,取50 μL接种于96孔板,设置5个复孔,待细胞贴壁后加药。将芳姜黄酮:DMSO按100∶1配置成1 g/L母液。参照荣冬芸[6]等的实验方法,实验组以等体积法计算芳姜黄酮浓度,使其终浓度为0、2.5、5、10、20、40、80、160 mg/L,终体积为100 μL。同时,设细胞对照组(除不加药物外,处理同实验组)、空白对照组(除不加 DMSO、药物及细胞,余处理同实验组),继续培养24、48、72 h,结束前2.5 h避光加入CCK-8试剂10 μL/孔,继续孵育2.5 h小时后酶标仪检测450 nm波长吸光度(A)值。
细胞增殖抑制率=(细胞对照组A450 - 实验组A450)/(细胞对照组A450 - 空白对照组A450)×100%
1.2.3 凋亡形态观察
消化离心收集细胞,重悬计数后以完全培养基稀释至1×105个/mL,将细胞悬液接种于6孔板中(1 mL/孔),加药使药物终浓度为0、20、40、80 mg/L,培养24 h,按照吉姆萨试剂盒方法染色,倒置显微镜下观察细胞形态,拍照记录。
1.2.4 体外迁移实验
将细胞悬液接种于6孔板,待细胞平铺面积达80%后,用1 mL的枪头在孔内划痕,用PBS洗去脱落细胞,于倒置显微镜下对划痕进行拍照。实验组加药使药物终浓度为5、10 mg/L,设置含0.1% DMSO的培养基对照组,于培养箱中培养24、48 h,再次于显微镜下拍照。用Image J软件计算加药前后划痕面积,计算面积比。
面积比 =(加药前初始划痕面积-加药24 h / 48 h后划痕面积)/(加药前初始划痕面积)×100%
1.2.5 Transwell体外侵袭实验
将配置好的Matrigel胶均匀铺于Transwell小室内,A431细胞饥饿24 h后制备成细胞悬液。实验组将细胞分别用浓度为5、10 mg/L的不含血清的芳姜黄酮重悬,设置含DMSO的无血清培养基对照组,并调整细胞浓度为5×105个/mL,取200 μL接种于铺好胶的小室中,在下室内加入600 μL含15%血清的完全培养基,置于培养箱中孵育。24、48 h后用棉签擦去小室内的细胞和胶,按照结晶紫染色试剂盒步骤染色,在倒置显微镜下随机选取6个视野,显微镜下计数每个视野中的细胞数量,重复实验3次。
细胞平均穿膜数量 = 6 个视野中的细胞总数 / 6
1.2.6 流式细胞仪检测细胞凋亡率
收集细胞后以完全培养基重悬,按1 mL每孔接种于6孔板,培养箱中培养12 h后,实验组加入芳姜黄酮,使药物终浓度分别为20、40、80 mg/L,设置不加药的细胞对照组,继续培养48 h。小心消化收集细胞,PBS洗涤后,参照Annexin V-FICT/ PI 试剂盒说明书操作,上流式细胞仪检测,重复实验3次,计算凋亡率。
1.2.7 siRNA转染
siRNA的设计由上海吉玛生物公司完成,lipofectamine2000 转染技术转染细胞。细胞转染后无血清培养6 h,更换完全培养基,继续培养至48 h,检测相关mRNA及蛋白表达。荧光标记siRNA(cy3-siRNA)评价转染效率,转染效率约为80%。转染成功后,设置空白组(未作任何处理的A431细胞)、对照组(阴性siRNA转染的A431细胞),加药组(以20 mg/L的芳姜黄酮作用于A431细胞)、siRNA组(siRNA转染细胞),siRNA+药物组(以20 mg/L的芳姜黄酮作用于转染后的A431细胞)。检测Notch1、Hes1和PTEN的mRNA及蛋白表达,流式细胞仪检测沉默PTEN后细胞的凋亡率。
1.2.8 real-time PCR检测mRNA表达
使用Trizol试剂从细胞中分离出RNA。根据逆转录试剂盒的说明书逆转录总RNA,然后使用real-time PCR试剂盒和所选基因的特异性引物进行定量实时PCR。反应条件为:95 ℃预变性30 s,95 ℃变性15 s,60 ℃退火1 min,进行40个循环。以管家基因β-actin为对照,用2-△△Ct计算相对表达水平。
1.2.9 Western blot检测蛋白表达
将细胞在裂解缓冲液中裂解,并通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,10%凝胶)分离来自每个样品的50 μg蛋白质,并转移到聚偏二氟乙烯(PVDF)膜上。使用抗Notch1、抗Hes1、抗PTEN抗体孵育。ECL发光液进行发光反应,于暗室中曝光,将条带强度以β-actin标准化。
1.2.10 统计学分析
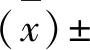
2 结果
2.1 CCK-8法检测芳姜黄酮对A431细胞增殖的影响
5~160 mg/L的芳姜黄酮作用于A431细胞24、48、72 h后,其增殖抑制率与对照组相比升高,差异有统计学意义(P均<0.01);当芳姜黄酮浓度为2.5 mg/L时,三个处理时间后增殖抑制率与对照组相比均无明显差异(P均>0.05)。当药物浓度在10~80 mg/L时,随作用时间的延长,增殖抑制率逐渐升高,差异有统计学意义(P均<0.01),但当药物浓度为160 mg/L时,继续增加作用时间,增殖抑制率也无明显变化(48 h vs 72 h,P>0.05)。芳姜黄酮在24、48、72 h的IC50分别是124.67、98.82、72.16 mg/L,结果表明实验浓度对A431细胞的增殖具有抑制作用,且呈现一定的时间-剂量依赖性(见表1)。
2.2 芳姜黄酮对A431细胞形态的影响
对照组细胞呈多角形、排列紧密,芳姜黄酮不同浓度组细胞贴壁性降低,细胞间隙增宽,形态改变,可见核固缩、核碎裂和核溶解,上述现象随药物浓度增加更为明显(见图1)。
2.3 芳姜黄酮对A431细胞迁移能力的影响
与对照组相比,实验组细胞迁移能力降低,差异有统计学意义(24 h时P<0.05,48 h时P<0.01),提示随芳姜黄酮浓度增高,培养时间增加可抑制A431细胞迁移(见图2)。
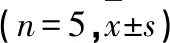
表1 芳姜黄酮对A431细胞增殖抑制率的影响
注:与对照组相比,**P<0.01;与24 h相比,##P<0.01;与48 h相比,▽▽P<0.01。
Note:compare with the control group,**P<0.01;compare with the 24 h group,##P<0.01;compare with the 48 h group,▽P<0.01.

图1 芳姜黄酮(0、20、40、80 mg/L)处理48 h对A431细胞形态变化的影响Fig.1 Effects of Ar-Turmerone (0,20,40,80 mg/L,48 h) on the morphological changes of A431 cells注:A:对照组(倒置显微镜下,×400);B-D:20、40、80 mg/L芳姜黄酮处理细胞(倒置显微镜下,×400),箭头处示细胞核Note:A:control group(inverted microscope,×400);B-D:20,40,80 mg/L Ar-Turmerone treated cells(inverted microscope,×400),the arrow shows the nucleus.

图2 芳姜黄酮(5、10 mg/L)、DMSO组作用于A431细胞(24、48 h)后横向迁移图Fig.2 Lateral migration plots of A431 cells after Ar-Turmerone (5,10 mg/L) and DMSO treatment (0,24,48 h)注:A:A431细胞横向迁移代表性图像(倒置显微镜下,×100);B:芳姜黄酮与DMSO组细胞迁移统计(倒置显微镜下,×100)。与对照组相比,*P<0.05,**P<0.01。Note:A :A431 cells lateral migration representative plot(inverted microscope,×100);B:Ar-Turmerone (5,10 mg/L) group and DMSO group cell migration statistics(inverted microscope,×100).Compared with the control group,*P<0.05,**P<0.01.
2.4 芳姜黄酮对A431细胞侵袭能力的影响
实验组A431细胞与对照组相比穿膜细胞数量明显减少,差异有统计学意义(P均<0.01),且随作用时间延长,细胞穿膜数量逐渐减少,差异具有统计学意义(P均<0.01),提示随芳姜黄酮浓度升高,作用时间延长可抑制A431细胞的侵袭(见图3)。
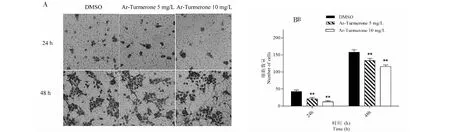
图3 芳姜黄酮(5、10 mg/L)、DMSO组作用于A431细胞(24、48 h)后侵袭能力图Fig.3 A431 cell invasion capacity affected by Ar-Turmerone (5,10 mg/L) and DMSO treatment (24,48 h)注:A:A431细胞侵袭能力代表图像(倒置显微镜下,×200);B:Ar-Turmerone (5、10 mg/L)与DMSO组细胞侵袭统计,与对照组相比,**P<0.01。Note:A:A431 cells invasion capacity represents plots(inverted microscope,×200);B:Ar-Turmerone(5,10 mg/L) and DMSO group cell invasion statistics.Compared with control group,**P<0.01.
2.5 芳姜黄酮对A431细胞凋亡率的影响
20、40、80 mg/L药物浓度时的A431细胞凋亡率分别为(8.30±0.36)%、(16.37±0.46)%、(30.48±1.08)%,与对照组(0.02±0.01)% 相比凋亡率升高,差异有统计学意义(P均<0.01)(见图4)。
图4 芳姜黄酮(0、20、40、80 mg/L)作用于A431细胞(48 h)后凋亡率图Fig.4 A431 cell apoptotic rate affected by Ar-Turmerone (0、20、40、80 mg/L) treatment (48 h)注:A-D:A431细胞凋亡代表图像;A:对照组;B-D:芳姜黄酮浓度为20、40、80 mg/L时的凋亡图像。Note:A-D:A431 cells apoptotic representative plot;A:Control group;B-D:Ar-Turmerone (20,40,80 mg/L) group apoptotic rate.
2.6 芳姜黄酮对A431细胞Notch1和Hes1、PTEN mRNA和蛋白表达的影响
随药物浓度增加,Notch1、Hes1和PTEN 的mRNA和蛋白表达的量与对照组相比逐渐上调,差异有统计学意义(P均<0.01)。Pearson分析显示Notch1、Hes1、PTEN的蛋白表达与药物浓度呈正相关关系(r=0.694、0.937、0.982,P<0.05和P<0.01)(见图5)。
2.7 siRNA沉默Notch1、Hes1和PTEN后对下游靶基因和蛋白的影响
阴性 siRNA转染细胞后,相应蛋白表达与空白组相比无差异(P均>0.05),siRNA成功转染细胞后,相应蛋白表达下调,与空白组相比有差异(P均<0.01)。沉默Notch1后,si Notch1+ 芳姜黄酮组Hes1的mRNA和蛋白表达与加药组相比下调,差异有统计学意义(P<0.01);沉默Hes1表达后,si Hes1+ 芳姜黄酮组PTEN的mRNA和蛋白表达与加药组相比下调,差异有统计学意义(P<0.01)(见图6)。
2.8 沉默PTEN对芳姜黄酮促凋亡作用的影响
空白对照组凋亡率(0.00±0.00)% 和阴性对照组凋亡率(0.01±0.00)% 无差异(P>0.05)。沉默PTEN后,在20 mg/L芳姜黄酮的作用下,A431细胞的凋亡率为(3.78±0.29)%,高于阴性对照组,差异有统计学意义(P<0.01),但是低于单纯用药组(9.23±0.65)%,差异有统计学意义(P<0.01)(见图7)。
3 结论
姜黄挥发油是姜黄的主要成分,本团队在前期研究中已经证实姜黄挥发油可以通过调节casepase 3、casepase 9、survivin等凋亡相关蛋白的表达促进皮肤鳞状细胞癌细胞的凋亡[7-8]。芳姜黄酮是姜黄挥发油的有效部位之一,其含量在姜黄挥发油中达到30%以上[9],姜黄挥发油促进皮肤鳞癌细胞凋亡的作用是否涉及芳姜黄酮,目前尚不明确。本研究表明,芳姜黄酮对皮肤鳞癌A431细胞起到一定的抑制增殖和促进凋亡的作用,并对相关机制进行了深入探讨。

图5 芳姜黄酮(0、20、40、80 mg/L)作用于A431细胞后对Notch1、Hes1和PTEN mRNA及蛋白表达的影响Fig.5 Effects of Ar-Turmerone (0,20,40,80 mg/L) on the expression of Notch1,Hes1,PTEN mRNA and protein注:A:real-time PCR检测Notch1,Hes1 和 PTEN mRNA的表达;B:Western blot检测Notch1,Hes1 和 PTEN蛋白表达;C:蛋白表达量的定量分析;D:药物浓度与蛋白表达量的pearson相关性分析。A,C:与对照组相比,*P<0.05,**P<0.01。Note:A:real-time PCR detects the mRNA expression of A431 cells Notch1、Hes1 and PTEN;B:Western blot detects the protein expression of A431 cells Notch1,Hes1 and PTEN;C:Quantitative analysis of protein expression.D:Pearson correlation analysis between drug concentration and protein expression;A,C:Compared with the control group,*P<0.05,**P<0.01.
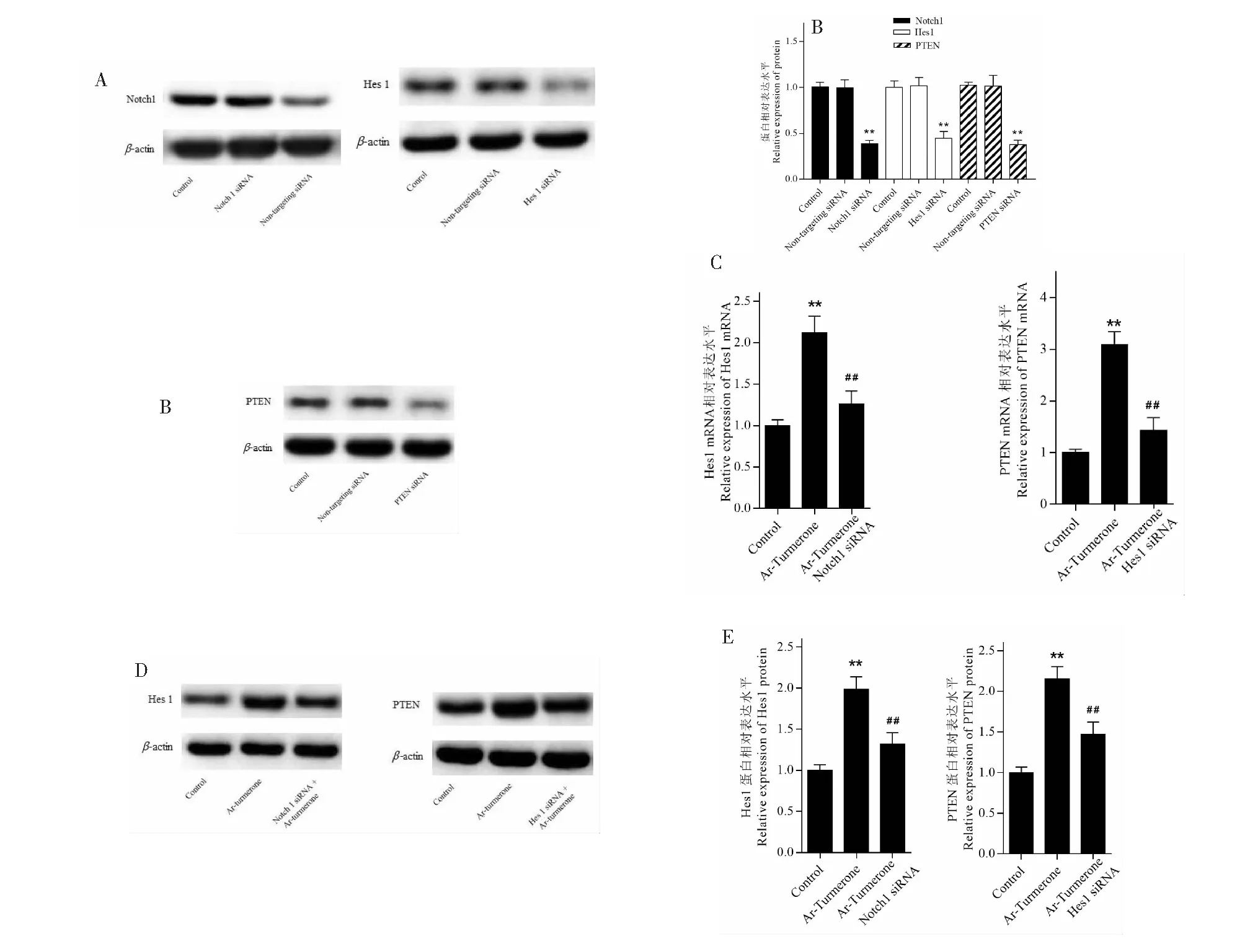
图6 siRNA沉默Notch1、Hes1和PTEN后对下游靶基因、蛋白的影响Fig.6 Effects of lower Notch1,Hes1 and PTEN expression on the expression of Notch1,Hes1 and PTEN mRNA and protein注:A,B:Western blot检测Notch1,Hes1和 PTEN沉默后对应的蛋白表达变化;C,D,E:real-time PCR和Western blot检测Notch1沉默后芳姜黄酮对Hes1 mRNA和蛋白的表达影响及 Hes1沉默后芳姜黄酮对PTEN mRNA和蛋白的表达;B,C,E:**P<0.01。Note:A,B:Western blot detects the lower expression of Notch1,Hes1 and PTEN,the protein expression of A431 cells Notch1,Hes1 and PTEN; C,D,E:real-time PCR and Western blot detects the effects of lower expression Notch1 on the expression of mRNA and protein Hes1 and the lower expression of Hes1 on the expression of mRNA and protein of PTEN ;B,C,E:**P<0.01.
此研究中,通过CCK-8实验检发现芳姜黄酮对皮肤鳞癌A431细胞的增殖具有抑制作用,并且呈现一定的时间-剂量依赖性,低剂量即有较明显的抑制作用。细胞凋亡时是以DNA的降解为特征,可以观察到核固缩、核碎裂、核溶解等现象。通过吉姆萨染色,倒置显微镜下可观察到随药物浓度的增加,细胞逐渐失去正常形态,细胞间隙增加,黏附性降低,细胞核出现固缩,核碎裂形成的碎片逐渐增多,说明芳姜黄酮具有诱导细胞凋亡的作用。同时,流式细胞仪检测细胞凋亡发现,随药物浓度的增加,A431细胞早期凋亡和晚期凋亡的细胞数量也逐渐增多,进一步说明了芳姜黄酮具有促进A431细胞凋亡的作用。细胞迁移和侵袭实验表明,随药物浓度的增加,作用时间的延长,芳姜黄酮可以一定程度上抑制肿瘤细胞的迁移和侵袭。本实验在研究芳姜黄酮对A431细胞迁移、侵袭的影响时,所选择的药物浓度为5、10 mg/L,作用时间为24、48 h。但当药物浓度为5、10 mg/L时,作用48 h后的增殖抑制率分别为(14.12±0.66)% 和(27.07±1.60)% ,细胞增殖在较小程度上受到抑制,可能对迁移和侵袭的实验结果有所影响,但结合多项实验数据,研究者仍然认为芳姜黄酮可以一定程度上抑制肿瘤细胞的迁移和侵袭。

图7 沉默PTEN后细胞凋亡率图(芳姜黄酮20 mg/L,48 h)Fig.7 A431 cell apoptotic rate affected by the lower expression of PTEN(Ar-Turmerone 20 mg/L,48 h)注:A:空白对照组;B:阴性对照组;C:芳姜黄酮浓度为20 mg/L时的凋亡图像;D:PTEN被抑制后,芳姜黄酮浓度为20 mg/L时的凋亡图像。Note:A:Blank control group;B:Negative control group;C:Ar-Turmerone 20 mg/L group apoptotic rate;D:The lower expression of PTEN,and Ar-Turmerone 20 mg/L group apoptotic rate.
细胞凋亡的发生取决于促凋亡和抑凋亡成员的相对浓度。Notch 基因最早于1917年由 Thomas Hunt Morgan 在果蝇中发现,因其功能的部分缺失会在果蝇翅膀的边缘造成切迹而命名[10]。Notch信号通路是一个在进化上十分保守的跨膜受体蛋白家族,Notch信号通路的激活在控制细胞的增殖、凋亡、迁移、侵袭等方面发挥着重要作用[11,12]。在过去十年的研究中发现,Notch信号通路相关蛋白在急性T淋巴细胞白血病、宫颈癌及乳腺癌中都有相关表达。毛秋霞等[13]学者曾研究报道,Notch蛋白表达的异常与银屑病、恶性黑色素瘤、炎症性皮肤病等多种皮肤疾病相关;而Notch信号通路的缺失可能导致皮肤鳞状细胞癌的发生[14,15]。Zhang M等[16]学者研究发现,皮肤鳞癌细胞中Notch1表达和激活水平均较低。Hes1是Notch1的下游靶基因,其活化和抑制均受到Notch1的调控。PTEN为一种新发现的抑癌基因,其调控受到多种因素的影响。Kim SJ等[17]研究发现,可通过调节Notch信号通路影响PTEN的表达,从而抑制胃癌的发生。因此,芳姜黄酮是否通过Notch1/ Hes1/ PTEN信号通路促使皮肤鳞状细胞癌A431细胞凋亡是值得探讨的问题。本研究通过siRNA质粒沉默Notch1基因和Hes1基因,用合适的药物浓度干预转染后的细胞,检测基因和蛋白表达的变化。在成功沉默Notch1后,Hes1的基因和蛋白表达量明显下调,而在沉默Hes1后,PTEN的基因和蛋白表达量也呈下调趋势,同样沉默PTEN后,流式细胞仪检测细胞凋亡率与对照组相比明显下降。因此,研究者认为芳姜黄酮可能是激活了Notch1,进而导致Hes1和PTEN的激活,发挥促进肿瘤细胞凋亡的作用。
综上所述,本研究发现芳姜黄酮不仅能够抑制A431细胞的增殖,诱导其凋亡,还能够抑制其侵袭和转移的能力。综上所述,Notch1/Hes1/PTEN途径的激活是芳姜黄酮诱导皮肤鳞状细胞癌A431细胞凋亡可能的机制,实验丰富了芳姜黄酮在皮肤肿瘤的治疗上应用的理论基础,为治疗皮肤鳞癌提供了新的作用靶点。
