色素添加对咖啡金黄水母体色影响的初步研究
2019-05-30杨翠华王文章陈华增齐继光
杨翠华,王文章,陈华增,齐继光
(青岛海洋科技馆,山东 青岛 266003 )
咖啡金黄水母(Chrysaoramelanaster)又称咖啡海刺水母,属刺胞动物门、钵水母纲、旗口水母目、游水母科、金黄水母属。主要生活在日本的白令海,在我国未见报道。虽然该水母中胶层薄,食用价值低,但其外形优美,游姿优雅,具极高的观赏性,近年来许多水族馆对其进行人工饲养、繁殖和展示[1-2]。
根据笔者多年饲养发现,目前在高密度人工养殖条件下,多种水母出现了身体褪色和状态下降等问题,严重降低了观赏价值,增加了繁育成本。杨翠华等[3]认为,巴布亚硝水母(Mastigiaspapua)的外观颜色是体内胶蓝蛋白、虫黄藻(Zooxanthella)和环境光线之间相互作用的结果。在人工养殖条件下,这种平衡会被破坏,导致水母颜色发生改变。因此,目前迫切需要对水母的着色与变色机理进行探讨,找到养殖条件下水母变色的原因,并加以解决,从而使养殖品种体色更接近天然品种,提高观赏价值。
鱼类的体色主要是由一类称之为类胡萝卜素的色素决定,黑色素、嘌呤和虹彩细胞等也参与体色形成,同时体色也与鱼的生理状态和环境因素等有关[4-5]。但是,水母的体色细胞及相关的显色机理研究尚未见报道。笔者参照鱼体色的相关资料,结合多年的水母饲养经验和咖啡金黄水母自身的特点,开展本次研究,观察色素添加剂对水母体色的影响,并探讨体内酪氨酸酶活力、总类胡萝卜素含量等指标与外观体色的相关程度,以期解决人工饲养水母色泽变暗的问题,对水母增色机理得出初步结论,得到观赏性强的水母个体,为探究水母色素细胞的发育机制提供参考。
1 材料与方法
1.1 材料
1.1.1 试验动物
试验用咖啡金黄水母为青岛海洋科技馆繁育60 d的水母成体。水母饲养在0.6 m3水体的循环缸内,试验用水经过黑暗沉淀、砂滤、臭氧、活性炭预处理,水温18~20 ℃,盐度32~33,pH 7.5~8.2,每周测定1次水质,保证NO2-≤0.01 mL/L,NH4+≤0.1 mL/L,每日于10:00、14:00投喂,基础饵料为卤虫(Artemia)无节幼体、水母颗粒饵料和海月水母(Aureliaaurita)汁体积1∶1∶1的混合物。
1.1.2 试验试剂及其使用方法
1.1.2.1 人工食用色素
胭脂红、柠檬黄、亮蓝和果绿4种色素由广东省东莞市御豪食品有限公司(生产许可证编号: QS441901040493)生产。用饲喂吸管将人工食用色素滴在水母口腕部,2 mL/只。
1.1.2.2 水溶性荧光色素
人工水溶性荧光色素荧光红、荧光黄、荧光蓝、荧光绿由南京聚恩科技有限公司生产。试验时,用注射器将4种色素分别注入水母胃囊,2 mL/只。
1.1.2.3 虾青素
美国CareNet公司生产的美国时刻原装进口天然虾青素(雨生红球藻中提取),即3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素。试验时,6 mg虾青素粉末与20 g基础饵料混匀,含量为300 mg/kg,用吸管投喂在水母的口腕部。
1.1.2.4 FeSO4
攀枝花市韦东工贸有限公司生产的分析纯级FeSO4·7H2O。19.86 mg FeSO4·7H2O与20 g基础饵料混匀,Fe2+含量为200 mg/kg,用吸管投喂在水母的口腕部。
1.1.2.5 海蜇
每次称取90 g青岛海洋科技馆繁殖饲养的90日龄海蜇(Rhopilemaesculentum)(图1),切成2~3 cm3碎块,均匀放在水母口腕部,自主采食。
图1 人工饲养90 d的海蜇
1.2 试验方法
随机将360只60日龄的试验水母分为对照组、食用色素组(4种色素)、水溶性荧光色素组(4种色素)、虾青素组、FeSO4组和海蜇组,观察不同处理后的水母外观体色、酪氨酸酶活力和总类胡萝卜素含量的变化。水溶性荧光色素组仅在试验第1 d注射1次荧光色素,正常饲喂基础饵料1个月,其余处理组日投喂2次,连续1个月。
1.3 试验指标测定方法
1.3.1 酪氨酸酶活力
取水母伞部或者口腕部3 g,加入1 mL pH 6.0的PBS缓冲液,冰冻匀浆,匀浆液在冰冻离心机上8000 r/min离心5 min,取上清液作为粗酶液(总溶液大于2 mL)。
取1 mg/mL L-酪氨酸0.5 mL,加入28 ℃预热的2 mL酪氨酸酶粗酶液,总反应体积为2.5 mL,混合后立即室温下于UV5100紫外分光光度计490 nm处测定吸光度(OD0),10 min后再测吸光度值(OD10)。按下式计算酶活力值:
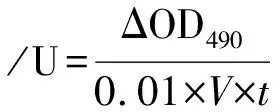
ΔOD490=OD10-OD0
式中,V为样品体积,t为时间。
1.3.2 总类胡萝卜素含量的测定
准确称取3 g鲜样品于25 mL棕色容量瓶中。加入7.5 mL浸提液(无水乙醇∶丙酮=5∶5),盖上塞子并旋转振摇1 min。用移液管加入1 mL 40%KOH甲醇—水溶液(称取200 g KOH溶解于50 mL水,用甲醇定容至500 mL)于容量瓶中,旋转振摇1 min,将容量瓶于55.5 ℃水浴上加热20 min,在容量瓶颈接上空气冷凝装置以防止溶剂损失。冷却样品,于暗处放置1 h。加入7.5 mL正己烷,旋转振摇1 min,以10%硫酸钠溶液定容,猛烈振摇1 min。于暗处静置1 h后,将上层液放入1 cm比色皿中,以正己烷、丙酮混合液为空白对照(加盖防止丙酮挥发),在UV5100紫外分光光度计下300~800 nm波长范围内进行扫描,找出最大吸收峰所处的波长,在该波长下测定各组提取液的吸光值。测定标准质量浓度类胡萝卜素,获得本试验的摩尔消光系数。
总类胡萝卜素含量/mg·kg-1=(A×K×V)/(E×G)
式中,A为吸光度,K为稀释倍数,V为提取液体积,E为摩尔消光系数,G为样品质量。
1.4 数据处理
采用Excel 2010软件处理数据,计算测定指标的平均值±标准差,对数据进行正态分布检验和方差齐性检验。使用SPSS 19.0统计软件进行单因素方差分析,Duncan法进行多重比较,显著性水平为0.05。
2 结果与分析
2.1 水母体色变化
水母口腕部接触人工食用色素后,在3~10 min色素到达胃囊腔,并沿辐管快速扩散。果绿色、胭脂红色和柠檬黄色染色水母体色晶莹透亮,亮蓝色颜色略暗,但是4种色素均大大提升水母的观赏性(图2)。15~20 min后,水母通过伞部的辐管和触手将色素开始排入水中,排出色素的过程持续2~3 h。口腕部主要是吸收色素,伞部辐管只能排出色素,仅有很少色素通过口腕部和触手排出。色素的吸收和排出时间与色素种类无关,仅与接触色素的部位相关。3 h后,每组水母均恢复原来的体色,4种色素间无差异,水母状态未发现改变。30 d后水母全部存活,体色和状态与未饲喂色素的水母(对照组)(图2a)无明显差异。

图2 饲喂人工食用色素后咖啡金黄水母体色变化a.繁育60 d未饲喂色素的水母,b.饲喂果绿色素的水母,c.饲喂亮蓝色素的水母,d.饲喂胭脂红色素的水母,e.饲喂柠檬黄色素的水母.
水母口腕部接触水溶性荧光色素后,不能将色素吸收到胃囊腔,但可以用2 mL注射器通过水母十字型口将荧光色素直接注入。荧光色素注入胃囊腔后,积聚在一起,10 h后才能通过水循环扩散到全身。注入荧光色素第1 d的效果见图3。荧光染料对水母染色效果明显,在第10 d时仍能很好地保持色素颜色,并且不影响流水母采食和存活,其状态未发现明显改变。至第15 d,水母体色逐渐变浅,但仍能观察到荧光色素的颜色,并且未对水母状态产生影响(图4)。30 d试验结束时,水母体仍能观察到少许颜色,水母体态和大小与对照组无明显差异。

图3 饲喂水溶性荧光色素第1 d咖啡金黄水母体色变化a.荧光绿,b.荧光蓝,c.荧光红,d.荧光黄.
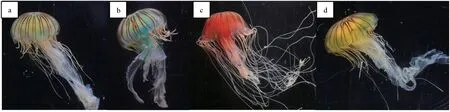
图4 饲喂水溶性荧光色素第15 d咖啡金黄水母体色变化a.荧光绿,b.荧光蓝,c.荧光红,d.荧光黄.
咖啡金黄水母添加天然虾青素、FeSO4和含有色素的海蜇30 d后,海蜇组的水母(图5)比对照组颜色要深,而虾青素组(图6)、FeSO4组(图7)的水母与对照组差异不明显。结果表明,人工添加色素能获得颜色各异的水母,水溶性荧光色素能长期保存在动物体内,可以作为染色色素,长期饲喂海蜇能够维持自然状态的体色,而添加虾青素和FeSO4不能改善人工繁育水母的体色。

图5 饲喂海蜇30 d的水母

图6 添加虾青素30 d的水母

图7 添加FeSO430 d的水母
2.2 各处理组水母体内酪氨酸酶活力和总胡萝卜素含量
试验结果显示,各组水母酪氨酸酶活力均较低,最高为海蜇组的0.133 U/mL(表1),可能与咖啡金黄水母色素仅分布于外伞表面、色素含量较少有关。食用色素组和荧光色素组水母虽然体色鲜亮,但是因为色素并未在表皮和中胶层形成色素沉淀,因此本结果中两项指标均与对照组差异不显著(P>0.05)。添加虾青素未显著改变水母的体色,在本试验中,虾青素组酪氨酸酶活力最低,仅为0.109 U/mL。各组内个体间酪氨酸酶活力差异较大,FeSO4组和海蜇组的标准偏差大于测量平均值,并且6个样本出现负值。各组间差异不显著(P>0.05)。
经过分光光度计波长扫描,咖啡金黄水母中总胡萝卜素在450 nm处吸光值最高。本方法中,海蜇组总胡萝卜素含量最高,为251.01 mg/kg,与对照组差异显著(P<0.05)。食用色素组总胡萝卜素含量最低,酪氨酸酶活力仅高于虾青素组,但与对照组差异均不显著(P>0.05)。荧光色素组、虾青素组、FeSO4组和对照组差异均不显著(P>0.05)。

表1 4组水母酪氨酸酶活力和总胡萝卜素含量
3 讨 论
3.1 人工食用色素对水母体色的影响
本试验中所用的4种色素均为人工合成的化学色素。胭脂红、柠檬黄为偶氮类水溶性色素,亮蓝是非偶氮色素,而果绿是柠檬黄和亮蓝的混合物。胭脂红给予大鼠口服时,大部分3~6 h后在盲肠和肝脏内被还原成1-氨基萘-4-磺酸和1-氨基-2-萘酚-6,8-二磺酸(NA),被吸收的色素经胆道排泄[6]。兔经口摄入柠檬黄,48 h后分析尿液,得到原形色素(1%)、对氨基苯磺酸(74%)和对乙酞氨基苯磺酸(22%),而对氨基苯磺酸正是合成柠檬黄的原料[7]。这表明胭脂红和柠檬黄在大鼠及兔体内均很快被分解排出,难以在体内积累。由于亮蓝色素易挥发并且稳定性差,在自然光照条件下,极易被氧化分解,很难被机体消化吸收[8]。将该4种食用色素以2‰的比例加入基础饲料中投喂金鱼110 d,对体色无显著影响[9]。
本试验表明,4种人工食用色素可在短期内明显改变试验水母体色,但会随水循环快速代谢到外界,长期投喂也不能被水母吸收或吸收量甚微。正如色泽鲜艳的鱼饲料仅能短期增加鱼的观赏性一样[9],虽然市面上有各种颜色的水母饵料,但本试验证明,通过添加人工食用色素改变水母体色的方法是难以达到持续维持的。咖啡金黄水母分为伞部和口腕部,本试验色素的流动证明,口腕部和伞部的触手不仅是采食器官,同时也具有排泄功能,消化后的食物转化为液体或者细小颗粒,除主要通过伞部的辐管排出体外,少部分也能通过口腕部和伞部的触手排泄。
3.2 水溶性荧光色素对水母体色的影响
荧光色素可分为碱性、酸性和中性荧光色素。本试验用到的为中性的人工合成荧光色素,主要用于彩绘涂鸦、手工创意礼品、夜间警示、印染等领域,为生物不可分解物质。本试验中荧光色素可以长期保存在水母胃囊内,对水母体的染色时间较长。注射后,荧光色素中水溶性部分携带部分小分子色素快速扩散,油溶性部分逐渐形成大颗粒,1 d后随食物扩散到整个胃囊腔、辐管、触手和口腕部,染色效果明显,可保持30 d以上。并且因为色素在水母体内以大颗粒状态存在,因此对水母采食、游动等无影响。本方法简单易操作,在实践中可提高水母的观赏性,可用于水母染色。
3.3 虾青素对水母体色的影响
虾青素进入动物体后,可以不经修饰或生物转化而直接贮存、沉淀在组织中,并可与肌动蛋白非特异性结合。汪洪涛等[10]认为,虾青素在金鱼体内以酯化形式沉淀,不同添加量和饲养时间对金鱼的色素沉积有着极为显著的影响。Booth等[11]研究表明,在澳大利亚金赤鲷(Pagrusauratus)饵料中添加虾青素,72 mg/kg虾青素组较36 mg/kg虾青素组更易增加体色,但是两者在饲喂6周和9周后皮肤颜色达到一致。本试验中,添加虾青素组水母状态、游动能力和生长速度较其他组强,与野生水母接近,说明虾青素能促进水母的生长,增强水母的体质。但虾青素组的酪氨酸酶活力和总胡萝卜素含量均较低,说明与其他水产动物和家禽类不同[12],水母体内不含有肌动蛋白,因此短期添加虾青素并不能改善水母体色。
3.4 FeSO4和海蜇对水母体色的影响
铁是动物机体最必需的微量元素之一,它的主要功能是构成血红蛋白,参与氧气的运输,是肌红蛋白及细胞色素酶、过氧化物酶等的必需组成成分。影响日粮中铁吸收的主要因素是有机和无机铁的比例。动物源性饲料,如鱼粉和肉粉中铁的含量比较高,约为400~800 mg/kg,油类作物中含铁100~200 mg/kg,谷物中含铁30~60 mg/kg[13]。刘希光等[14]测定了新鲜海蜇皮、海蜇头、生殖腺的含水量分别为95.89%、96.39%和96.09%,并利用JY38S型顺序扫描电感耦合等离子体发射光谱仪测定了上述部位新鲜海蜇样品中铁的含量分别为0.06、0.07、0.83 μg/L。
养殖条件下,许多水产动物体色会发生变化,如黄颡鱼(Pelteobagrusfulvidraco)[15]、胡子鲇(Clariasfuscus)[16]等。本试验在不添加外源色素的条件下,通过添加FeSO4,观察微量元素铁的补充对水母体表色素的影响。结果表明,添加外源性铁对水母体色影响较小。饲喂海蜇能使水母体色加深,可能与海蜇含有色素有关,也可能是由于海蜇通过影响水母酶代谢等途径促进了水母铁的吸收和色素的沉积。
3.5 酪氨酸酶活力对水母体色的影响
动物体色与黑色素沉淀密切相关,酪氨酸酶在黑色素生成过程中起关键作用。在鱼体内,酪氨酸在酪氨酸酶的作用下生成多巴,再经过一系列的生化反应,最终生成黑色素。目前研究表明,黑色素不能正常形成主要有以下几种原因[13]:
一是黑素细胞形态正常,但细胞中黑色素体的分布发生变化,这是动物短时间处于浅色背景、或光线较强等条件下发生的应激反应。当这些条件解除后,动物体色也恢复正常。在多年饲养过程中,笔者发现,水母体色与温度、光照、背景等外部环境相关[3],但这是一个长期过程,水母很少出现体色的骤然变化。
二是黑素细胞的生长状态发生剧烈变化,细胞出现衰老、死亡,表现在黑素细胞树突状分支逐渐消失或减少、细胞萎缩,逐渐凋亡,这种变化通常使动物体色发生不可逆转的变化。咖啡金黄水母在不同生长阶段颜色表现不同,刚刚分裂的碟状体呈红色,水母幼体为无色透明状,而水母成体外伞具18~24条咖啡色条纹,同时触手和口腕部呈咖啡色[1],日龄越大,水母颜色越深,说明生长过程中有黑色素生成和积累。
三是黑素细胞的分化、增殖受到影响,生物合成发生障碍,使成熟的黑素细胞数量显著减少。本试验中,添加海蜇组水母体色眼观有明显加深,而虾青素虽然能增强水母的状态,使水母生长速度加快,但是外观颜色未发生改变。FeSO4组各项指标均较对照组无显著差异。各组水母酪氨酸酶活力较低且差异不显著,对照组仅为(0.126±0.093) U/mL,而黄颡鱼血清中酪氨酸酶活力为(2.16±0.528) U/mL[15],可能与水母色素仅仅分布于外伞表面,并且合成数量较少有关。
3.6 类胡萝卜素对水母体色的影响
机体颜色浓淡的变化,是由于细胞内色素的集中、分散以及色素细胞数量的多少决定的。观赏鱼的丰富色彩可以通过含类胡萝卜素的食物链而获得。向枭等[17]报道,在红剑尾鱼(Xiphophorushelleri)和花玛丽鱼(Molliensiavelifera)养殖中添加50 mg/kg的类胡萝卜素能有效地改善鱼的体色,提高其观赏价值。用添加100 mg/kg虾青素的饵料投喂虹鳟(Oncorhynchusmykiss)4周,血清总类胡萝卜素含量(1.83 μg/mL)极显著高于对照组(0.25 μg/mL)[18]。
本试验咖啡金黄水母中的类胡萝卜素在450 nm处有最大吸收值,与向枭等[17]测定的鱼类类胡萝卜素在450 nm处有最大吸收值相同,说明两者含有的类胡萝卜素种类类似。本试验中,海蜇组咖啡金黄水母体色最深,测定的酪氨酸酶活力和类胡萝卜素含量也最高,说明水母的色素合成、沉淀可能与这两项指标有关。
在日常饲养过程中,决定水母质量和状态的不仅仅是体色,实践证明,微量元素的合理补充对高质量的饲养仍是必须的,对水母体内类胡萝卜素的积累也是有利的。
