基于牛蒡根的灵芝固体发酵菌质化学成分的初步分析*
2019-05-30张命龙杨秋玲阚慧建王志宏陈智勇彭密军
张命龙 ,杨秋玲 ,阚慧建 ,王志宏 ,陈智勇 ,彭密军 **
(1.广东省测试分析研究所广东省分析测试技术公共实验室,广东 广州 510070;2.广东中测食品化妆品安全评价中心有限公司,广东 中山 528437;3.中山业成生物科技有限公司,广东 中山 528437)
灵芝(Ganoderma lingzhiS.H.Wu et al.)为名贵大型真菌之一,具有较高的食用和药用价值[1]。目前灵芝多糖和三萜类化合物成分被公认为灵芝中主要的药理活性成分[2-3]。灵芝在临床应用上也表现出良好的疗效[4]。最近药理研究显示灵芝三萜类化合物成分可延缓遗传性多囊肾病(ADPKD) 的发展[5];灵芝孢子油具有保护心脏的功能,可作为潜在的心脏病保护剂[6]。
牛蒡(Arctium lappaL.)属菊科(Asteraceae)植物,全株均可入药。牛蒡根(burdock root)系牛蒡的主要用药部位,是一种天然的食药兼用资源,富含多糖、膳食纤维、黄酮、蛋白质、氨基酸等[7-9]。近年来连续有关于牛蒡根药理活性新的报道。研究发现牛蒡根具有降血糖[10-11]、抗炎症[12]、改善脂质代谢等作用[13]。
药用真菌的固体发酵是现代生物工程技术的重要领域。庄毅[14]指出药用真菌双向型固体发酵是一个新的起点,其区别于传统的固体发酵中营养基质单向为真菌提高碳氮源等营养成分。双向固体发酵以中药材为基质,真菌菌丝体从中吸收营养,同时又改变药性成分,具有双向性,可实现中药材的二次开发,对原中药材起到“增效”、“扩用”、“减毒”效果,具有显著优势[15]。灵芝作为木腐真菌,菌丝体活力高,分解能力强。牛蒡根经灵芝菌丝体发酵后,菌质化学成分较原药材的变化情况尚不明晰。故本研究对牛蒡根经灵芝固体发酵的药性菌质化学成分进行初步分析,以期为开发这一新型发酵产物提供理论依据。
1 材料与方法
1.1 供试材料
牛蒡根和牛蒡根灵芝发酵菌质,由中山业成生物科技有限公司提供。将牛蒡根切成小段,烘干,加水浸润,搅拌均匀,装入栽培袋中,盖上棉塞包扎,于121℃灭菌50 min。冷却后,在无菌条件接入灵芝菌种,于24℃~28℃避光培养,待发酵至菌丝满袋后,取出,于60℃~70℃烘干后粉碎即得牛蒡根灵芝菌质。
1.2 主要试剂和仪器
葡萄糖、苯酚、浓硫酸、乙醇等试剂均为国产分析纯,甲醇为色谱级,美国Merck公司;灵芝酸B,上海同田公司,纯度98%;胞苷,加拿大Trc公司,纯度98%;尿苷,加拿大Trc公司,纯度98%;鸟苷,中国食品药品检定研究院,纯度93.6%;腺苷,美国Sigma公司,纯度99.8%;芦丁,中国食品药品检定研究院,纯度98%;绿原酸,上海阿拉丁生化公司,纯度98%。
AS20500BT超声波仪,天津奥特赛恩斯公司;UV2700紫外可见分光光度计,日本岛津公司;LC-20A高效液相色谱仪,日本岛津公司;N310全自动定氮仪,广州格丹纳公司。
1.3 方法
1.3.1 多糖含量检测
采用苯酚-硫酸法[16]进行测定。
(1) 标准曲线制作
精密称取葡萄糖(105℃下干燥2 h) 49.95 mg于500 mL容量瓶中,加纯水至满刻度后摇匀。分别吸取 0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL对照品品溶液于比色管中,补水至1.0 mL,加入5%苯酚0.5 mL和浓硫酸2.5 mL,充分摇匀。室温放置20 min后于分光光度计488 nm处测定吸光值,以1.0 mL蒸馏水按同样显色操作为空白,以葡萄糖含量(μg·mL-1)为横坐标,吸光值为纵坐标制作标准曲线,得回归方程Y=0.014 0X-0.038 0,R2=0.999 7。
(2) 样品测试
精密称取粉碎后均匀样品1 g于具塞试管中,加25 mL纯水,摇匀,采用沸水浴提取2 h,冷却后过滤,在残渣中加20 mL纯水再提取1 h,过滤合并2次滤液,残渣用少量水洗涤2次,洗涤液并入容量瓶中,定容至50 mL,充分摇匀。取1 mL提取液加入4倍体积无水乙醇,混匀,4℃静置过夜。次日离心弃上清,沉淀物用80%乙醇洗涤数次后,溶解待测。吸取样液1 mL,按照上述标曲步骤操作测定吸光值,代入回归方程中计算样品多糖含量。
1.3.2 总三萜酸含量检测
参考文献 [17]方法进行测定。
(1) 标准曲线制作
精密称取灵芝酸B对照品,用无水乙醇溶解,配制成 511.6 μg·mL-1的对照品溶液。分别吸取 0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.5 mL 对照品溶液,加入浓度为50%的浓硫酸乙醇溶液2 mL,以溶剂做空白,沸水浴5 min,取出用流水速冷,30 min内于分光光度计526 nm处测定吸光值。以对照品质量(μg)为横坐标,吸光度为纵坐标制作标准曲线,得回归方程Y=0.000 7X-0.038 7,R2=0.998 1。
(2) 样品测试
称取2 g样品,加入无水乙醇,参照文献 [17]中规定的方法制备供试样品。按上述制作标准曲线方法进行样品显色,测定526 nm处吸光值,代入回归方程中计算样品中总三萜酸含量。
1.3.3 总黄酮含量检测
(1) 标准曲线制作
参考文献 [18]方法制作标准曲线。精密称取芦丁6.00 mg于容量瓶,加甲醇定容至10 mL,配制成约600 μg·mL-1的对照品溶液。吸取不同体积的对照溶液于比色管中,加入30%乙醇溶液定容至5 mL,再加入0.3 mL浓度为5%的亚硝酸钠溶液,摇匀后放置5 min,加入0.3 mL浓度为10%的硝酸铝溶液,摇匀后静置1 h,最后加入4 mL1.0 mol·L-1的氢氧化钠溶液,用30%乙醇溶液定容至10 mL,以溶剂为空白。于510 nm波长下测定吸光值,按对照品质量(μg)与吸光值的关系,制作标准曲线,得回归方程Y=0.001 33X+0.004 75,R2=0.999 9。
(2) 样品测试
参考文献 [19],取2 g样品,加入浓度为42.2%的乙醇溶液,按液料比40∶1,于82℃、浸提3.5 h的条件提取1次,冷却定容至100 mL。取适量样液离心后按制作标准曲线方法进行样品显色,代入回归方程中计算总黄酮含量。
1.3.4 核苷含量检测
参考文献 [20]方法进行测定。
(1) 色谱条件
色谱柱为 Aglient TC-C18柱 (4.6 mm×250 mm,5 μm)。流动相为水-甲醇:0~20 min,甲醇5%;35 min,甲醇20%;36 min,甲醇5%;40 min,甲醇5%。流速:1.0 mL·min-1,进样量 10 μL,紫外检测器,波长259 nm,柱温30℃。
(2) 标准曲线制作
分别精密称量5.00 mg左右的4种核苷对照品,置于25 mL容量瓶中,加纯水溶解并定容,制成约200 μg·mL-1的核苷混合标准品母液。配制6个不同浓度的混合标准品工作液,按上述色谱条件测试。通过单个核苷对照品确定各自色谱峰保留时间,以核苷标准品浓度对相应峰面积绘制标准曲线,得回归方程(表4)。
(3)样品制备和分析
精密称取各样品0.5 g,置于10 mL具塞试管中,加入10 mL纯水,密塞。混匀后,超声(500 W,40 kHz)提取1 h。取出试管冷却至室温,摇匀后取适量提取液4 000 r·min-1离心10 min。上清液过0.45 μm微孔滤膜,转移至进样瓶中,按给定色谱条件进行HPLC分析。
1.3.5 蛋白质含量检测
蛋白质含量的测定参照GB 5009.5-2016食品安全国家标准食品中蛋白质进行测定(凯氏定氮法)[21]。
1.3.6 HPLC 指纹图谱
参照参考文献 [22]进行HPLC指纹图谱分析。精密称取适量绿原酸对照品,用甲醇配置成105.2 μg·mL-1的对照品溶液。色谱条件:Aglient TC-C18柱 (4.6 mm×250 mm,5 μm);流动相 0.04%磷酸溶液-甲醇:0,甲醇15%;30 min,甲醇38%;60 min,甲醇 38%。流速 1.0 mL·min-1,进样量 10 μL,紫外检测器,波长320 nm,柱温30℃。称取1 g样品加入甲醇超声(500 W,40 kHz) 提取1 h,减压蒸干,用甲醇溶解定容10 mL。过滤后,上机分析。将色谱图导入“中药色谱指纹图谱相似度评价系统(2004版)”[23]进行处理。
1.4 数据分析
试验数据以平均值±标准误表示。用统计分析软件SPSS 19.0对数据进行单因素方差分析。
2 结果与分析
2.1 多糖含量
牛蒡根和牛蒡根灵芝发酵菌质中多糖含量的检测结果见表1。

表1 牛蒡根和牛蒡根发酵菌质中多糖含量Tab.1 Content of polysaccharides in burdock root and burdock root fermentation fungal substance(n=3)
由表1可知,发酵前,牛蒡根中多糖含量为9.94%,经灵芝菌丝发酵后多糖降至 2.76%(P<0.01),大幅降低72.2%。由此推测,灵芝菌丝体在生长过程中,大量分解利用了牛蒡根中的多糖成分,为生命活动提供能量。这提示灵芝除可直接利用葡萄糖、蔗糖、淀粉外源性的碳源外,还可利用植物材料中的多糖碳源物质,实现菌丝体生长和生物转化。
2.2 总三萜酸含量
牛蒡根和牛蒡根灵芝发酵菌质中总三萜酸含量的检测结果见表2。
三萜酸是灵芝三萜类化合物中主要药效成分[24]。由表2可知,发酵前,牛蒡根中未检出三萜酸。发酵后,牛蒡根灵芝菌质中出现了三萜酸,含量达到0.14 mg·g-1。于华峥等[25]运用 HPLC 法测定灵芝子实体、菌丝体和孢子粉中多种灵芝三萜类成分,结果显示灵芝菌丝体中也含有灵芝三萜酸,主要为灵芝酸S和灵芝酸T,两者之和为0.74 mg·g-1,但未检出灵芝酸A和灵芝酸B。对于牛蒡根灵芝发酵菌质具体为何种灵芝三萜酸成分还需分离鉴定。

表2 牛蒡根和牛蒡根发酵菌质中总三萜酸含量Tab.2 Content of triterpenic acids in burdock root and burdock root fermentation fungal substance(n=3)
2.3 总黄酮含量
牛蒡根和牛蒡根灵芝发酵菌质中总黄酮含量的检测结果见表3。

表3 牛蒡根和牛蒡根发酵菌质中总黄酮含量Tab.3 Content of total flavonoids in burdock root and burdock root fermentation fungal substance(n=3)
由表3可知,发酵前,牛蒡根总黄酮含量为3.47%。除多糖外,黄酮类化合物也是牛蒡根主要活性成分,如槲皮素、山奈酚、木犀草素[26]。发酵后,牛蒡根灵芝发酵菌质中总黄酮含量降低至0.34%(P<0.01)。这说明,灵芝菌丝吸收牛蒡根的营养成分生长时,同时也显著降低牛蒡根中的黄酮类成分含量。
2.4 核苷含量
牛蒡根和牛蒡根灵芝发酵菌质中核苷含量的检测结果见表4、表5和图1。
表4为核苷混合标准品的线性方程。图1为标准品和测试样品的色谱图。由图1可知,样品中4种核苷的色谱峰与杂质峰分离效果较好,保留时间适中。表5为样品中4种核苷的含量。发酵前,牛蒡根中未检出腺苷,3 种核苷总量为 861.05 μg·g-1;发酵后,牛蒡根灵芝发酵菌质中同时含有4种核苷,其中胞苷 (cytidine) 含量降低 (P<0.01)、尿苷(uridine) 和鸟苷 (guanosine) 含量增加 (P<0.01),腺苷 (adenosine) 含量为 208.80 μg·g-1,核苷总量增加至 1 113.49 μg·g-1(P<0.01)。王金艳等[20]全面分析了龙泉、黄山等4个产地灵芝孢子粉多种核苷含量,发现黄山灵芝孢子粉中此4种核苷含量最丰富,总量为 715.62 μg·g-1。可见,牛蒡根灵芝发酵菌质4种核苷的含量远高于灵芝孢子粉。
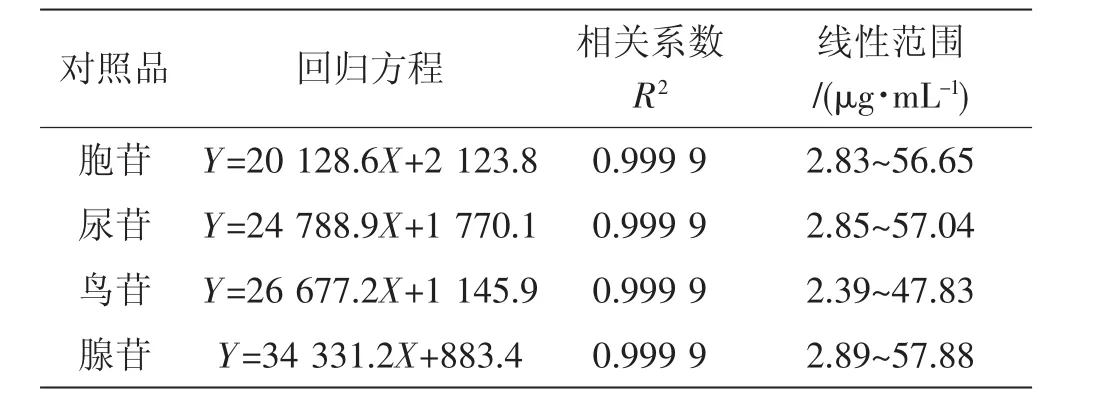
表4 4种核苷的线性回归方程Tab.4 Linear regression equation of four nucleosides

表5 牛蒡根和牛蒡根发酵菌质中三萜含量Tab.5 Content of nucleosides in burdock root and burdock root fermentation fungal substance(n=3)
同时由图1的色谱图可知,10 min~15 min出现多个色谱峰,说明相对牛蒡根,牛蒡根灵芝发酵菌质中产生了新的成分。在28 min左右牛蒡根灵芝发酵菌质的色谱峰较牛蒡根色谱峰高度显著降低,说明该成分的含量大幅降低。结果表明,灵芝菌丝体发酵使牛蒡根的水溶性成分出现有增有减的变化。其原因可能是灵芝菌丝体的生理代谢活动产生多种酶,通过生物催化导致这些成分出现变化。
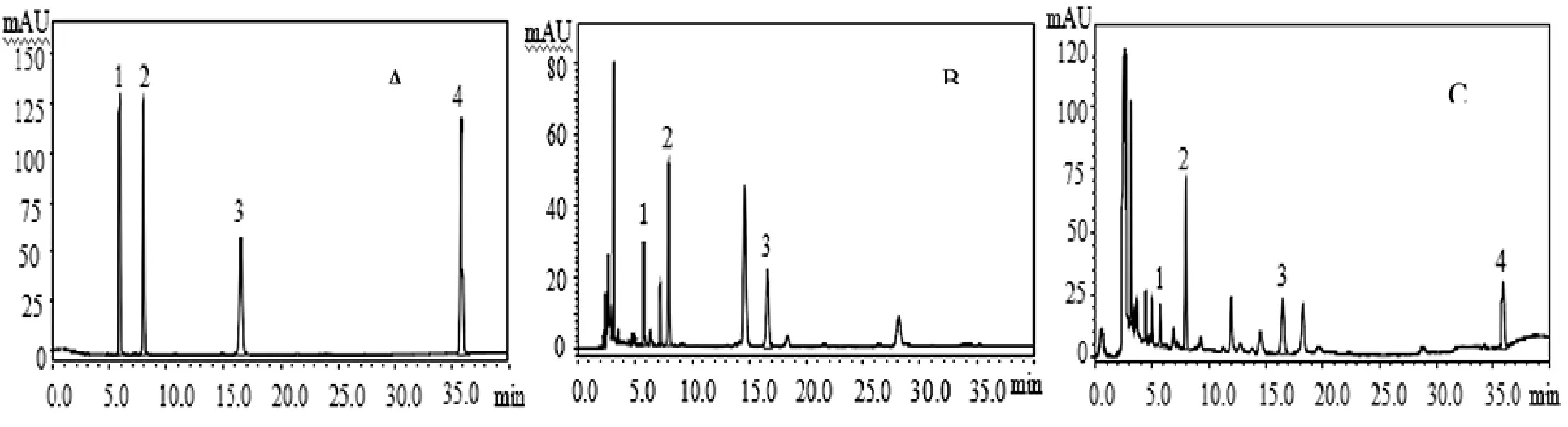
图1 混合对照品与样品高效液相色谱图Fig.1 HPLC chromatogram of mixture standards and samples
2.5 蛋白质含量
牛蒡根和牛蒡根灵芝发酵菌质中蛋白质含量结果见表6。
由表6可知,牛蒡根经灵芝菌丝体发酵后,蛋白质含量提高了 29.14% (P<0.01)。虽然菌丝生长需要消耗氮源,会利用牛蒡根中的蛋白质,但可能因自身合成代谢强于分解代谢,导致发酵后菌质中的蛋白质含量增加。这表明灵芝菌丝体可通过发酵实现植物蛋白质的转化。

表6 牛蒡根和牛蒡根发酵菌质中蛋白质含量Tab.6 Content of protein in burdock root and burdock root fermentation fungal substance(n=3)
2.6 HPLC指纹图谱比较
以绿原酸为对照品,牛蒡根和牛蒡根灵芝发酵菌质的HPLC指纹图谱如图2所示。
由图2可以看出,发酵前,牛蒡根醇提液的色谱峰(S2)较多,并且含有绿原酸色谱峰。发酵后,在色谱图前10 min,牛蒡根发酵灵芝菌质(S3) 和牛蒡根的峰相似度较高;而在第10分钟后,牛蒡根灵芝发酵菌质的图谱中几乎没有明显的色谱峰,并且不再有绿原酸色谱峰。由此可知,牛蒡根在发酵前后的HPLC指纹图谱相似度很低。结果表明,灵芝菌丝体发酵明显改变了牛蒡根的某些化学成分,可能被分解或被结构修饰、转化。
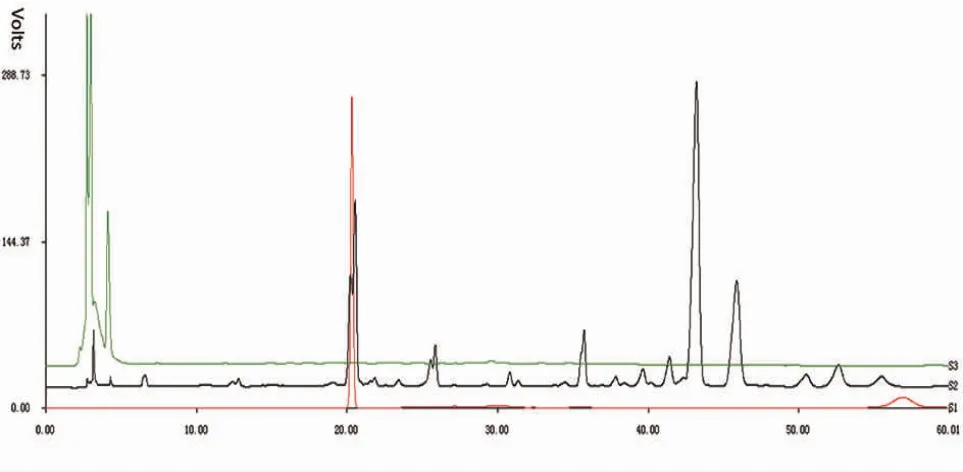
图2 HPLC指纹图谱Fig.2 HPLC fingerprint
3 讨论
综合运用分光光度法、HPLC法、凯氏定氮法对牛蒡根经灵芝菌丝体发酵前后多种成分进行了较为全面的对比分析。发酵后其多糖和黄酮含量显著降低,核苷含量显著升高,并新产生腺苷和三萜酸类物质;蛋白质含量显著升高。HPLC指纹图谱显示发酵前后成分相差较大。结果表明牛蒡根经灵芝菌丝体发酵后原药材的成分发生了较大变化,体现了真菌发酵中药材的双向效果。何斌[27]发现丹参经灵芝双向发酵后的药性菌质在活血化瘀和增强免疫方面的药效优于丹参原药材,这说明灵芝发酵起到了“增效”作用。此外灵芝双向发酵钩吻根后,菌质有毒生物碱化合物含量降低,毒性降低,药效稳定,起到“减毒存效”作用[28]。对于牛蒡根灵芝发酵菌质相对牛蒡根原药材是否具有“增效、扩用”的优势,本课题组将适时开展相关药理药效实验予以验证。
牛蒡苷元是牛蒡子的主要活性成分,而牛蒡根中通常不含牛蒡苷元或含量极低[29],笔者尝试去检测发酵前后的样品,均未检测到牛蒡苷元。这表明灵芝菌丝体在发酵过程中不能产生牛蒡苷元。同时采用HPLC法检测牛蒡根灵芝发酵菌质中灵芝酸A、灵芝酸B的含量,也未检出。目前被发现的灵芝三萜类化合物已超过160种[3],至于牛蒡根灵芝发酵菌质中是否存在新型三萜类化合物还有待后续分离鉴定。
目前药用真菌发酵菌质在医药领域已有应用。槐耳菌质就是槐耳菌(Trametes robinioplilaMur.)在玉米、麦麸等营养基质上经培养后所得的干燥菌质(即药用菌质),已被批准为国家中药一类新药,具有扶正固本、活血消症的功效。槐耳菌分别在营养基质与药性基质上发酵产生药用与药性两种菌质,通过对其药效比较,证实药性菌质出现了“增效、扩用”的理想结果[16]。今后随着真菌双向固体发酵研究的深入及其应用不断发展,可能会出现更多通过发酵中药材制得药性菌质的真菌。因此,灵芝的应用范围将由子实体、孢子粉、菌丝体拓展到通过与中药材组合进行双向发酵的菌质原料,具有重要的实践意义和应用价值。在此过程中阐明了发酵过程的生物转化机制,明确了活性物质和活性之间的构效关系,可为更好地合理利用灵芝双向发酵菌质资源提供理论依据。
