气相色谱-质谱法测定酱猪蹄和酱猪肘中5种胆固醇氧化物
2019-05-29张雅玮彭增起周光宏
钱 烨,张雅玮,王 震,尹 敬,彭增起*,周光宏
(1. 南京农业大学食品科技学院, 江苏 南京 210095; 2. 食品安全与营养协同创新中心, 江苏 南京 210095)
猪肉富含胆固醇,胆固醇是由甾体部分和一条长的侧链组成,甾体的四个环通常用A、B、C、D进行编号[1]。新鲜猪肉中胆固醇氧化物(COPs)含量极低[2],但一经加工处理,如腌制、加热、光照以及长时期贮存等,猪肉中的胆固醇极易在A环、B环或侧链发生氧化而形成COPs[3,4]。目前研究表明,COPs可能有70余种,但大多数因自身极不稳定而并不常见[5]。食品中常见的COPs有7-酮基胆固醇、7α-羟基胆固醇、7β-羟基胆固醇、5α,6α-环氧化胆固醇、5β, 6β-环氧化胆固醇、胆甾烷-3β,5α,6β-三醇、20-羟基胆固醇和25-羟基胆固醇等[5]。医学研究结果表明,食源性胆固醇氧化物会对健康造成一定损害,具有细胞毒性[6],并会导致血管动脉粥状硬化、癌症以及神经系统疾病的发生[7]。
COPs的检测方法主要有气相色谱-质谱法[8-10]、气相色谱法[11-13]、高效液相色谱法[14,15]、液相色谱-质谱法[16]。其中,液相色谱仪的分离效果和所使用的色谱柱容量达不到COPs的分离要求[17],并且大多数胆固醇氧化物无紫外吸收和荧光,无法采用紫外或者荧光检测器进行检测[18]。液相色谱-质谱法由于设备价格昂贵,因此用于分析COPs的研究报道较少。气相色谱法在COPs上的应用较多,大多采用氢火焰离子化检测器进行检测[11,13,19]。而气相色谱-质谱技术兼顾了气相色谱的高分辨率和质谱的高灵敏度,能够有效分离和检测复杂化合物[20]。目前,我国对胆固醇及其代谢物的研究均有报道[21],但对肉制品中胆固醇氧化物研究较少,并且还未对胆固醇氧化物的分析方法建立统一的标准,所以有必要建立快速准确高效分析食品中胆固醇氧化物的检测方法。本研究建立了气相色谱-质谱技术测定酱猪肉中5种COPs(7β-羟基胆固醇、5α,6α-环氧化胆固醇、胆甾烷-3β,5α,6β-三醇、25-羟基胆固醇和7-酮基胆固醇)含量的方法,为评价酱猪肉制品的安全性提供了依据。
1 实验部分
1.1 仪器、试剂与材料
Bruker 450GC-320MS型气相色谱-质谱仪(美国Bruker Daltonics公司); LB20ES型高速组织捣碎机(美国Waring Blender公司); LGJ-10C型冷冻干燥机(北京四环科学仪器厂有限公司); SYC-2101型水平摇床(美国精骐有限公司); RE-52AA型旋转蒸发器(上海研承仪器有限公司); SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂); SBEQ-CR1012型固相萃取装置(德国CNW公司); DC-12H型氮吹仪(上海安谱科学仪器有限公司); KQ2200DE型数控超声波清洗器(昆山市超声仪器有限公司); WH-2微型旋涡混合仪(上海沪西分析仪器厂有限公司); Secura125-1CN型十万分之一电子天平(德国Sartorius公司)。SPE硅胶柱(500 mg/6 mL,美国Supelco公司)。
5种COPs标准品:7β-羟基胆固醇、25-羟基胆固醇、胆甾烷-3β,5α,6β-三醇(加拿大Toronto Research Chemicals公司); 7-酮基胆固醇(美国Santa Cruz Biotechnology公司); 5α,6α-环氧化胆固醇(梯希爱上海化成工业发展有限公司)。衍生剂N,O-双(三甲基硅基)乙酰胺-三甲基氯硅烷-三甲基硅基咪唑(3∶2∶3, v/v/v)(Sylon BTZ,美国Supelco公司)。乙酸乙酯和吡啶(色谱纯,上海阿拉丁生化科技股份有限公司)。其余试剂:石油醚、甲醇、氯仿、正己烷、无水乙醚、丙酮、无水硫酸钠、氢氧化钾,均为国产分析纯。
4.5月龄左右的三元猪前肘购于南京市玄武区童卫路农贸市场。酱猪蹄(编号1~4)和酱猪肘(编号5~8)产品购于北京、山东、无锡3个地区,每种产品购买3个批次(n=3)。8种产品的配料、保质期及包装方式见附表1(详见http://www.chrom-China.com)。
1.2 标准溶液的配制
分别称取5种COPs标准品各2 mg,置于50 mL容量瓶中,溶于乙酸乙酯中,并定容至50 mL,制得40 mg/L COPs混合标准溶液(于4 ℃低温避光保存),再用乙酸乙酯稀释成不同质量浓度的系列标准溶液,5α,6α-环氧化胆固醇浓度梯度为0.4、0.8、4、12和20 mg/L,其余4种COPs浓度梯度均为0.06、0.1、0.8、4、12和20 mg/L,。
取1 mL标准溶液,用氮气吹扫浓缩至近干,溶解于1 mL无水吡啶中,移取50 μL,置于250 μL内衬管中,再加入50 μL Sylon BTZ,漩涡混合10 s,于25 ℃避光衍生化1 h,取1 μL用于GC-MS分析,建立标准曲线。
1.3 样品前处理
将样品用组织捣碎机绞碎成糜状,准确称取5.0 g肉糜,冻干36 h后加入30 mL甲醇-氯仿(1∶2, v/v)混合液,振荡萃取30 min。然后加入0.5 g无水硫酸钠,滤纸过滤,除去残余水分。滤液在40 ℃真空条件下蒸发至干后溶解于5 mL正己烷中,用0.45 μm有机滤膜过滤,得到提取液。
硅胶柱用15 mL正己烷活化,将提取液全部上样,过柱后弃去,然后依次用10 mL正己烷-乙醚(95∶5, v/v)、25 mL正己烷-乙醚(90∶10, v/v)和15 mL正己烷-乙醚(80∶20, v/v)溶剂淋洗,抽干,最后用5 mL丙酮洗脱,洗脱液收集于10 mL离心管中,用氮气吹扫浓缩至近干,用1 mL无水吡啶溶解,过0.2 μm有机滤膜,移取50 μL滤液,置于250 μL内衬管中,再加入50 μL Sylon BTZ,漩涡混合10 s,将此混合物置于25 ℃避光衍生化1 h,取1 μL用于GC-MS分析。
1.4 色谱-质谱条件
色谱柱为HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度为280 ℃;载气(氦气)流速为0.8 ml/min;进样模式为不分流进样;柱温升温程序:初始温度220 ℃,保持1 min,以15 ℃/min的速率升至270 ℃,保持1 min,再以1 ℃/min的速率升至280 ℃,保持2 min,再以5 ℃/min的速率升至290 ℃,保持10 min。进样体积为1 μL。
离子源为电子轰击电离(EI)源;离子源温度为220 ℃;电离能量为70 eV; GC-MS接口温度为270 ℃;检测模式为选择离子扫描(SIM)模式;电子倍增管电压为1 360 V。其他质谱采集参数见表1。
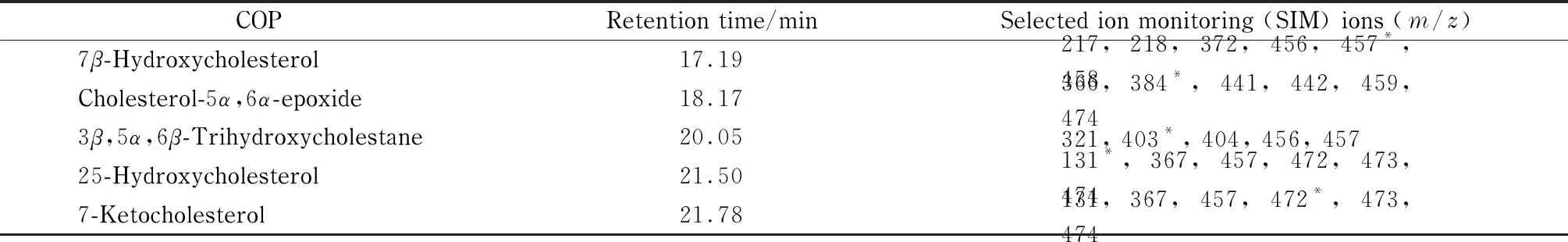
表 1 5种COPs的GC-MS采集参数
* Quantitative ion.
2 结果与讨论
2.1 色谱-质谱条件的选择
2.1.1程序升温条件的选择
根据文献中采取的升温程序以及相应的保留时间可知,COPs在色谱柱温度达到200 ℃以上才能被检出,表明经衍生化处理后COPs的沸点仍然较高[22,23]。COPs结构相似,保留时间较接近,过快的升温速率会导致其分离效果降低。经试验反复优化,得到1.4节的柱温升温程序。对5种COPs的混合标准溶液进行定性分析,监测模式为全扫描模式,得到5种COPs的总离子流色谱图(见图1)。对各个色谱峰进行库检索,得到7β-羟基胆固醇、5α,6α-环氧化胆固醇、胆甾烷-3β,5α,6β-三醇、25-羟基胆固醇、7-酮基胆固醇的保留时间分别为17.19、18.17、20.05、21.50和21.78 min, 5种COPs可在22 min内完成分离,且分离度较好,因此可以采用该升温程序。

图 1 5种COPs混合标准溶液(2 mg/L)的总离子流色谱图Fig. 1 Total ion current chromatogram of of the fiveCOPs mixed standard solution (2 mg/L) 1. 7β-hydroxycholesterol; 2. cholesterol-5α,6α-epoxide; 3. 3β,5α,6β-trihydroxycholestane; 4. 25-hydroxycholesterol; 5. 7-ketocholesterol.
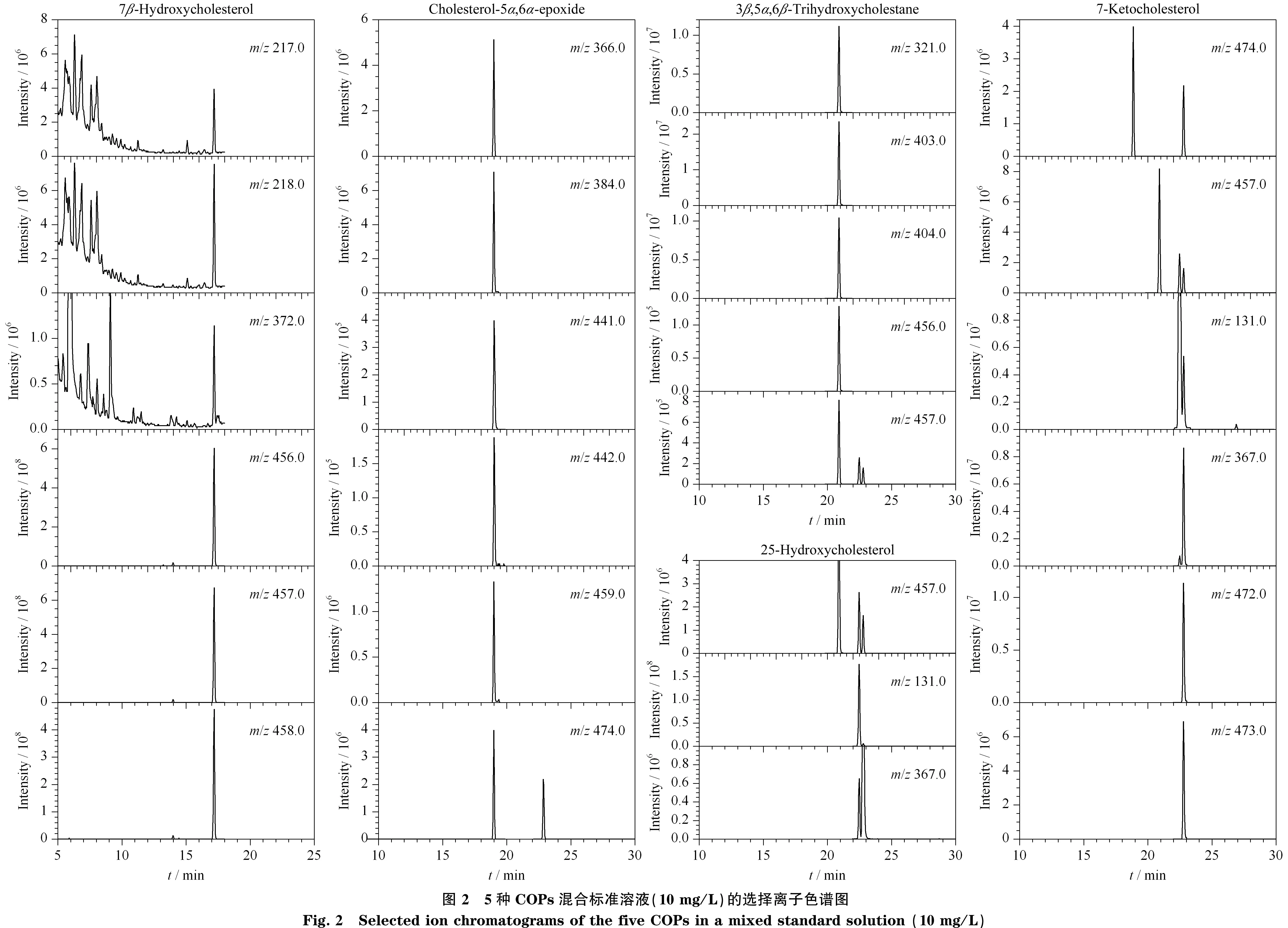
2.1.2质谱检测模式的选择
由于COPs在食品中的含量较低,且食品成分复杂,若采用全扫描模式检测样品中的COPs,易受到杂质干扰,因此采用选择离子扫描模式,对各COPs的主要离子进行检测(见图2),可有效降低杂质干扰,增加检测灵敏度。各COPs经衍生化后,主要离子差异较大,若单以一组离子进行5种COPs的检测,则所要选取的离子数目过多,灵敏度较低。因此,可以根据各物质的主要离子,以及全扫描所得到的保留时间,将其分为4组,每组扫描5~6种离子。第一组为0~18 min,检测7β-羟基胆固醇;第二组为18~19 min,检测5α,6α-环氧化胆固醇;第三组为19~21 min,检测胆甾烷-3β,5α,6β-三醇;第四组为21 min至层析结束,检测25-羟基胆固醇和7-酮基胆固醇。选择峰面积最大的离子作为各物质的定量离子,如图2所示,分别为m/z457、384、403、131、472的离子。
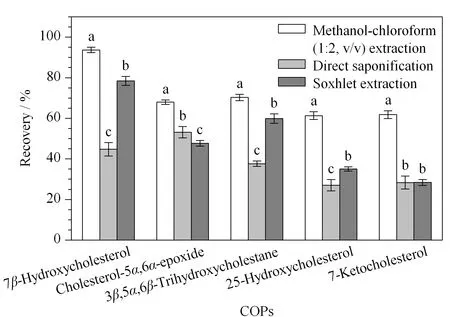
图 3 不同提取方法对5种COPs回收率的影响(n=3)Fig. 3 Influences of different extraction methodson the recoveries of the five COPs (n=3) Different letters in the same COP indicated significant differences between the different extraction methods.
2.2 样品前处理方法的选择
2.2.1提取方法的选择
根据报道,使用最频繁的提取方法是将2种或者3种溶剂以不同的比例混合,充分提取不同极性的脂类物质,同时将其他非脂类物质去除,避免提取液基质的复杂性,最常用的提取溶剂是甲醇-氯仿(1∶2, v/v)[24]。Tatiana等[25]提出直接对食品基质进行皂化处理,皂化处理能使基质中主要的酰基甘油转化成水溶性的羧酸盐和游离甘油,从而得以去除,最后提取出COPs等不皂化物。过高的皂化温度会增加胆固醇被氧化和胆固醇氧化物被再次氧化的可能性[26],所以目前多采用冷皂化方式,即在25 ℃条件下反应18~22 h,然后提取出非皂化物质[27]。索氏抽提法是常用的提取粗脂肪的方法,具有易操作、稳定性好等优点,是公认的经典方法。实验结果表明,用甲醇-氯仿(1∶2, v/v)萃取比直接皂化法和索氏抽提法更高效(见图3)。采用甲醇-氯仿(1∶2, v/v)萃取时,5种COPs的回收率为61.31%~93.67%,显著高于直接皂化法和索氏抽提法(P<0.05)。Lozada-Castro等[15]研究发现,当采用直接皂化法提取火腿中的胆固醇氧化物时,易发生乳化反应,导致操作难以进行。Busch等[28]发现,直接皂化法不适用于肉制品等成分复杂的样品。方益等[29]提出,索氏抽提法由于在高温条件下进行,会造成胆固醇氧化物之间相互转化或分解,导致定量结果不准确。因此最终选用甲醇-氯仿(1∶2, v/v)萃取的方法进行提取。
2.2.2净化方法的选择
提取脂溶性物质后,通常采用SPE法或皂化-固相萃取法对提取物进行净化处理。在固相萃取前进行皂化处理可将粗脂肪提取物中的主要成分酰基甘油转化为水溶性的脂肪酸盐和游离甘油,从而得以去除,并且皂化反应可水解胆固醇酯,使结合态的胆固醇氧化物游离出来[23]。但实验结果表明,直接进行固相萃取时,COPs的回收率显著高于皂化-固相萃取法(P<0.05)(见图4)。采用皂化-固相萃取法时,7-酮基胆固醇的回收率仅为30.46%,这是由于皂化反应在碱溶液中进行,7-酮基胆固醇等不稳定的COPs极易发生分解[27]。Clariana等[30]也发现在冷皂化过程中,常常发生COPs的分解或转化,这可能是导致某些COPs在经皂化法净化后回收率较低的原因。固相萃取法能够将提取出的脂类物质如甘油三酯、胆固醇及其氧化物、磷脂等按照不同的极性分离,分离效率高。由图4可以看出,采用直接固相萃取法时,5种COPs的回收率为61.31%~93.67%,满足检测要求。因此最终没有采用皂化步骤,提取脂类物质后,直接采用固相萃取法进行样品的净化。

图 4 不同净化方法对5种COPs回收率的影响(n=3)Fig. 4 Influences of different purification methodson the recoveries of the five COPs (n=3) Different letters in the same COP indicated significant differences between the different purification methods.
2.3 方法学评价
2.3.1标准曲线、检出限与定量限
按1.2节配制系列标准溶液,以各组分定量离子的峰面积为纵坐标(y),质量浓度为横坐标(x, μg/L),绘制标准曲线。方法的检出限(LOD)和定量限(LOQ)定义为产生3倍和10倍信噪比(S/N)时化合物的质量浓度。选取一系列质量浓度较低的5种COPs混合标准溶液,按1.4节色谱-质谱条件进行分析检测,计算LOD和LOQ。结果表明,7β-羟基胆固醇、胆甾烷-3β,5α,6β-三醇、25-羟基胆固醇、7-酮基胆固醇在0.03~10 mg/L范围内呈现良好的线性关系,5α,6α-环氧化胆固醇在0.2~10 mg/L范围内呈现良好的线性关系;5种COPs的检出限和定量限分别为0.02~47.07 ng/g和0.06~156.90 ng/g(见表2)。实际样品中,单种胆固醇氧化物的含量一般为0~2.5 mg/kg,换算为进样浓度为0~6.25 mg/L,因此该方法的线性范围可满足实际样品的检测要求。

表 2 5种COPs的线性范围、相关系数(R2)、回归方程、检出限和定量限
y: peak area;x: mass concentration, μg/L.

表 3 空白生猪肉样品中5种COPs的加标回收率和精密度(n=3)
2.3.2回收率和精密度
选取新鲜猪前肘皮、皮下脂肪、瘦肉部分,分别制成肉糜,冻干后作为空白样品。添加浓度为高、中、低3个水平的COPs混合标准溶液1 mL,按1.3节和1.4节所述方法进行加标回收率测定,每个加标水平平行测定3次(n=3),结果显示,5种COPs的加标回收率为61.16%~96.96%,相对标准偏差≤7.80%(见表3),其精密度满足猪肘皮、皮下脂肪、瘦肉中COPs含量的检测要求。
2.4 实际样品检测
利用所建方法分析测定市售酱猪蹄和酱猪肘中COPs的含量。结果显示,酱猪蹄皮中COPs总量为422.1~1 083.3 ng/g,皮下组织中COPs总量为855.2~1 794.7 ng/g(见表4);酱猪肘皮中COPs总量为690.0~3 767.2 ng/g,皮下脂肪中COPs总量为538.9~4 275.1 ng/g,瘦肉中COPs总量为641.1~3 848.8 ng/g(见表5)。这与Chen等[31]的结果相似,其研究发现,加热24 h后酱猪蹄皮中COPs总量为1 497.8 ng/g,肉中COPs总量为1 565.5 ng/g。酱猪蹄肉中COPs含量显著高于皮中,可能是因为肉中血红素铁等金属离子含量较高,金属离子会促进电子转移,导致自由基的快速形成,胆固醇在自由基的攻击下发生氧化反应[32,33]。
皮下脂肪样品2和样品6中未检出5α,6α-环氧化胆固醇,瘦肉样品6中未检出胆甾烷-3β,5α,6β-三醇,产品中COPs种类和含量存在差异,可能与其加工方式和添加物不同有关。结合附表1可知,保质期长的产品中COPs总量显著高于保质期短的产品,这可能是因为保质期长的产品在高温杀菌过程中进行了二次加热,促进了COPs的形成。
3 结论
建立了气相色谱-质谱测定酱猪肉中5种COPs含量的检测方法。该方法的线性范围、检出限、定量限、回收率和精密度均能够满足实际样品的检测要求。通过对市售酱猪蹄和酱猪肘中COPs的测定,发现保质期长的产品中COPs含量显著高于保质期短的产品,该结果将为进一步研究传统酱卤猪肉制品的加工方式与危害,以及胆固醇氧化物的消减技术提供参考。
