新型亚微米亲水作用色谱的制备及其在加压毛细管电色谱中的应用
2019-05-29刘让东王薇薇
胡 静,刘让东,王薇薇,王 彦,闫 超
(上海交通大学药学院, 上海 200240)
近些年来,随着生物医药技术、食品安全和环境监测等研究领域的发展,强极性和亲水性小分子物质迅速成为药物、食品分析和生物化学等领域的重要研究对象。反相液相色谱(reversed-phase liquid chromatography, RPLC)作为一种色谱分析技术,被广泛应用于弱极性及中等极性化合物的分离分析,但强极性和亲水性化合物在RPLC上保留很弱,导致分离困难。
1990年,美国科学家Alpert[1]首次提出了亲水作用色谱(hydrophilic-interaction chromatography, HILIC)的概念,在此后的二十多年时间里,HILIC迅速发展,为分离强极性和亲水性化合物提供技术支持[2],在代谢组学[3]、药物分析[4,5]、食品分析[6]、中药现代化[7,8]、环境保护[9,10]等研究领域呈现出独特的优越性和极强潜力。
新型亲水作用固定相是亲水色谱领域的研究热点之一,离子型固定相表面可与不同性质的带电基团进行结合[11],具有很好的亲水作用。比如半胱氨酸是一种天然的两性离子化合物,Shen等[12]将其作为功能基团修饰在5 μm二氧化硅微球表面,在低聚糖、多肽及碱性化合物的分离中,表现出良好的分离选择性。
根据van Deemter方程,降低填料粒径大小能获得更好的分离柱效,但同时会带来反压过高的问题。加压毛细管电色谱(pressurized capillary electrochromatography, pCEC)拥有HPLC和CE的双重机理,采用压力流和电渗流同时推动样品和流动相[13],能够有效解决上述问题。本实验采用改良Stöber法合成580 nm粒径大小的二氧化硅亚微米填料,通过“巯基-烯”点击化学将L-半胱氨酸修饰在其表面,制备新型的亚微米亲水色谱填料,并以pCEC为平台,实现对核苷、酚类、胺类及多肽等极性化合物的分离,为极性及亲水性化合物的分离分析提供新的解决思路。
1 实验部分
1.1 仪器与试剂材料
TriSepTM-3000加压毛细管电色谱仪(美国Unimicro Technologies公司),包括溶剂输送系统、微流控系统、高压电源、柱上紫外检测器和数据采集系统;Vario EL Cube元素分析仪(德国Elementar公司); S-4800场发射扫描电镜(日本电子株式会社); SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司); DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司); KQ5200DE超声波清洗仪(昆山市超声仪器有限公司); DM36-12马弗炉(上海德恭实业有限公司); JD200-3电子天平(郑州南北仪器有限公司); TGL-16G高速离心机(上海安亭科学仪器厂); XW-80A涡旋混合器(上海青浦沪西仪器厂); Molcell 1805V摩尔细胞型纯水仪(重庆摩尔水处理设备有限公司)。
正硅酸四乙酯(tetraethylorthosilicate, TEOS)、甲苯、无水乙醇、氨水、吡啶、甲醇、丙烯酰胺、硫脲、苯酚、邻苯二酚、间苯三酚、对甲苯胺和N,N′-二甲基双丙烯酰胺均为分析纯(国药集团化学试剂公司);丙酮(分析纯,上海凌峰化学试剂有限公司);偶氮二异丁腈(azobisisobutyronitrile, AIBN,纯度99%,上海试四赫维化工有限公司);乙腈(色谱纯,Tedia公司);乙烯基三氯硅烷(vinyltrichlorosilane, VTMS,纯度98%)、L-半胱氨酸(纯度99%)、尿嘧啶(纯度98%)、胞嘧啶(纯度99%)、尿苷(纯度99%)、肌苷(纯度99%)、胞苷(纯度99%)和鸟苷(纯度99%)(北京百灵威科技有限公司);精氨酸加压素(纯度99%)、催产素(纯度98%)和Met-enkephalin肽(纯度98%)(生工生物工程(上海)股份有限公司);石英毛细管(100 μm i. d.,永年县锐沣色谱器件有限公司)。
1.2 亚微米单分散的二氧化硅微球的合成
580 nm亚微米单分散二氧化硅微球的合成:以文献[14]方法为基础,本试验的具体合成过程为:配置15 mL 28%(质量分数)的浓氨水、24.75 mL超纯水和一定体积无水乙醇的混合溶液,加入圆底烧瓶中,混合均匀,置于油浴锅控温搅拌,配置10 mL正硅酸四乙酯和无水乙醇的混合溶液,快速加入圆底烧瓶,高速搅拌1 min后降低搅拌速度,封口反应2 h。反应完毕后将反应液转移至烧杯中,用浓盐酸调pH至中性,超纯水浮选多次至超纯水层无明显悬浮颗粒为止。洗涤抽滤,于65 ℃烘箱中干燥过夜,马弗炉中煅烧3次,备用。
1.3 半胱氨酸功能基团的修饰
将经浓硝酸活化的580 nm亚微米二氧化硅微球混悬于无水甲苯中,依次加入VTMS、吡啶,常温下磁力搅拌反应12 h,反应结束后依次用乙醇、丙酮洗涤,抽滤,干燥,得到反应产物VTMS-SiO2。将适量VTMS-SiO2混悬于甲醇-水溶液中,加入半胱氨酸、AIBN,于65 ℃下反应24 h,反应结束后抽滤并依次用超纯水和甲醇清洗,得到反应产物Cys-VTMS-SiO2。
1.4 毛细管色谱柱的制备
截取一定长度100 μm内径的毛细管,活化,氮气吹干备用。采用高压匀浆法将水混悬的新型580 nm亚微米固定相Cys-VTMS-SiO2装入毛细管中,填充至所需有效长度,烧结柱塞和窗口,备用。

表 1 温度、搅拌速度和反应时间对微球粒径大小的影响
-: not detected.
2 结果与讨论
2.1 亚微米二氧化硅微球的制备与表征
2.1.1亚微米二氧化硅微球的合成优化
Stöber等[15]采用正硅酸四乙酯为原料合成硅颗粒,本实验室[14,16]通过一系列的条件优化,合成出了单分散亚微米二氧化硅微球。本实验将进一步优化实验方法,考察反应温度、搅拌速度和反应时间对合成结果的影响。其中,反应温度和搅拌速度对粒径大小影响显著(见表1)。反应1~6考察了反应温度对粒径大小的影响,反应温度低于20 ℃会产生团聚现象,在26 ℃后微球粒径大小随着温度的升高而逐渐降低。反应7~10考察了搅拌速度对粒径大小的影响,搅拌速度过快或过慢均不利于微球的生长,在650 r/min时粒径大小可达到(577±6) nm。反应11~13考察了反应时间对粒径大小的影响,结果表明,当微球生长到一定大小后反应时间不会对粒径产生显著影响。
在反应温度为26 ℃,搅拌速度为650 r/min,反应时间为2 h的条件下,合成580 nm亚微米二氧化硅微球,扫描电镜(SEM)图如图1所示,显示合成的微球表面光滑、粒径均匀且单分散。

图 1 580 nm亚微米二氧化硅微球的电镜扫描图Fig. 1 Scanning electron microscopy (SEM) imageof the 580 nm submicron SiO2particles
2.1.2亚微米二氧化硅微球的表面修饰与表征
进一步通过“巯基-烯”点击化学将半胱氨酸键合到亚微米二氧化硅微球表面,形成新型亲水作用色谱固定相,修饰路径见图2。
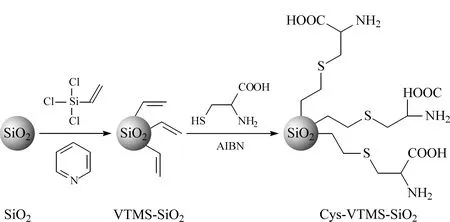
图 2 580 nm亚微米二氧化硅微球的L-半胱氨酸修饰的合成Fig. 2 Synthesis of L-cysteine modified580 nm submicron SiO2particles VTMS: vinyltrichlorosilane; AIBN: azobisisobutyronitrile.
采用元素分析法测定中间产物VTMS-SiO2和最后产物Cys-VTMS-SiO2的含碳量分别为0.35%和7.93%,说明半胱氨酸功能基团被成功键合到了微球表面。根据图3可知,该Cys-VTMS-SiO2微球的比表面积为8.383 m2/g,孔径为3.055 nm,总孔容积为0.023 m3/g。根据比表面积数据和元素分析结果计算得到该二氧化硅微球的碳载样量为157.66 μmol/m2。
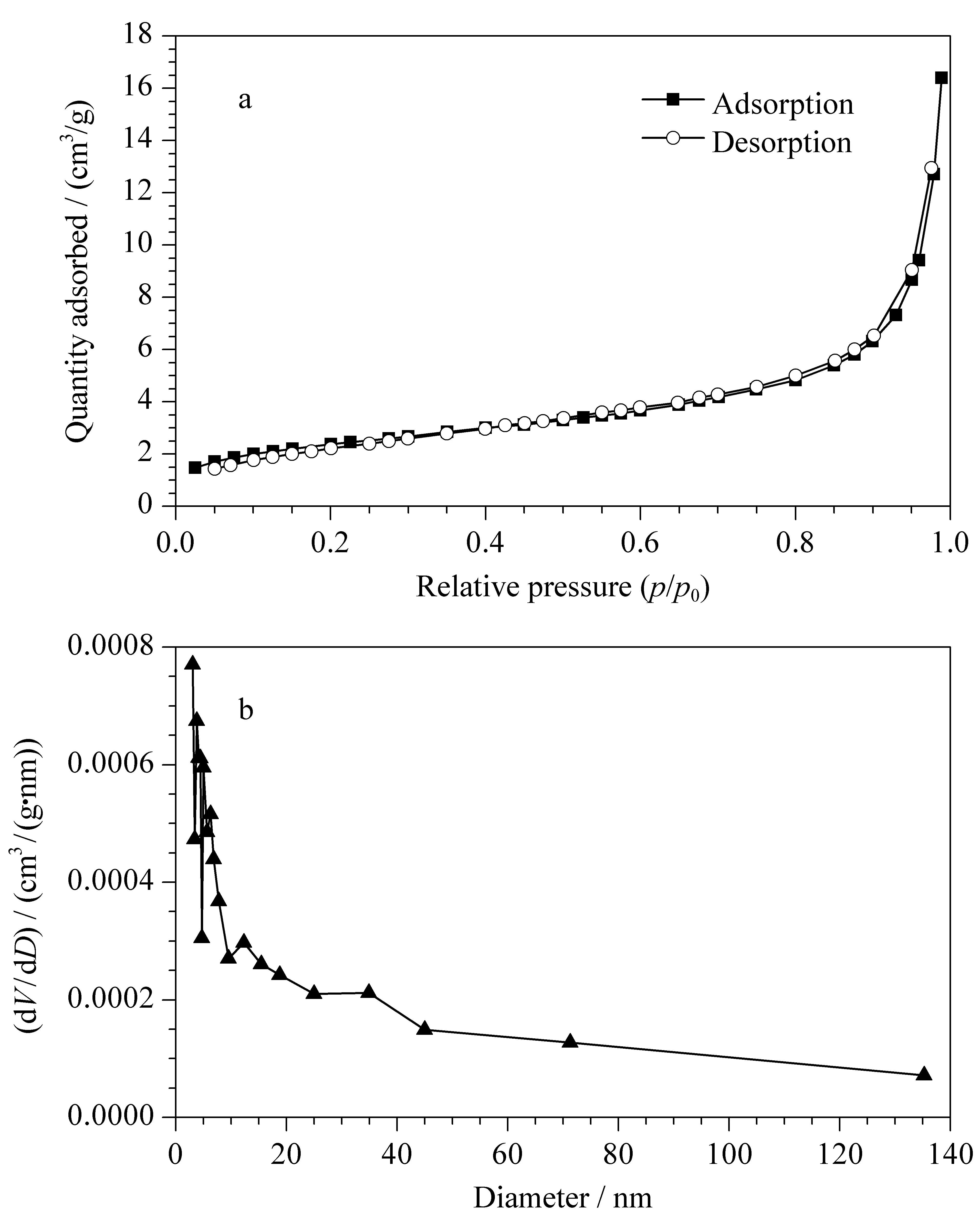
图 3 580 nm亚微米Cys-VTMS-SiO2的(a) N2吸附-解吸附图和(b)孔径分布图Fig. 3 (a) N2adsorption-desorption isotherm plot and (b) pore size distribution curve of the 580 nm submicron Cys-VTMS-SiO2
利用傅里叶红外仪对半胱氨酸修饰后的Cys-VTMS-SiO2微球进行表征,结果见图4。同纯SiO2微球相比,Cys-VTMS-SiO2的红外谱图出现很多新吸收峰。其中3 433.56 cm-1处的吸收峰为N-H伸缩振动,1 585.02 cm-1处的吸收峰为N-H面内弯曲振动,810.07 cm-1处的吸收峰为N-H面外弯曲振动,1 338.83 cm-1处的吸收峰为C-N伸缩振动,3 031.41 cm-1处的吸收峰为O-H伸缩振动,1 297.57 cm-1处的吸收峰为C-O伸缩振动,1 620.87 cm-1处的吸收峰为C=O伸缩振动,964.30 cm-1为C-S伸缩振动,这些吸收峰的存也反映了半胱氨酸功能基团的成功修饰。
将修饰好的580 nm亚微米Cys-VTMS-SiO2微球装入毛细管色谱柱中,如图5所示,色谱柱装填紧密,状态良好。

图 4 580 nm亚微米SiO2和Cys-VTMS-SiO2的傅里叶红外光谱图Fig. 4 FT-IR spectra of the 580 nm submicronSiO2and Cys-VTMS-SiO2

图 5 毛细管柱的电镜扫描图Fig. 5 SEM image of the capillary column
2.2 580 nm亚微米Cys-VTMS-SiO2色谱填料的亲水机理考察
为了考察580 nm亚微米Cys-VTMS-SiO2色谱填料的亲水作用分离机理,选择丙烯酰胺和硫脲两种物质为分离对象,测定保留时间与有机相浓度之间的关系,结果见图6。
在高有机相条件下(φ(ACN)>93%)下,丙烯酰胺和硫脲的保留呈现亲水相互作用的保留机理,即保留时间随有机相比例增加而增加;另外,这两个物质在亚微米Cys-VTMS-SiO2色谱柱上的出峰顺序也表现为极性小的丙烯酰胺先出峰,极性大的硫脲最后出峰,符合亲水色谱的机理。
2.3 580 nm亚微米Cys-VTMS-SiO2亲水色谱柱分离性能的考察
选用甲苯、丙烯酰胺和硫脲为分离对象,以毛细管液相色谱(cLC)和pCEC两种分离模式为平台,对本研究合成的亚微米Cys-VTMS-SiO2亲水色谱柱的分离性能进行考察。

图 6 580 nm亚微米Cys-VTMS-SiO2毛细管填充柱亲水作用机理考察Fig. 6 Investigation of hydrophilic mechanism on the 580 nm submicron Cys-VTMS-SiO2packed capillary column Column: 20 cm (effective length, 45 cm total length)×100 μm i. d.; mobile phase, pH 6.01 ACN/H2O containing 100 mmol/L ammonium formate solution; back pressure, 14.4 MPa; detection wavelength, 254 nm.
2.3.1施加电压和流速对分离的影响
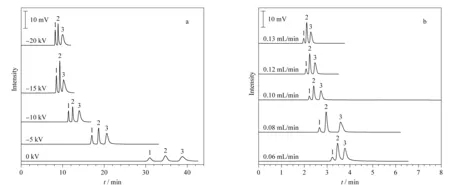
图 7 (a)电压和(b)流速对580 nm亚微米Cys-VTMS-SiO2毛细管填充柱分离的影响Fig. 7 Effects of (a) voltages and (b) flow rates on the separation of capillary column packed with580 nm submicron Cys-VTMS-SiO2 Column: 20 cm (effective length, 45 cm total length)×100 μm. (a) Mobile phase, ACN-H2O (98∶2, v/v) containing 100 mmol/L ammonium formate, pH 6.01; applied voltage, 0 to -15 kV; back pressure, 14.4 MPa; (b) mobile phase, ACN-H2O (96∶4, v/v) containing 100 mmol/L ammonium formate, pH 6.01; applied voltage, -15 kV; detection wavelength, 254 nm. Peak Nos.: 1. toluene; 2. acrylamide; 3. thiourea.
分别在cLC(0 kV)和pCEC(-5 kV到-20 kV)模式下对3种化合物进行分离,结果(见图7a)表明,施加电压能显著缩短保留时间,且电压越大,出峰时间越快。pCEC模式下,柱塞型电渗流驱动力和抛物线型压力流驱动力联合驱动样品的分离,大大提高了分离效率[12]。当施加电压达到-10 kV时,分离度达到最大值,但电压继续增加到-15 kV时,分离度又逐渐降低,可能是样品和固定相的作用时间减少及产生焦耳热所致,因此最终选择-10 kV电压对3种物质进行分离。
考察了流速对亚微米Cys-VTMS-SiO2亲水色谱柱分离性能的影响,结果(见图7b)表明,增加流速,分离时间缩短,分离度变化不大,综合考虑时间和分离度,选择0.08 mL/min为后续实验的流速值。
2.3.2缓冲盐浓度对分离的影响
在不同缓冲盐浓度条件下,3种物质均能达到基线分离(见图8a)。随着缓冲盐浓度的降低,分离度逐渐增大,但当甲酸铵缓冲盐浓度为5 mmol/L时,硫脲的峰形很宽且有拖尾现象;随着缓冲盐浓度的增加,峰形得到明显改善,达到100 mmol/L时峰形最佳,推测除了缓冲液浓度对电流的影响外,本文合成的亲水色谱填料表面的半胱氨酸可能具有一定的离子交换作用。
2.3.3缓冲液pH对分离的影响
分别采用pH=3.86、4.50、6.01和9.04的缓冲液分离甲苯、丙烯酰胺和硫脲。结果表明,3种物质在不同pH条件下均能达到基线分离,但分离度有所变化(见图8b)。从离子交换机理推测分离度改变的原因,由于色谱柱表面半胱氨酸的等电点为5.05,当pH值较低时弱阴离子交换的分离机制发挥作用;随着pH逐渐接近等电点,分离度逐渐变小(3种物质在pH 4.5的分离度小于pH 3.86);当pH大于等电点时,随着pH的增大,分离度不断增加,保留时间也逐渐变长,可能是因为弱阳离子交换的分离机制开始发挥作用。
2.3.4日内和日间重现性考察
采用甲苯、丙烯酰胺和硫脲为标记物,考察毛细管色谱柱的重现性,日内(n=6)保留时间的相对标准偏差分别是1.1%、0.8%和1.0%,峰面积的相对标准偏差分别为2.0%、1.1%和2.0%;日间(n=3)保留时间的相对标准偏差分别是1.1%、0.9%和1.0%,峰面积的相对标准偏差分别为0.5%、2.0%和2.0%。取3个批次的色谱柱,甲苯、丙烯酰胺和硫脲保留时间的相对标准偏差分别是0.8%、0.2%和1.2%,峰面积的相对标准偏差分别为3.8%、5.0%和2.0%。可见毛细管亲水Cys-VTMS-SiO2色谱柱在pCEC模式下具有良好的重现性,且该色谱柱制备方法重现性好,批次间的差异小,成功率高。
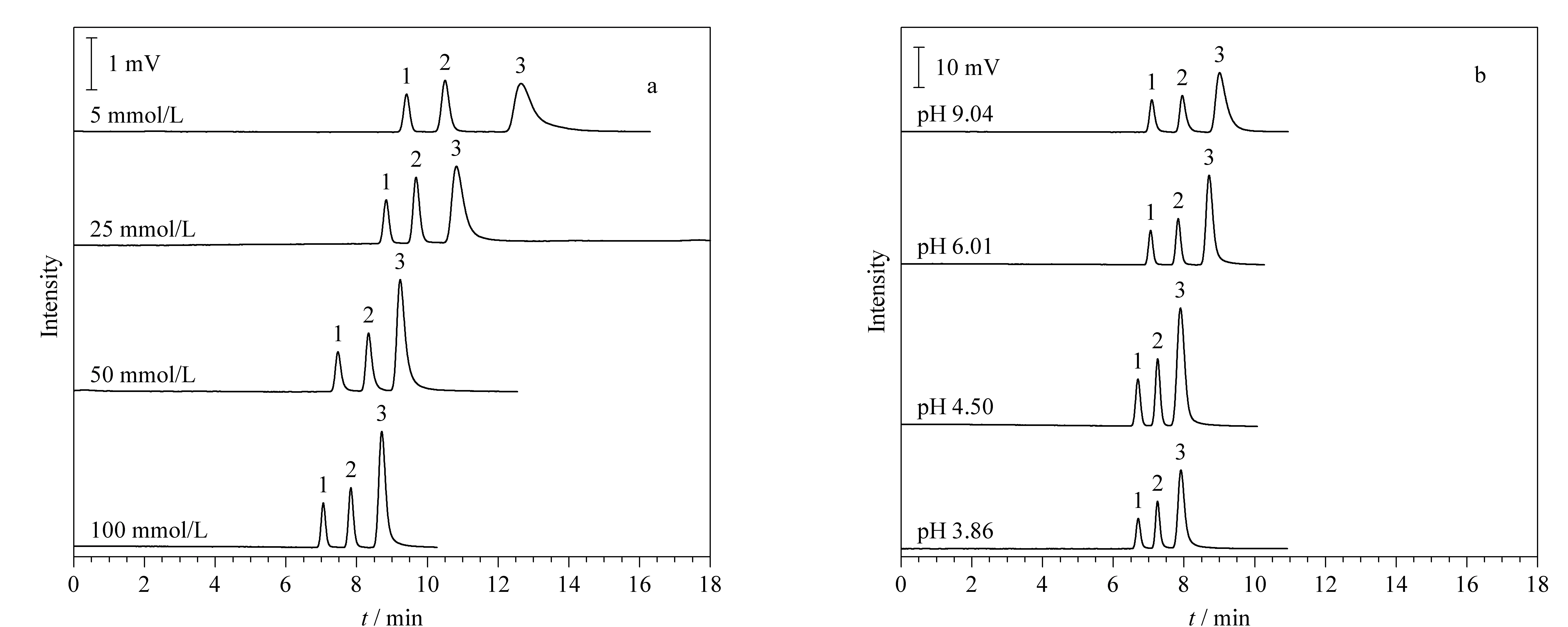
图 8 (a)缓冲盐浓度和(b)缓冲盐pH对580 nm亚微米Cys-VTMS-SiO2毛细管填充柱分离的影响Fig. 8 Effects of (a) buffer concentrations and (b) buffer pHs on the separation ability ofthe capillary column packed with 580 nm submicron Cys-VTMS-SiO2 Column: 20 cm (effective length, 45 cm total length)×100 μm i. d. Mobile phases: (a) ACN-H2O (98∶2, v/v) containing ammonium formate of 5 to 100 mmol/L, pH 6.01; (b) ACN/H2O (98∶2, v/v) containing 100 mmol/L ammonium formate, pH 3.86 to 9.04. Applied voltage: -10 kV; back pressure: 14.4 MPa; detection wavelength: 254 nm. Peak Nos.: 1. toluene; 2. acrylamide; 3. thiourea.
2.4 新型亲水作用毛细管填充柱的应用
通过在pCEC模式下分离核苷类、酚类、胺类和多肽化合物,进一步考察新型毛细管两性离子毛细管填充柱在极性化合物分离中的应用。
2.4.1核苷类化合物的分离
对尿嘧啶、胞嘧啶、尿苷、肌苷、胞苷和尿苷组成的核苷类混合物进行分离,来考察亲水色谱柱的性能。图9a显示这6种化合物在20 min内能被快速有效分离。分离条件为:流动相为pH=6.3的乙腈-25 mmol/L甲酸铵(93∶7, v/v)缓冲溶液;施加电压为-18 kV;压强为15.2 MPa。
2.4.2酚类化合物的分离
在pCEC模式下对酚类化合物进行分离,在11 min内实现了苯酚、邻苯二酚和间苯三酚的快速分离(见图9b),且出峰顺序与其极性相关,极性越大,保留时间越长。分离条件为:流动相为pH=6.3的乙腈-25 mmol/L甲酸铵(98∶2, v/v)缓冲溶液;施加电压为-10 kV;压力为16.3 MPa。
2.4.3胺类化合物的分离
在pCEC模式下对酚类化合物进行分离,在12 min内实现了对甲苯胺、N,N′-二甲基双丙烯酰胺和硫脲的快速分离,出峰顺序与化合物极性相关,极性越大,保留时间越长(见图9c)。分离条件为:流动相为pH=6.3的乙腈-25 mmol/L甲酸铵(98∶2, v/v)缓冲溶液;施加电压为-10 kV;压力为15.8 MPa。
2.4.4多肽类化合物的分离
新型亲水作用色谱柱在ACN-H2O(40∶60, v/v,含25 mmol/L甲酸铵)流动相条件下,实现了对3种多肽混合物的分离,在pCEC模式下,随着施加电压的增大,保留时间缩短,柱效最高可达145 000 plates/m,分离图谱见9d。

图 9 核苷类、酚类、胺类和多肽类化合物在580 nm亚微米Cys-VTMS-SiO2毛细管填充柱上的分离Fig. 9 Separation of (a) nucleosides, (b) phenols, (c) amides, and (d) peptides on the column packed with 580 nm submicron Cys-VTMS-SiO2
3 结论
通过条件优化合成不同粒径的亚微米二氧化硅微球,选择580 nm亚微米粒径大小的微球作为基质,两步反应将两性离子化合物半胱氨酸修饰到微球表面,合成均匀且粒径单分散的新型亚微米两性离子亲水作用色谱固定相(Cys-VTMS-SiO2)。将甲苯、丙烯酰胺和硫脲作为亲水作用色谱柱性能考察的分离物质,以pCEC为平台,通过对电压、缓冲盐浓度和缓冲液pH进行优化,实现化合物的分离研究。将填充柱成功用于核苷类、酚类、胺类和多肽化合物的快速分离,柱效高,为极性化合物和亲水化合物的分离研究提供了新方法和新思路。
