混合型离子交换液相色谱-串联质谱法测定蜂蜜中5种氨基糖苷类抗生素残留
2019-05-29吴云辉严丽娟沈鹭英林立毅徐敦明
吴云辉,严丽娟,沈鹭英,林立毅,张 峰,徐敦明*
(1. 厦门海关检验检疫技术中心, 福建 厦门 361026; 2. 厦门海洋职业技术学院, 福建 厦门 361100;3. 中国检验检疫科学研究院, 北京 100176)
氨基糖苷类抗生素(aminoglycosides, AGs)可以有效抑制细菌的生长和繁殖,在临床上用于治疗绿脓杆菌、革兰氏阴性菌感染,在农业上也被作为动物促生长剂添加到饲料中。AGs具有广谱抗菌特性,但其具有明显的副作用,比如神经肌肉传导阻滞,肠道功能损害以及耳毒性、肾毒性等,并且AGs会在生物组织中富集,残留时间较长。如果消费者食用了AGs残留超标的食品,可能会对身体健康造成危害。欧盟已经明确禁止将AGs作为畜禽促生长添加剂使用,而近年来我国也对AGs在动物源食品中的残留进行了严格控制。在我国,蜂农常不科学地使用AGs防治蜜蜂幼虫病,导致蜂产品中AGs残留超标事件时有发生。因此,加强蜂产品中AGs残留的监控具有非常重要的现实意义。
AGs的主要结构包括氨基糖和碱性1,3-二氨基肌醇,二者通过苷键连接。由于1,3-二氨基肌醇具有碱性多元环己醇结构,AGs通常具有较强的碱性和极性,在普通反相色谱柱上没有保留。传统方法通常在流动相或者进样溶液中加入离子对试剂,如七氟丁酸等,以改善液相色谱的分离效果[1-6]。但是,离子对试剂对质谱检测器的影响较大,特别是离子抑制和离子源污染问题。除了离子对色谱法,亲水液相色谱色谱法(HILIC)也得到了较为广泛的应用,其原理是通过在流动相中加入缓冲盐(如甲酸铵等)以增强AGs在色谱柱上的保留,从而与杂质进行较好的分离[7-14]。
目前,AGs的分离检测仍然是兽药残留检测领域的难点之一,混合保留模式可能是解决这一问题较理想的方法。混合型离子交换液相色谱柱,对于极性化合物的分离具有很好的效果,到目前为止已被成功应用于各类动物源性食品(水产品和肉制品等)中AGs残留的分析[15-17]。
本文采用分子印迹固相萃取柱净化,混合型离子交换液相色谱-串联质谱法进行分离检测,全程不添加离子对试剂,建立了同时测定蜂蜜中5种氨基糖苷类抗生素的方法。该方法具有选择性好、灵敏度高、重复性好等优点,且对质谱仪无污染,适用于蜂蜜中链霉素、双氢链霉素、壮观霉素、卡那霉素和阿米卡星等5种氨基糖苷类抗生素的检测,对于控制抗生素在蜜蜂养殖业中的使用、保障蜂蜜质量安全具有重要意义。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260高效液相色谱仪(美国安捷伦公司); QTRAP 6500三重四极杆-线性离子阱复合质谱仪,配有电喷雾电离(ESI)源(美国AB SCIEX公司);Allegra 64R型高速冷冻离心机(美国Beckman公司); 12通道半自动固相萃取装置、SupelMIP Aminoglycosides分子印迹固相萃取柱(50 mg/3 mL(美国Supelco公司);旋涡混合器(德国IKA公司); Obelisc R色谱柱(100 mm×2.1 mm, 5 μm,美国SIELC公司)。
链霉素、双氢链霉素、壮观霉素、卡那霉素和阿米卡星等5种氨基糖苷类抗生素标准品均购自德国Dr. Ehrenstorfer公司,纯度均大于94%。甲酸、氨水、乙腈和甲醇均为色谱纯;二氯甲烷、磷酸、磷酸氢二钾均为分析纯。实验用水由Milli-Q系统(美国Millipore公司)制得。
50 mmol/L磷酸盐缓冲溶液(pH 8.0)的配制:称取8.7 g磷酸氢二钾,加入950 mL水溶解,用磷酸调节pH值至8.0,用水定容至1 L。
1.2 标准溶液的配制
准确称取适量标准品,分别用水溶解并定容,配制成质量浓度为100 mg/L的标准储备液,于4 ℃避光保存。吸取各标准储备溶液,用水稀释成质量浓度为1.0 mg/L的混合标准储备液,于4 ℃避光保存。以空白基质溶液将混合标准储备液稀释至适当浓度,现用现配。
1.3 样品前处理
1.3.1提取
称取2 g(精确至0.01 g)蜂蜜样品,置于50 mL塑料离心管中,加入5 mL 50 mmol/L磷酸盐缓冲液(pH 8.0)溶液,充分涡旋混合3 min后,以9 000 r/min离心5 min,收集上清液,待净化。
1.3.2净化
SupelMIP Aminoglycosides分子印迹固相萃取柱依次用3 mL甲醇和3 mL 50 mmol/L磷酸盐缓冲溶液(pH 8.0)活化,然后将提取液全部过柱,控制上样流速小于1 mL/min,弃去流出液。依次以3 mL水和1 mL 0.1%(v/v)氨水淋洗,真空抽干5 min,再用1 mL乙腈-水(40∶60, v/v)溶液淋洗,然后真空抽干10 s,再用1 mL二氯甲烷-甲醇(50∶50, v/v)溶液淋洗,然后真空抽干10 s,整个淋洗过程控制流速小于1 mL/min。最后用1.0 mL乙腈-水(20∶80, v/v)溶液(含5%(v/v)甲酸)洗脱至塑料管中,控制洗脱流速小于0.5 mL/min,收集洗脱液,经0.22 μm尼龙滤膜过滤至2 mL塑料进样瓶中,供混合型离子交换液相色谱-串联质谱测定。
1.4 分析条件
1.4.1液相色谱条件
一些高职院校在开设旅游专业时,并没有相应的师资力量作为基本保障,所以不少院校通过挂靠在不同院系下进行招生,这种情况很容易出现课程设置不合理的问题。课程设置不科学不合理就会导致学生难以形成一个完整的旅游专业知识体系,这在一定程度上脱离了高职教育的基本目的,不仅影响到旅游专业毕业生的就业,还严重制约了学生的进一步发展。
色谱柱:Obelisc R色谱柱(100 mm×2.1 mm, 5 μm);柱温:35 ℃;流速:0.4 mL/min;流动相:(A)0.1%(v/v)甲酸水溶液和(B)乙腈;梯度洗脱程序:0~2.0 min, 95%B; 2.0~5.0 min, 95%B~65%B; 5.0~8.0 min, 65%B~5%B; 8.0~14.0 min, 5%B; 14.0~14.1 min, 5%B~95%B; 14.1~20.0 min, 95%B。进样量:10 μL。
1.4.2质谱条件
离子源:电喷雾电离源;扫描方式:正离子扫描;检测方式:多反应监测(MRM)模式;电喷雾电压(IS): 5 500 V;离子源温度(TEM): 550 ℃;雾化气压力(GS1): 345 kPa;辅助气压力(GS2): 345 kPa;气帘气压力(CUR): 241 kPa;碰撞气压力(CAD)模式:中度(medium);入口电压(EP): 10 V;出口电压(CXP): 10 V;滞留时间(dwell time): 20 ms。5种氨基糖苷类药物的监测离子对、聚焦电压(DP)、碰撞能量(CE)见表1。

表 1 5种氨基糖苷类抗生素的质谱参数
* Quantitative ion.
2 结果与讨论
2.1 样品前处理条件的优化
氨基糖苷类抗生素具有碱性,且极性较大,普通的C18反相固相萃取小柱难以将其保留。本实验选择了具有分子印迹功能的SupelMIP Aminoglycosides固相萃取柱,该固相萃取柱是由高度交联的聚合物组成,在聚合物合成中引入模板分子,可选择性地吸附与模板分子结构类似的分析物,因此具有极高的选择性,可有效降低基质干扰,从而获得较低的检出限。实验结果发现,采用分子印迹固相萃取柱萃取后,5种氨基糖苷类药物的回收率均在85%以上,并且因为分子印迹固相萃取柱的选择性较好,只有具有氨基糖苷类似结构的目标化合物才能被洗脱,因此对样品净化具有较好的效果。
采用SupelMIP Aminoglycosides固相萃取柱净化时有推荐的活化、淋洗、洗脱方法,推荐的洗脱液为1 mL乙腈-水(20∶80, v/v)溶液(含5 mmol/L七氟丁酸和1%(v/v)甲酸)。实验对该洗脱液进行了优化,不添加离子对试剂七氟丁酸,同时改变甲酸的体积分数,比较了洗脱液中含1%、2%、5%和10%(v/v)甲酸时目标化合物的回收率。实验发现。当洗脱液中甲酸的体积分数为1%或2%时,只能洗脱部分氨基糖苷类药物,回收率在40%以下;而当洗脱液中甲酸的体积分数≥5%时,5种氨基糖苷类药物可被洗脱,回收率均大于85%。因此,本实验选择乙腈-水(20∶80, v/v)溶液(含5%(v/v)甲酸)作为洗脱溶液。
2.2 质谱条件的优化
在优化条件下,5种氨基糖苷类抗生素基质匹配混合标准溶液(20 μg/L)的MRM色谱图见图1。

图 1 5种氨基糖苷类抗生素基质匹配混合标准溶液(20μg/L)的MRM色谱图Fig. 1 MRM chromatograms of the five aminoglycosides in a matrix matching mixed standard solution (20μg/L)
2.3 色谱条件的优化
由于氨基糖苷类药物的极性较强,采用普通的反相色谱柱没有保留,通常需要在流动相中加入离子对试剂,化合物才能获得较好的保留。在不添加离子对试剂的情况下,通常采用亲水作用色谱柱进行分离,不同色谱柱因固定相种类不同,色谱保留机理存在一定差异[8,11]。Obelisc R色谱柱具有混合型离子交换色谱的机理,分析物与色谱柱固定相存在离子交换的作用机制,即在酸性条件下,碱性物质呈阳离子状态,在固定相上的吸附能力较强,保留较强。由于链霉素、双氢链霉素、壮观霉素、卡那霉素和阿米卡星等5种氨基糖苷类抗生素的pKa均大于7,为强碱性化合物,当缓冲液pH小于pKa时,化合物以离子形式存在。实验分别采用体积分数为0.1%、0.5%和1%的甲酸水溶液和乙腈作为流动相,考察甲酸的体积分数对色谱分离的影响。实验发现,随着甲酸体积分数的增大,5种抗生素的保留时间缩短,但是峰形变差,特别是壮观霉素的色谱峰出现分叉,所有化合物的灵敏度均降低。因此最后选取0.1%(v/v)甲酸水溶液和乙腈作为流动相,5种氨基糖苷类抗生素在Obelisc R色谱柱上可获得满意的保留和峰形。
2.4 线性范围和定量限
取空白蜂蜜基质溶液,加入系列已知量的氨基糖苷类药物,配制链霉素和双氢链霉素质量浓度分别为5、10、20、50和100 μg/L,壮观霉素、卡那霉素和阿米卡星质量浓度分别为20、50、100、250和500 μg/L的系列基质匹配混合标准溶液,然后进行测定,以定量离子的响应峰面积(y)对相应的质量浓度(x, μg/L)进行线性回归。
实验结果表明,5种氨基糖苷类药物在相应的线性范围内定量离子的响应峰面积和样品浓度间具有良好的线性关系,相关系数(r)均大于0.998(见表2)。

表 2 5种氨基糖苷类抗生素的线性范围、回归方程、相关系数和定量限
y: peak area;x: mass concentration, μg/L.
以不含待测组分的蜂蜜为空白基质样品,采用空白样品添加目标化合物的方法,按照1.3节和1.4节步骤处理,以特征离子色谱峰的信噪比(S/N)≥10为方法的定量限,计算5种氨基糖苷类抗生素的定量限。链霉素和双氢链霉素的定量限为5 μg/kg,壮观霉素、卡那霉素和阿米卡星的定量限为20 μg/kg。文献[8]采用Merck ZIC-HILIC色谱柱对蜂蜜中氨基糖苷类药物进行分析,其中这5种氨基糖苷类药物的定量限为7~34 μg/kg。除壮观霉素外,本实验分析的其他4种化合物的定量限均优于文献方法。
2.5 回收率和精密度
分别向空白蜂蜜样品中添加1倍、2倍和5倍定量限水平的混合标准溶液,每个添加水平取6个平行样品,按1.3节和1.4节描述进行处理和测定,计算各个添加水平的回收率和精密度。
由表3可以看出,5种氨基糖苷类药物的平均回收率为75.1%~92.3%,相对标准偏差为4.5%~10.7%,表明该方法具有较好的准确度和精密度,能够满足日常检测的分析要求。
2.6 实际样品分析
采用本方法对市售的15份蜂蜜样品进行检测,均未检出链霉素、双氢链霉素、壮观霉素、卡那霉素和阿米卡星等5种氨基糖苷类抗生素。
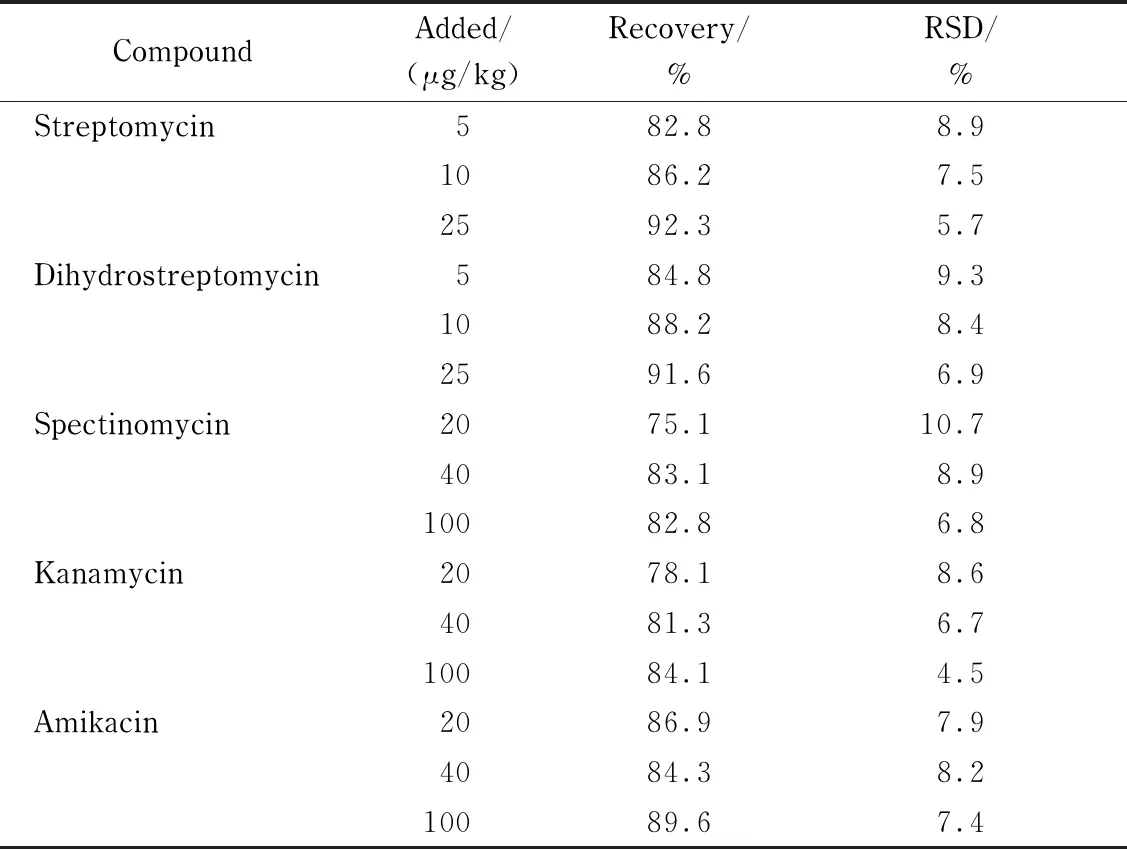
表 3 蜂蜜样品中5种氨基糖苷类抗生素的加标回收率和精密度(n=6)
3 结论
本文建立了混合型离子交换液相色谱-电喷雾电离三重四极杆-线性离子阱复合质谱测定蜂蜜中链霉素、双氢链霉素、壮观霉素、卡那霉素和阿米卡星等5种氨基糖苷类抗生素的检测方法。本方法简便快速,线性范围宽,定量限低,重复性好,全程不添加离子对试剂,有效避免了对质谱仪的污染,各项技术指标均能满足日常检测的分析要求,可用于蜂蜜中5种氨基糖苷类抗生素的测定。
